| CATEGORII DOCUMENTE |
| Bulgara | Ceha slovaca | Croata | Engleza | Estona | Finlandeza | Franceza |
| Germana | Italiana | Letona | Lituaniana | Maghiara | Olandeza | Poloneza |
| Sarba | Slovena | Spaniola | Suedeza | Turca | Ucraineana |
Ontogeneze – vývoj jedince – je dynamický proces, na který lze nahlížet jako na sled kvantitativních a kvalitativních změn, které se uskuteční mezi počátkem (vznikem) jedince a koncem jeho existence. Procesy, které v ontogenezi mohou proběhnout, jsou dány genetickou výbavou, kterou jedinec získá ve chvíli svého vzniku – genotypem. Průběh ontogeneze je organizovaný a koordinovaný v prostoru i čase a u rostlin je významně ovlivňován prostředím, s nímž organizmus žije v neustálé výměně látek, energie a informací, jemuž se neustále přizpůsobuje a které neustále ovlivňuje. Procesy, které skutečně proběhnou, a vlastnosti, které se projeví, tvoří fenotyp jedince.
▼Genetická výbava – genom – je zapsána v primární struktuře DNA (pořadí nukleotidů v polárním řetězci DNA), univerzálním genetickým kódem, diskontinuálně v jednotkách, které se označují jako geny. Genetická výbava je obsažena v každé živé buňce rostliny a uložena v DNA jádra - jaderný genom (v sítkových elementech floému může jádro a jaderná DNA chybět) a v DNA semiautonomních organel – plastidů (plastom) a mitochondrií (chondriom). (Pozn. Termín plastom lze najít v literatuře i jako označení souboru všech plastidů v buňce a chondriom jako označení souboru všech mitochondrií v buňce).
Genetická výbava plastidů a mitochondrií není úplná, plastidy ani mitochondrie současných organizmů nejsou schopny samostatné existence mimo buňku. V evoluci se množství genů z genomu těchto endosymbiotických organizmů přemístily do jádra a byly vloženy do jaderné DNA i do kontextu regulace exprese jaderných genů.
V jádře je DNA rozdělena do určitého počtu lineárních molekul, které spolu s asociovanými proteiny tvoří chromozomy. Počet chromozomů je druhově specifický. Ve sporách, gametofytech a gametách je ve srovnání se sporofytem počet chromozomů poloviční – haploidní (značí se n). V buňkách sporofytu je jaderný genom diploidní (2n), DNA pochází z gamet rodičovských jedinců a je uspořádána ve dvou sadách homologických chromozomů. Rodičovské genomy zpravidla nejsou úplně identické. Informace o stejném funkčním produktu může být zapsána nepatrně pozměněnou sekvencí nukleotidů. Jednotlivé geny se tedy vyskytují v alternativních formách, zvaných alely, které na homologních chromozomech zaujímají stejné místo (lokus). Uvádí se, že u většiny rostlin je v haploidním jaderném genomu 20 tisíc až 30 tisíc genů (zhruba jako u člověka).
▲Kukuřice (Zea mays) má deset různých chromozomů (tj. počet chromozomů v haploidním genomu; 2n = 20), Arabidopsis thaliana pět (2n = 10), Haplopappus gracilis (Asteraceae) má chromozomy dva (2n = 4), rozchodník Sedum suaveolens 320 (2n = 640), kapradina hadí jazyk Ophioglossum reticulatum 630 (2n = 1260).
▼Obsah nukleární DNA je u různých druhů rostlin různý, vyjadřuje se jako množství obsažené v jádře gamety, značí se C a udává se v jednotkách hmotnosti (pikogramy; pg = 10-12 g) nebo v počtu párů bází – obvykle uváděný rozsah je 107 až 1011 párů bází (bp; z angl. base pairs). (1C = množství DNA v jádře gamety nebo v haploidním jádře před replikací). Genom huseníčku thalova Arabidopsis thaliana tvořený 1,25 x108 bp je obecně považován za nejmenší (lze však najít i údaje o ještě menších jaderných genomech, např. u Cardamine amara), genom řebčíku Fritillaria assyriaca s 1,2 x1011 bp patří jistě k největším. Rozdíly ve velikosti haploidního genomu jsou dány především obsahem nekódující DNA, polyploidní druhy mají samozřejmě vyšší obsah DNA. Obsah DNA v jádře s počtem chromozomů nekoreluje.
▼Geny nesou informaci o pořadí aminokyselin v proteinech (geny strukturní) nebo o pořadí nukleotidů v různých druzích RNA (ribozomálních rRNA, transferových tRNA, malých jaderných snRNA, malých jadérkových snoRNA, RNA v telomeráze a mikroRNA).
Geny jsou tvořeny oblastí, která kóduje (určuje) příslušný produkt a oblastmi, které řídí expresi genu (promotor, enhancery). Kódující oblast může být přerušena nekódujícími sekvencemi DNA, zvanými introny, a rozdělena na dvě nebo více částí, zvaných exony. Geny obsahující introny se označují jako složené (geny bez intronů se nazývají jednoduché, vyskytují se především u prokaryot). V intronech mohou ležet oblasti s regulační funkcí.
Nekódující oblasti jaderné DNA mohou mít jiné významné funkce, např. tvoří centromeru (struktura důležitá pro asociaci s cytoskeletem při mitóze nebo meioze) nebo telomery (definují konce chromozomu a spolu s telomerázou zajišťují replikaci celé molekuly DNA).
Termín exprese genu znamená projev jeho informace ve funkčním produktu (proteinu nebo příslušné RNA). Všechny geny nejsou exprimovány současně. Geny, nesoucí informaci nutnou k zajištění základních metabolických a buněčných procesů nezbytných pro existenci buňky, se exprimují stále a jsou označované jako geny konstitutivní neboli provozní (angl. housekeeping genes). K nim patří geny kódující např. katalytické a strukturní proteiny zajišťující všechny fáze respirace, katalytické a strukturní podjednotky ribozomů, rRNA, tRNA a mnoho dalších. Bezproblémová exprese těchto genů je pro průběh ontogeneze základní podmínkou. Geny, které kódují produkty zajišťující specifické metabolické, funkční nebo strukturní vlastnosti diferencovaných buněk, jsou exprimovány selektivně neboli specificky. Některé geny se exprimují jen v určitém pletivu nebo typu buněk, v určité vývojové fázi nebo za určitých vnějších podmínek – např. světlo, tma, nedostatek vody. Exprese těchto genů je vysoce a účinně řízená a kontrolovaná.
3.1 Regulace exprese strukturních genů
Má-li být informace genů kódujících protein, tj. genů strukturních, exprimována, musí být transkribována (přepsána do mRNA) a translatována (přeložena do polypeptidu na ribozomech). Vznik funkčního proteinu závisí též na posttranslačních úpravách proteinu. Každá z těchto etap má několik dalších regulačních úrovní, v nichž působí mnoho různých regulačních mechanizmů. V mnoha životních situacích a vývojových procesech rostlin je neméně důležité expresi genu zastavit a ukončit. Děje se tak nejen na úrovni transkripce ale i odbouráváním existující příslušné mRNA i degradací stávajících proteinů.
3.1.1 Regulace transkripce
Transkripce genu může být regulována na úrovni dostupnosti informace, iniciace transkripce, průběhu transkripce, ukončení transkripce. Primární transkript je v jádře dále upravován a po úpravách transportován do cytoplazmy.
Dostupnost informace uložené v jaderné DNA je ovlivněna řadou mechanizmů, především uspořádáním chromatinu a metylací DNA, další možností je např. působení transpozonů.
▼Chromatin tvoří DNA a asociované strukturní proteiny histonové i nehistonové povahy, které určují uspořádání molekuly DNA v chromozomu a stav chromatinu.
Základní strukturní jednotku chromatinu představují částice zvané nukleozomy, tvořené proteinovým jádrem a úsekem DNA. Jádro tvoří oktamer bazických proteinů, zvaných histony. Histony značené H2A, H2B, H3 a H4 se vyskytují v jádře nukleosomu dvakrát. Kolem jádra je dvakrát ovinut úsek DNA o průměrné délce 200 bp. Z vnější strany se k nukleozomu připojuje histon H1, který může sloužit ke spojení sousedních oktamerů. Na nuklezomech není vázána všechna DNA – volná DNA představuje tzv. hypersenzitivní místa, která jsou rychle přístupná regulačním proteinům, leží v nich promotory genů a jiné regulační oblasti. Nukleozomy spojené DNA tvoří nukloezomový řetězec o tloušťce 10 nm, který se táhne celým chromozomem. Nukleozomový řetězec může tvořit struktury vyšších řádů – chromatinové vlákno o tloušťce 30 nm (solenoid), jehož úseky jsou asociované s vláknitou strukturou tvořenou proteiny nehistonové povahy zvanou nukleární lešení (angl. nuclear scaffold). Úseky vázané na proteinové lešení se označují MAR (z angl. matrix attachement regions). Oblasti MAR jsou odděleny smyčkami volného nukleozomového řetězce o velikosti 5 až 200 kbp, které se nazývají chromatinové domény. Vlákno o tloušťce 30 nm může být spiralizováno ve vlákno o tloušťce 200 nm. Uspořádání základního řetězce do vyšších struktur určuje stupeň kondenzace chromatinu
Chromatin se může vyskytovat jako kondenzovaný heterochromatin, dekondenzovaný euchromatin a v mnoha přechodných stavech mezi těmito extrémy. V nejvyšším stupni kondenzace je chromatin během dělení jádra (mitózy i meiózy). Transkripci umožňuje euchromatin, ne všechna DNA v euchromatinu je však aktivně transkribována.
Kondenzaci chromatinu výrazně ovlivňuje acetylace histonů, tvořících oktamer jádra nukleozomu. Acetylace histonů zamezuje kondenzaci chromatinu a umožňuje vazbu transkripčních faktorů. Acetylaci katalyzují enzymy acetyltransferázy, odstranění acetylové skupiny katalyzují deacetylázy – značené HDACs (z angl. histon deacetylases). Acetylace a deacetylace histonů katalyzovaná příslušnými enzymy a řízení exprese genů, které tyto enzymy kódují, stejně jako aktivace a inaktivace vlastních katalytických proteinů, poskytuje značné možnosti regulace exprese genů. V genomu Arabidopsis bylo identifikováno 16 genů pro HDACs.
Pro vznik heterochromatinu je vedle deacetylace významná metylace histonu H3 na lyzinovém zbytku v pozici 9 – značí se H3-K9me. Na metylovaný lyzin se váže heterochromatinový protein 1 značený HP1. Vazbě slouží doména 50 aminokyselinových zbytků na N-konci HP1, která se označuje jako chromodoména (chromo- z angl. chromatin modification organizer). HP1 umožní vazbu dalších proteinů, mj. deacatyláz a metyltransferáz, které dále modifikují histony. Modifikované histony umožní interakci s dalšími proteiny a vznik tzv. zavřeného chromatinu (angl. closed chromatin). HP1 umožní také vazbu metyltransferáz, které metylují DNA.
Metylace DNA a její odstranění – demetylace – jsou další mechanizmy regulující dostupnost informace uložené v DNA. U rostlin se metyluje cytozin (obr. 3.1.) v postavení CpNpG (cytozin, p – fosfodiesterová vazba mezi fosfátem a deoxyribózou sousedních nukleotidů, jakýkoli nukleotid, guanin). Metylovaná DNA se netranskribuje ale replikuje se (informace se neztrácí ale neprojeví se), metylace se přenáší při mitóze i meióze. Je-li mateřský řetězec metylován, je při replikaci metylovám i řetězec dceřinný. Metylovaný cytozin je dále rozeznáván specifickými proteiny, z nichž některé umožní vazbu deacetyláz a deacetylaci přilehlých histonů, jiné umožní vazbu HP1. HP1slouží navázání dalších metyláz a deacetyláz histonů nutných pro vznik heterochromatinu.
Obě alternativní cesty vzniku heterochromatinu (vazba HP1 a komplexy PcG) zahrnují podobné mechanizmy – deacetylaci a metylaci histonů.
Další významné činitele ovlivňující expresi genů na úrovni dostupnosti informace představují úseky DNA, zvané transpozony. Transpozony jsou schopny se přemísťovat a měnit organizaci jaderného genomu.
▲Transpozony jsou ohraničené specifickými sekvencemi opakovanými v obráceném pořadí. Tyto sekvence rozeznává enzym transposáza a katalyzuje vyštěpení mobilního úseku DNA – transpozonu. Transpozon je vložen na jiné místo genomu a může kladně, záporně, v čase nebo lokálně ovlivnit expresi genů této oblasti. Předpokládá se, že transpozony zvyšují proměnlivost genomu a adaptabilitu jedince na evoluční tlaky.
Metylace DNA a vazba komplexů Polycomb zapříčiňují dědičné, avšak revertovatelné změny exprese genů (celková genetická informace se nemění, změny nejsou založeny na změnách charakteru mutací). Změny tohoto charakteru mohou výrazně ovlivnit fenotyp jedince i průběh ontogeneze. MetylaceDNA a vazba komplexů Polycomb se označují jako epigenetické mechanizmy exprese genů. (Vedle zmíněných mechanizmů existují další epigenetické mechanizmy.).
3.1.2 Primární transkript a jeho úpravy
Vlastní transkripce jaderných genů je řízena vazbou regulačních proteinů na regulační elementy genu. Regulační elementy jsou krátké sekvence (asi 20 pb) na řetězci DNA, který se přepisuje, a označují se jako cis-elementy nebo boxy. Možnosti zahájení nebo ukončení transkripce i regulace její rychlosti jsou určeny charakterem, počtem a uspořádáním regulačních elementů v promotorové oblasti daného genu i regulačních elementů mimo promotor. Promotorová oblast (řádově stovky bp) leží před počátkem transkripce (tzv. proti proudu, angl. up stream) a tvoří ji obvykle několik regulačních elementů. Počátkem transkripce se rozumí první transkribovaný nukleotid, jeho pozice se označuje se +1 (obr. 3.2.). Regulační oblasti mohou ležet i v oblasti intronů příslušného genu (nekódujících sekvencích DNA, tzv. po proudu, angl. down stream). Na cis-elementy se vážou regulační proteiny, zvané trans-faktory. Regulační proteiny mohou na transkripci působit pozitivně i negativně. Tyto proteiny jsou kódovány vlastními strukturními geny, jejichž exprese podléhá další regulaci, jsou syntetizovány na cytoplazmatických ribozomech a transportovány do jádra. Tyto procesy poskytují další možnosti regulace a kontroly exprese genů.
Další regulační oblasti mohou ležet mimo promotor v oblastech vzdálených až několik tisíc bp před počátkem transkripce i za ním. Tyto oblasti ovlivňují transkripci určitého genu kvantitativně kladně nebo záporně, tj. transkripci zrychlují nebo zpomalují. Pokud tyto vzdálené regulační oblasti působí zrychlení transkripce, označují se jako zesilovače neboli enhancery
Základní cis-element promotorové oblasti strukturních jaderných genů je tzv. TATA box (zvaný též Hognessův, bohatý na báze adenin a thymin), lokalizovaný obvykle mezi 26. až 34. bp před počátkem transkripce. Význam tohoto elementu spočívá především v tom, že umožňuje vazbu DNA-dependentní RNA-polymerázy II na transkribovaný (tj. negativní) řetězec DNA. Tento enzym katalyzuje vlastní polymeraci nukleotidů a tvorbu primárního transkriptu. Polymeraci rRNA a tRNA katalyzují RNA-polymerázy I a III, uspořádání promotoru je jiné. Před TATA boxem (v oblasti asi -75 až -80 pb) leží box značený CAAT, který zvyšuje sílu promotoru, a další elementy promotoru.
Na základní elementy promotoru se vážou obecné neboli generální transkripční faktory. Obecné transkripční faktory se vyskytují ve všech buňkách a rozeznávají elementy promotorů všech genů, které jsou transkribovány RNA-polymerázou II. Typů těchto regulačních proteinů je relativně malý počet, vyskytují se však v jádru ve značném množství.
Geny, které se exprimují jen za určitých podmínek, mají v oblasti promotoru specifické cis-elementy, např. element značený LRE (z angl. light regulated element) zajišťuje možnost řízení transkripce genu světelným signálem, geny s elementem AuxRE jsou řízeny signálem auxinu (z angl. auxin regulated element). Na specifické elementy promotoru se vážou speciální transkripční faktory, které ovlivňují transkripci pozitivně nebo negativně (indukují, stimulují nebo snižují až blokují transkripci). Tyto regulační proteiny se vyskytují ve velikém množství typů avšak v jednom jádru může jen malý počet molekul znamenat počet dostatečný. Tvorba specifických regulačních proteinů je indukovatelná odpovídajícím podnětem, např. produktem genu, který je v hierarchii postaven výše a určuje typ pletiva, nebo složkou přenášející světelný signál. Transkripci jednoho genu řídí větší počet různých regulačních proteinů, jeden typ regulačního proteinu může ovlivňovat transkripci většího počtu genů.
Transkripční faktory mají nejméně dva strukturně i funkčně rozdílné motivy, dané konformací proteinu. Jeden motiv jim dává schopnost rozeznat a vázat se na určité úseky DNA, druhý zajišťuje vazbu s dalším regulačním proteinem, který může ale nemusí být schopen se vázat na DNA. Transkripční faktory jsou obvykle kódovány rodinou genů a vyskytují se ve větším množství podobných proteinů. Tvorba dimerů poskytuje možnost vzniku mnoha kombinací, které rozeznávají různé regulační sekvence na DNA.
▼ Uvádí se, že z asi 26000 genů Arabidopsis jich přibližně 15000 kóduje transkripční faktory.
Strukturní motivy, které dávají schopnost transkripčním faktorům a regulačním proteinům vázat se na DNA mají různý charakter a podle nich se mohou proteiny řadit do skupin. Následující seznam významných rodin TF samozřejmě zdaleka není úplný.
Skupina s motivem HTH = helix – otáčka (z angl. turn) – helix; tyto transkripční faktory se vážou na DNA jako homo- nebo heterodimery.
Skupina s motivem HMG – proteiny mají tři α-helixy, z nichž dva se vážou na DNA a deformují ji tak, že se v těsné blízkosti vytvoří místo pro vazbu dalšího transkripčního faktoru, který zároveň vytvoří komplex s proteinem HMG; značí se, podle jejich chování při elektroforéze (z angl. high mobility group).
Skupina s motivem zinkového prstu – atomy Zn interagují se čtyřmi aminokyselinovými zbytky proteinu (histidinu nebo cysteinu), peptidový řetězec mezi nimi tvoří specifickou prstovitou nebo kruhovou strukturu; tento typ transkripčních faktorů zpravidla netvoří dimery. U rostlin je známo více než 50 regulačních proteinů se tohoto typu, v oblasti prstu je častá sekvence aminokyselinových zbytků QALGGH(glutamin, alanin, leucin, glycin, glycin, histidin). Proteiny se Zn-prstem často působí ve vývojových procesech.
Skupina s motivem leucinového zipu (LZ) – v oblasti α helix je každý sedmý aminokyselinový zbytek leucinový – tato struktura slouží tvorbě dimeru; proteiny mají bazický charakter, značí se bZip.
Skupina s homeodoménou (HD) je kódována geny s homeoboxem – charakteristickou sekvencí 180 pb (homeobox, HB), určující pořadí 60 aminokyselin v peptidu, které se skládají do specifické tříhelixové struktury, která specificky interaguje s DNA a spouští kaskády dalších genů. Je-li u živočichů gen s homeoboxem nefunkční (mutovaný nebo umlčený), může se na jeho místě projevit funkce jiného homeotického genu. Tyto geny hrají úlohu především ve vývojových procesech, poprvé byly poznány a popsány u octomilky (při určité poruše se u Drosophila tvoří noha na místě tykadla; jev zvaný homeóze). U rostlin geny s homeoboxem nemají homeotické efekty.
U rostlin se vyskytuje unikátní rodina transkripčních faktorů,v nichž je homeodoména bezprostředně následována leucinovým zipem, který umožňuje dimerizaci. Podle dalších vlastností, jako jsou charakter domény pro vazbu na DNA, další obecné sekvence a fyziologické funkce, se rodina dělí do čtyř podrodin – I až IV. Tyto transkripční faktory hrají důležitou úlohu především v diferenciačních a vývojových procesech.
Jiná kategorizace transkripčních faktorů vychází z názvů genů, které kódují proteiny se stejnými nebo velmi podobnými vazebnými motivy, např. MADS (kap. 9.2.1), GARP (kap. 7.1.3.5), GRAS (kap. 7.1.3.6), YABBI (kap. 7.1.3.5), EREBP (kap. 6.5.2), NAC (kap. 7.3.1), MYB (6.3.2),WRKY (kap. 11.).
Iniciace transkripce strukturních genů závisí na přítomnosti obecných transkripčních faktorů TFII (transkripční faktory pro RNA-polymerázu II, dále se rozlišují velkými písmeny D, B, A, F, E, H), které se postupně na TATA box vážou a s RNA-polymerázou II vytvoří iniciační komplex (obr. 3.3.).
▼ Při iniciaci transkripce se na DNA jako první váže TFIID – multiproteinový komplex, jehož jedna podjednotka (TBP z angl. TATA binding protein) rozezná TATA box a zprostředkuje navázání komplexu. Navázání TFIIB a TFIIA vazbu stabilizuje a umožní navázání RNA-polymerázy II na řetězec DNA a vazbu dalších jednotek iniciačního komplexu – TFIIF a TFIIE. Pro vlastní polymeraci je nutné uvést polymerázu do aktivního stavu. RNA-polymeráza II je aktivována fosforylací několika serinových a threoninových zbytků na C-konci polypeptidu jedné z jejích podjednotek. Fosforylaci katalyzuje TFIIH, který má kinázovou aktivitu. Po zahájení polymerace se iniciační komplex rozpadá.
Pro průběh transkripce je nezbytná aktivní (fosforylovaná) RNA-polymeráza II a dostatečné množství ATP, CTP, GTP a UTP.
Vznikající nascentní řetězec RNA je na 5´-konci ošetřen čepičkou (navázání 7-metylguanylátu; obr. 3.4.b) a po délce asociovanými proteiny, které zabrání nevhodným interakcím s jinými molekulami (včetně vlastního řetězce nebo s RNA-polymerázou II) a hrají významnou úlohu při další úpravě hnRNA (heterogenní nukleová RNA, tj. primární transkript) v jádře – sestřihu.
Ukončení transkripce je signalizováno specifickou sekvencí nukleotidů na 3´-konci DNA, konec řetězce je ošetřen polyadenylací, tj. navázáním různého počtu A (obr. 3.4.a).
Polyadenylaci zajišťuje komplex, tvořený endonukleázou a poly(A)polymerázou, který rozezná signální sekvence na 3´-konci hn-RNA (terminační kodon UAG a sekvence v 3´-UTR = netranslatovaná oblast na 3´-konci; z angl. untranslated region), RNA štěpí a naváže 50 až 250 (i více – údaje z různých zdrojů se liší) adenosinových zbytků.
Počet navázaných adenylů ovlivňuje funkční dobu a stabilitu molekuly mRNA (chrání ji proti působení exonukleáz v jádře i cytoplazmě). Poly(A)-konec je také významný pro transport mRNA nukleárním pórem do cytoplazmy.
Primární transkript, označovaný jako hn-RNA (heterogenní nukleární RNA nebo pre-mRNA), je v jádře dále upravován procesem zvaným sestřih, v němž jsou odstraněny introny (nekódující oblasti), a vzniká mRNA Sestřih (angl. splicing) může probíhat jen jedním způsobem, tzv. konstitutivně, nebo alternativně a z jednoho genu mohou být odvozeny odlišné mRNA (posléze i odlišné proteiny).
Editace je další možnou úpravou mRNA. Editace RNA zahrnuje modifikace určitých nukleotidů v RNA, která způsobí, že nukleotidový triplet určující aminokyselinu je změněn a při translaci pak jinak interpretován. Syntetizovaný protein má na odpovídajícím místě jinou aminokyselinu, což může ovlivnit jeho funkci, např. schopnost vázat ligand. Editace RNA zvyšuje diversitu (rozmanitost) produktů, kódovaných genomem.
Příkladem editace může být deaminace cytosinu na uracil, působená proteinovým komplexem, zvaným editozom, který obsahuje příslušnou deaminázu. Editace může změnit sekvenci CGG, určující tryptofan, na to UGG, odpovídající argininu. Deaminace může změnit adenin na inozin, který je rozeznáván jako guanosin a páruje se s cytosinem (místo uracilu). Editace může měnit kodon AUG určující začátek translace, triplet ACG určující threonin může být změněn na AUG a určit začátek translace. Editace může nově určit také konec translace.
Transport mRNA z jádra do cytoplazmy je proces, v němž je prověřena kvalita produktu transkripce a představuje další regulační úroveň exprese genu. Transportu různých typů RNA a ribozomálních podjednotek z jádra do cytoplazmy a transportu proteinů oběma směry slouží jaderné póry.
▲ Jaderný pór je komplexní proteinová struktura o hmotnosti asi 124 MDa, vnějším průměru asi 120 nm a vnitřním asi 40 nm, tvořená z nejméně 120 různých typů proteinů zvaných nukleoporiny. Je lokalizovaná mezi vnější vnitřní jadernou membránou a propojuje cytoplazmu s obsahem jádra (obr. 3.5.). Osm kanálů (průměr 9 nm) na periferii póru umožňuje neselektivní transport malých hydrofilních molekul difúzí. V centrálním kanálu je struktura, která umožňuje aktivní a selektivní transport proteinů oběma směry a transport různých typů RNA i podjednotek ribozomů z jádra do cytoplazmy. Mechanizmus přenosu je závislý na rozeznání specifických signálních sekvencí a dodání energie.
3.2 Translace
Obecně se uvádí, že regulace exprese jaderných genů na úrovni transkripce má pro vývojové procesy rostlin základní význam. Nicméně i regulace exprese genů na úrovni posttranskripční, tj. translace a tvorby funkčních proteinů představují úrovně významné a poskytují možnost uplatnění dalších řídicích mechanizmů. Předností těchto mechanizmů je rychlost, s jakou se změny exprese genů uskutečňují.
Řízení nejen vývojových ale i jiných životních procesů (např. rekce na působení biotických i abiotických stresorů) na úrovni translace umožňuje posttranskripční umlčování genů (značí se PTGS, z angl. post transcriptional gene silencing). Translace může být dočasně reverzibilně blokována vazbou regulačních proteinů na oblast 5´-konce mRNA nebo zcela zamezena inaktivací a odbouráváním mRNA. Odbourávání nukleových kyselin, tj. hydrolýzu vazeb mezi nukleotidy, katalyzují enzymy (často komplexního charakteru) zvané nukleázy (štěpí NK v jádře i v cytoplazmě). Podle toho, zda odbourávají řetězec nukleových kyselin od konce nebo štěpí řetězec na kratší úseky, jsou klasifikovány jako exonukleázy nebo endonukleázy.
Významnou úlohu při specifické inaktivaci mRNA hrají proteinové komplexy, jejichž složkou jsou mikroRNA
▲ MikroRNA – miRNA – jsou RNA o délce 21 nukleotidů (nt), s regulační funkcí. Výskyt a mechanismus působení miRNA je obecný, u rostlin má některé charakteristické rysy. MiRNA jsou součástí komplexů, které blokují translaci a štěpí mRNA, s jejíž částí je příslušná miRNA komplementární. Dosud bylo u rostlin identifikováno několik set různých miRNA.Tento způsob posttranskripčního umlčování genů je častý ve vývojových procesech, především v regulaci exprese genů kódujících transkripční faktory (uplatňuje se i v jiných reakcích, např. na působení stresorů). U rostlin miRNA vznikají z delších jednořetězcových RNA (o délce 50 až 350 nt), které jsou kódovány v jádře, transkribovány RNA-polymerázou II, ošetřeny čepičkou a poly(A)-koncem. Jedna miRNA může být kódována jedním genem nebo malou rodinou genů. Prekurzorová miRNA (pre-miRNA) je u rostlin dále zpracovávána v několika krocích v jádře (obr. 3.6.). V určité oblasti se báze pre-miRNA spárují a vytvoří smyčku neboli vlásenku (angl. hairpin). Z oblasti spárovaných bází enzymatický komplex s funkcí endonukleázy vyštěpí úsek o délce 21 bp. Tento endonukleázový komplex se značí DCL1 (z angl. Dicer like 1; jméno podobné endonukleázy Dicer je odvozeno z angl. dice = krájet na kostky). Vyštěpený duplex je dále na 3´-koncích metylován a transportován z jádra do cytoplazmy. V cytoplazmě jsou řetězce odděleny a jednořetězcová miRNA je inkorporována do proteinového komplexu, zvaného RISC (z angl. RNA-induced silencing complex). Jeho důležitou složkou je protein AGO1 (ARGONAUTE 1), který slouží k rozpoznání, vazbě a indukci štěpení příslušné cílové mRNA (angl. target mRNA). U rostlin se RISC váže častěji na sekvence mRNA kódující protein než na sekvence netranslatované (UTR).
Vlastní translace – biosyntéza polypeptidového řetězce podle informace nesené sledem nukleotidů mRNA – probíhá v cytoplazmě na ribozomech, makromolekulárních komplexech tvořených rRNA a proteiny. Translace je závislá na přítomnosti mnoha dalších strukturních, katalytických a regulačních proteinů, nezbytné jsou všechny typy tRNA, dostatek proteinových aminokyselin a energie ve formě ATP a GTP.
▼Ribozomy jsou složeny ze dvou základních částí, malé podjednotky (40S; S – Svedbergova jednotka – udává velikost na základě rychlosti sedimentace v sacharózovém gradientu, 1S = 10-13s) a velké podjednotky (60S).
Sekvence tří nukleotidů na mRNA – kodon – určuje jednu aminokyselinu. Kodonů je 64, proteinových aminokyselin 20 – většina aminokyselin je tedy určena více než jedním kodonem – kód je tzv. degenerovaný. Jen jeden kodon mají pouze methionin a tryptofan. Aminokyseliny jsou na místo syntézy přinášeny transferovými RNA (velikost 70 až 90 nt).
tRNA na svém 3´-konci vážou aminokyselinu určenou sekvencí tří nukleotidů zvanou antikodon, která se nachází na jiném místě tRNA. Některé aminokyseliny mají více než jednu tRNA (tzv. izoakceptorové tRNA), určité tRNA rozeznávají a vážou se na více než jeden kodon (31 tRNA rozeznává 61 kodonů určujících 20 aminokyselin; tRNA tolerují neúplnou shodu v třetím nukleotidu kodonu, tzv. kolísavé párování bází; angl. wobble base pairing).
Na ribozomu se antikodon tRNA páruje s odpovídajícím kodonem na mRNA a tato interakce zajistí navázání odpovídající aminokyseliny na C-konec syntetizovaného peptidu. Navázání aminokyseliny na tRNA katalyzují enzymy zvané aminoacyl-tRNA-syntetázy, specifické pro jednotlivé proteinové aminokyseliny. Aminokyselina musí být předem aktivována ATP (zůstává v komplexu s AMP). Energie slouží nejprve ke vzniku vazby mezi aminokyselinou a tRNA (AMP se v tomto kroku uvolní), později je na ribozomu využita ke kovalentnímu připojení aminokyseliny na syntetizovaný peptidový řetězec.
▲K iniciaci translace jsou třeba regulační strukturní proteiny, zvané iniciační faktory translace značené eIF (z angl. eukaryotic initiation factor) a dále specifikované číslem a písmenem (např. eIF4A, eIF4B eIF4E). Některé eIF jsou složeny z několika podjednotek. Translace je iniciována tím, že se vytvoří ternární iniciační komplex, složený z eIF2, specifické iniciační tRNA nesoucí methionin Met-tRNAMet a GTP. Na ternární komplex se navážou další eIF (eIF1A a velký faktor eIF3, tvořený několika podjednotkami) a umožní vazbu malé podjednotky ribozomu (40S). Jiné faktory – z rodiny eIF4 se navážou na 5´-konec mRNA ošetřený čepičkou a umožní interakci mRNA s malou podjednotkou ribozomu, iniciátorovou Met-tRNAMet a eIF, které s nimi byly v komplexu (některé eIF se při interakci uvolní). Malá podjednotka s iniciátorovou Met-tRNAMet se pohybují po mRNA a hledají iniciační kodon translace - AUG pro methionin (tzv. skenování mRNA). Po jeho nalezení se naváže velká podjednotka ribozomu, GTP je hydrolyzován, eIF2 s GDP se uvolní a mRNA s Met-tRNAMet se dostanou do správného vzájemného postavení.
Výměna GDP za GTP na uvolněném eIF2 rozhoduje o jeho možném působení v příští iniciaci translace, vyžaduje působení dalšího proteinu (eIF2B) a otevírá prostor pro další regulační kroky.
Ribozom se pohybuje po mRNA a čte ji ve směru 5´→3´, peptid je syntetizován od N-konce k C-konci. Pro syntézu peptidu jsou významná tři vazebná místa na velké podjednotce ribozomu: P (důležité pro iniciaci translace, při elongaci váže peptidyl-tRNA a poskytuje konec vznikajícího peptidu pro vazbu dalšího aminokyselinového zbytku), A (aminoacyl-tRNA; váže kodon pro další aminokyselinu na mRNA a umožňuje vazbu aminoacyl-tRNA s odpovídajícím antikodonem) a E (z angl. exit; váže tRNA po té co byl aminokyselinový zbytek navázán na rostoucí peptid). Pro elongaci je nutná přítomnost elongačního faktoru eEF1 (z angl. eukaryotic elongation factor). Pro vytvoření peptidové vazby mezi koncem peptidu a aminokyselinovým zbytkem na tRNA je důležitá rRNA, integrovaná v komplexu velké podjednotky ribozomu.
Jeden řetězec mRNA může být translatován několika ribozomy současně. Další ribozom nasedá, když je z mRNA přečteno 80 až 100 nukleotidů – vznikají polyzomy.
Konec translace je signalizován tzv. stop kodony na mRNA (UAA, UAG, UGA). Na ribozom se do vazebného místa A naváže terminační komplex, tvořený terminačními faktory (značené eRF, z angl. eukaryotic releasing factor) a GTP, který pozmění funkci peptidyltransferázy tak, že místo aminokyseliny váže vodu, polypeptid a poslední tRNA se uvolní, velká a malá podjednotka disociují a mohou sloužit další translaci.
Proteiny nezbytné k zahájení (iniciaci) translace, k jejímu průběhu (elongaci), ukončení (terminaci) a proteiny, které se vážou na vznikající neboli nascentní polypeptid, poskytují možnost působení dalších regulačních mechanizmů. Proteiny určené k dalším úpravám, např. glykosylaci, integrální membránové proteiny, proteiny určené do vakuol nebo k transportu do buněčné stěny mají příslušnou určující signální sekvenci, jejich translace se dočasně zastaví a pokračuje až po navázání ribozomu na membránu endoplazmatického retikula.
3.3 Posttranslační úpravy proteinů
▲ Jednou z nejčastějších a zároveň nejčasnějších úprav proteinu je odstranění počátečního methioninu. Odstranění nebo setrvání methioninu je obvykle určeno aminokyselinovými zbytky v následujících pozicích a odstranění probíhá ještě na nascentním řetězci působením peptidázy, která je vázána na ribozom. Další časté úpravy proteolytického charakteru se týkají odstranění signálu pro lokalizaci po tom, co byl protein transportován do odpovídajícího kompartmentu, nebo odstranění segmentu spojené s inkorporací do příslušné struktury.
Správné prostorové uspořádání polypeptidových řetězců představuje další důležitou úroveň regulace exprese strukturních genů. První uspořádání polypeptidu do struktur vyššího řádu probíhá již během translace. Při tvorbě správné konformace proteinů, sestavení podjednotek v proteinové komplexy, při správné lokalizaci proteinů v buňce i při jejich degradaci hrají významnou roli pomocné (asistující) proteiny – chaperony, chaperoniny a energie ATP. Není-li protein správně složen, je rozeznán a určen k likvidaci.
Mezi významné posttranslační úpravy proteinů patří především fosforylace, glykosylace, prenylace a vazba různých ligandů, např. Ca2+, kalmodulinu nebo inozitoltrifosfátu (IP3). Existují i další důležité funkční modifikace jako je např. tvorba disulfidových můstků apod. Tyto úpravy ovlivňují funkční vlastnosti nebo lokalizaci proteinů v buňce a umožňují rychlé reakce na některé signály.
▼ Fosforylace proteinu – přenesení fosfátu (H2PO3-) z ATP nebo GTP na protein – znamená zvýšení vnitřní energie jeho molekuly a je obvykle doprovázena výraznými změnami konformace. Změny konformace mohou ovlivnit katalytickou aktivitu proteinu, schopnost tvořit komplexy s dalšími proteiny stejně jako s ligandy neproteinového charakteru nebo odkrýt místo nesoucí signál pro lokalizaci v jiném kompartmentu buňky. Vazbou fosfátu protein získává záporný pól, což může ovlivnit lokalizaci proteinu v buňce a dostupnost nových substrátů nebo ligandů. Stejně významně může vlastnosti proteinu modifikovat odstranění fosfátu, tj. defosforylace. V proteinech je fosfát vázán na zbytky polárních aminokyselin – serinu, threoninu, tyrozinu a histidinu.
Fosforylaci katalyzují enzymy zvané proteinové kinázy. Enzymy, které odštěpují fosfátovou skupinu se nazývají fosfatázy (enzymy, které přemisťují fosfát v rámci jedné molekuly se nazývají fosfomutázy).
Fosforylační kaskády, v nichž proteinové kinázy fosforylují a tím aktivují další proteinové kinázy, jsou důležitou součástí přenosu signálu.
▼Glykosylace – navázání oligosacharidového řetězce na protein – probíhá v lumenu endoplazmatického retikula a významně ovlivňuje vlastnosti proteinů. Může určovat specifickou interakci s membránovými strukturami nebo schopnost tvořit komplexy s jinými proteiny, ovlivňovat konformaci proteinu a tím jeho funkci, např. enzymatickou aktivitu (N-glykosylace) i chránit protein před proteolýzou. Oligosacharidový řetězec (tvořený obvykle 14 sacharidovými zbytky) je na lumenální straně ER vázán na dolichol (polyizoprenoid zakotvený v membráně). Protein syntetizovaný na ER se do lumenu zanořuje a oligosacharid je přenesen na aminoskupinu asparaginového zbytku – N-glykosylace. Glykosylovány jsou zbytky asparaginu v kontextu asparagin-A-serin/threonin, kde A je zbytek jakékoli aminokyseliny. Reakci katalyzuje enzym oligosacharid/proteintransferáza, který je lokalizován také na lumenální straně ER. Sacharidový řetězec může podléhat dalším úpravám v lumenu ER a v Golgiho aparátu.
▼Prenylace je navázání geranylgeranylu (čtyř izoprenových jednotek, 20C) nebo farnezylu (tří izoprenových jednotek. 15C) na cysteinový zbytek na C-konci proteinu (CAAX, kde X je jakákoli aminokyselina kromě leucinu nebo fenylalaninu; aminokyselinové zbytky za cysteinem jsou odštěpeny, na cystein je přes atom síry kovalentně navázán izoptenoid a koncová karboxylová skupina cysteinu je metylována). Tato posttranslační úprava dává schopnost periferním proteinům vázat se na membránu. Podobnou funkci má také navázání zbytku mastných kyselin, např. kyseliny palmitové – palmitoylace.
3.4 Degradace regulačních proteinů
Konečnou fázi regulace exprese strukturního genu a významný mechanizmus regulace metabolických i vývojových procesů (např. odbourávání cyklinů v průběhu buněčného cyklu.) představuje degradace proteinu. Proteolýza v buňce probíhá prakticky neustále. Současně poskytuje aminokyseliny pro syntézu nových nezbytných proteinů. Proteiny jsou degradovány v různých buněčných kompartmentech – vakuolách, cytosolu, jádře, chloroplastech a mitochondriích, různými a pro kompartment charakteristickými cestami. Proteiny zásobního charakteru jsou odbourávány ve vakuolách (původně proteinová tělíska), kam jsou transportovány proteázy lysozomálního charakteru.
Doba funkční existence proteinu je často daná už jeho složením. Brzká degradace některých cytoplazmatických proteinů je určena přítomností specifických signálních sekvencí (např. sekvencí označovanou PEST; P = prolin, E = glutamin, S = serin, T = threonin). Jako signály k degradaci mohou působit také některé hydrofobní oblasti, které jsou normálně uloženy uvnitř proteinu a během denaturace (poškození) proteinu se obnaží.
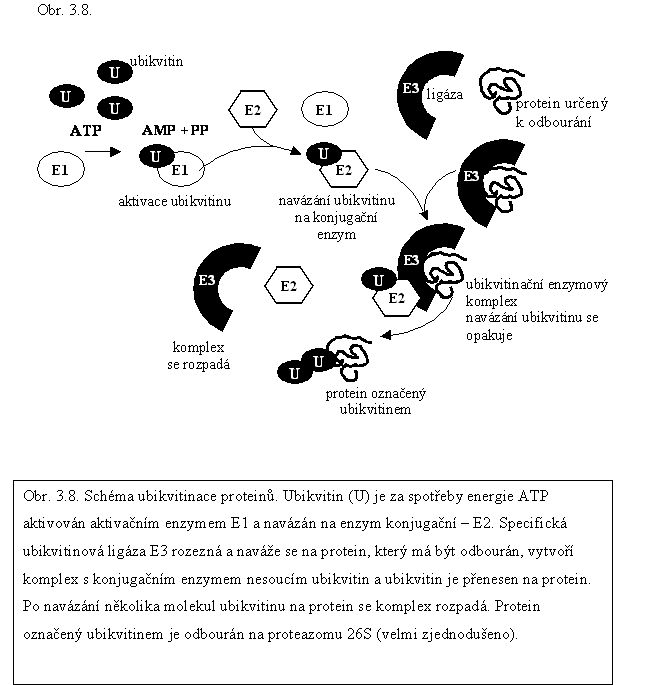
Proteiny regulačního, strukturního i katalytického charakteru jsou degradovány po velmi spolehlivém výběru, aby nedošlo k odbourávání proteinů funkčních. Proteiny určené k odbourání jsou označeny navázáním několika molekul polypeptidu zvaného ubikvitin. Navázání je katalyzováno substrátově specifickými ubikvitinovými ligázami E3 (obr.3.7.). Selektivní odbourávání polyubikvitinovaných (ubikvitilovaných) proteinů v cytosolu i v jádře probíhá na komplexu zvaném proteazom 26S a je závislé na dodání energie ve formě ATP.
▼Proteazom 26S (1,5 až 2 MDa; obr. 3.7.) je proteinový komplex, tvořený složkami, které jsou kódované asi jedním stem strukturních genů. Základní část 20S (angl. core) tvoří dutý válec, složený ze 4 kruhových struktur nad sebou. Každá kruhová struktura je tvořena 7 proteiny. Proteiny dvou centrálních kruhů se označují jako podjednotky β a na jejich vnitřní straně jsou místa s vlastní proteázovou aktivitou (tím jsou chráněny proteiny vně proteazomu). K centrálním dvěma kruhům přiléhají dva kruhy, tvořící okraje válce, složené z podjednotek α. Jejich funkce je především strukturní. Slouží k interakci s koncovými regulačními podjednotkami – komplexy 19S. Tyto dva komplexy zajišťují selektivní přístup proteinů do katalytické části proteazomu. Komplex 19S je tvořen 19 proteiny a má dvě části – část bazální a tzv. víčko. Bazální část přiléhá ke kruhům podjednotek α, je tvořena 10 proteiny, z nichž šest má ATPázovou aktivitu. Vazba ATP je pro asociaci podjednotky 19S s jádrem 20S nezbytná, hydrolýza ATP zajišťuje energii pro otevření centrálního válce, pro narušení proteinových konformačních struktur vyššího řádu a vstup rozvinutého polypeptidového řetězce dovnitř proteazomu, kde je štěpen. Víčko (angl. lid) přiléhá k základní části z vnějšku a jeho funkcí je rozeznávat proteiny určené ke štěpení. Proteiny určené k odbourání, musí být označené ubikvitinem.
Ubikvitin je obecně se vyskytující (od kvasinky po člověka) malý protein, tvořený řetězcem 76 aminokyselin, jejichž sled je silně konzervovaný. Alespoň čtyři nebo více molekul ubikvitinu se váže na zbytky lyzinu na C-konci proteinu, který je určen k degradaci (polyubikvitinace, syn. ubikvitylace). Vlastní vazbě ubikvitinu na protein však předchází několik kroků (obr. 3.8.). Protein určený k likvidaci musí být vázán na ubikvitinovvou ligázu E3, která určuje specifitu substrátu a katalyzuje vazbu ubikvitinu. Rostliny mají velké množství různých ubikvitinových ligáz E3, z nichž některé jsou značně komplexní (uvádí se, že u Arabidopsis thaliana více než jeden tisíc genů odpovídá ubiquitinovým ligázám E3). Vazbě na protein musí předcházet aktivace ubikvitinu navázáním enzymu E1. Aktivace proběhne za spotřeby ATP (adenylace ubikvitinu). Enzym E1 umožní vazbu konjugačního enzymu E2 na ubikvitin a uvolní se. Konečným krokem je interakce ligázy E3 s proteinem určeným k degradaci a konjugačního enzymu E2 s ubikvitinem, která umožní vazbu ubikvitinu na protein a uvolnění katalytických proteinů E2 i E3.
Protein označený ubikvitinem je komplexem 19S rozeznán a asociován s proteazomem 26S, transportován do střední části proteazomu, kde je peptidový řetězec štěpen. Ubikvitin do proteazomu nevstupuje a není odbouráván, uvolňuje se v neaktivní formě. Jak se ukazuje v poslední době, proteiny nejsou odbourávány až na aminokyseliny ale na kratší peptidy o 7 až 9 aminokyselinových zbytcích (extrémy 4 až 25). Tato selektivní degradace může vést ke vzniku peptidů se signální funkcí (u rostlin tyto případy zatím popsány nebyly).
Mezi E3 ligázami jsou u rostlin významné zejména komplexní ligázy typu SCF (SKP1–Cullin1–F-box protein). Strukturní podjednotka zvaná kulin (angl. cullin) váže na N-konci podjednotku SKP1 (z angl. SUPPRESSOR OF KINETOCHORE PROTEIN 1) a na C-konci podjednotku RBX1/ ROC1 (z angl. RING-BOX1/REGULATOR OF CULLINS 1). Podjednotka SKP1 nese vazebné místo pro proteiny s F-boxem. F-box je sekvence 50 aminokyselin, důležitá pro rozeznání a vazbu proteinu určeného k ubikvitinaci (poprvé byla tato struktura identifikována na cyklinu F; proteinů nesoucích F-box je značné množství – u Arabidopsis se předpokládá až 700 proteinů s F-boxem, u člověka se udává 78, u Caenorhabditis elegans 350). Ubikvitinové ligázy typu SCF rozeznávají fosforylované proteiny.
▲ Podjednotka RBX1/ROC1 zajišťuje interakci s konjugačním proteinem ubikvitinu E2. Rostliny mají větší množství proteinů podobných SKP1 (SKP1-LIKE), což umožňuje vznik značného množství komplexních E3 ligáz se specifitou k různým substrátům. U Arabidopsis se tyto proteiny značí ASK (Arabidopsis SKP1-LIKE) a rodina těchto proteinů zahrnuje 21 různě aktivních členů.
Katalytická aktivita ligáz typu SCF, daná schopností vázat konjugační enzym s ubikvitinem a substrát (protein určený k ubikvitylaci), je dále významně ovlivňována interakcí s komplexem CSN/COP9 (kap. 8.3.1.1.4). Mechanizmem působení CSN je vazba a uvolňování regulačního proteinu NEDD8 na a z kulinové jednotky SCF (neddylace a deneddylace). Protein NEDD8 (z angl. neural precursor cell expressed, developmentally down-regulated 8 je podobný ubikvitinu, má však specifické enzymy E1 a E2. Vazba NEDD8 ligázu SCF aktivuje, když je přítomen substrát. Po uvolnění ubikvitylovaného substrátu se NEDD8 uvolňuje, snižuje se schopnost vázat E2 s ubikvitinem a zabraňuje se tak vázání ubikvitinu na vlastní složky tvořící E3 ligázu (angl. self-ubiquitination).
Další významné komplexní E3 ligázy patří do typu APC (z angl. anaphase promoting complex). Ligázy APC hrají důležitou úlohu nejen v regulaci buněčného cyklu (jak napovídá název) ale i v diferenciaci buněk.



|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 2646
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2025 . All rights reserved