| CATEGORII DOCUMENTE |
| Bulgara | Ceha slovaca | Croata | Engleza | Estona | Finlandeza | Franceza |
| Germana | Italiana | Letona | Lituaniana | Maghiara | Olandeza | Poloneza |
| Sarba | Slovena | Spaniola | Suedeza | Turca | Ucraineana |
DOCUMENTE SIMILARE |
|
TERMENI importanti pentru acest document |
|
VZTAH STRUKTURY A VLASTNOSTI LÁTEK
Strukturální systém látek
Látka – je atomovým systémem v nejširším smyslu slova existujícím ve formě častých prvků
nebo sloučenin.
Materiál – považujeme látku, která je vyrobena k užití v konkrétní situaci. Má modifikované
vlastnosti.
Systém – uzavřený - izolovaný - otevřený
Analýza – fenomenologický přístup – chování podle vnějších projevů. Změny pozorovatelné na venek. Bez zkoumání co se děje uvnitř. Př: Zvýšením napětí na izolantu dojde k jeho proražení, ale nevíme co se dělo uvnitř materiálu.
- strukturální přístup – zjišťuje k jakým změnám dochází v struktuře
systému.Bereme v úvahu i pohyb vnitřních částic.
Atomové jádro z - atomové číslo(počet protonů)
A - hmotnostní číslo(počet nukleonů)
m – celková hmotnost jádra
m = Z.mp + (A – Z).mn p – proton
n – neutron
![]() Náboj jádra q – elementární
elektrický náboj
Náboj jádra q – elementární
elektrický náboj
![]() Obecné označení prvku
Obecné označení prvku
Kvantová čísla: n – hlavní kvantové číslo m – orbitální magnetické číslo
l - orbitální kvantové číslo s – spinové magnetické číslo
![]()
![]() Atom může absorbovat nebo vydávat jen určité kvanta
energie. Energie, kterou je nutné vynaložit aby se elektron odtrhl od atomu
nazýváme ionizační energií.
Atom může absorbovat nebo vydávat jen určité kvanta
energie. Energie, kterou je nutné vynaložit aby se elektron odtrhl od atomu
nazýváme ionizační energií.
Iont je atom ochuzený či obohacený a elektrony.
Připojením elektronu k atomu vzniká afinita atomu tzn. energie.
![]()
![]()
![]()
![]()
![]() Elektronegativita – schopnost podržet
elektrony. Je afinita atomu v elektronové dvojici, která tvoří
vazbu(kovalentní, iontovou)
Elektronegativita – schopnost podržet
elektrony. Je afinita atomu v elektronové dvojici, která tvoří
vazbu(kovalentní, iontovou)
Vazba – schopnost neutrálního atomu vázat elektronovou dvojici.
Je systém, který se skládá alespoň ze dvou atomů.
Molekula prvku obsahuje atomy stejné. Molekula sloučeniny obsahuje atomy různé.
Chemické vazby – v určité vzdálenosti jádra atomů dochází k interakci elektronů a tak ke vzniku chemické vazby.
Vazební síly – jsou v každém tomto systému. Pro porušení tohoto systému je potřeba vazebná energie.
Vazby Primární – kovalentní, iontová, kovová
Sekundární – Van der Waalsova, vodíková
Přechodná
Kovalentní vazba (homopolární). Jedná se o vzájemné propojení elektronů v obalu. Jsou společné k oběma jádrům. Tyto atomy jsou se stejnou, nebo málo rozdílnou elektronegativitou a hodnota je vysoká.
Vyskytují se v organických sloučeninách, u anorganických látek v atomových krystalech Si,Ge
-směrová vazba – tz. je nejpevnější ve směru spojnice středů obou atomů.
Molekuly s kovalentní vazbou se vyskytují – polární – asymetrická struktura
nepolární – symetrická struktura
Iontová vazba (heteropolární) Je tvořena jádry různých prvků, není směrová. Vzniká mezi atomy se značným rozdílem valenčních elektronů. Otázka odevzdávání elektronů mezi dvěma prvky. Je typická pro atomy s hodně odlišnou elektronegativitou. Má elektrostatickou povahu.
Kovová - Má elektrostatický charakter. Vyskytuje se jen u pevného, kapalného skupenství. Kladné ionty a volné elektrony se pohybují v celém objemu látky. Podobná kovalentní vazbě, tvořená elektronovými dvojicemi. Mřížka tvořena uzly – kladné ionty mezi nimi volné elektrony vytvářejí elektronový plyn.
Mají menší intenzitu než primární vazby.

 Vodíková – Vyskytuje se ve sloučenínách kde se atom
Vodíku váže na silně elektronegativní prvek (O, N, Halogeny).
Vodíková – Vyskytuje se ve sloučenínách kde se atom
Vodíku váže na silně elektronegativní prvek (O, N, Halogeny).
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
Vodíková vazba
Van der Waalsova – Vzniká jako důsledek pohybu elektronu v atomovém obalu. Dojde ke změně těžiště záporného náboje obalu vzhledem ke kladnému jádru a vzniká dipól.
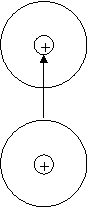
![]()
![]()


Kovalentní polární – přechod mezi iontovou a kovalentní
Silná (slabá) kovalentní vazba – přechod mezi kovalentní a kovovou vazbou.
Soudržnost atomů a molekul zajišťují vazby. V závislosti vzdálenosti molekul a atomů a jejich struktuře.
Krystalické - mají dalekosáhlé uspořádání
Nekrystalické (amorfní)
Podle druhu vazeb
Krystaly – atomové – vzájemná vazba stejných atomů. Mají pravidelnou orientaci atomu v
krystalu. Čím je větší energie(vazebná) v krystalu tím je tvrdší a vzrůstá teplota
tavení.
iontové – Vzniká při vazbě mezi prvky první a sedmé skupiny (slída, křemičitany)
kovové - Vzájemná vazba stejných atomů, nebo rozdílných atomů (slitiny). Pohybem volných elektronů vzniká elektrická vodivost.
Molekulové – Částice které tvoří krystal jsou celé molekuly. Síly jsou velmi slabé
(Van der Waalsovy síly). Vyskytují se v organických sloučeninách.
Krystalický stav látky má pravidelně uspořádané částice.
Reálný krystal bude mít určitý počet poruch v prostoru.
Amorfní stav – látka má nepravidelné uspořádání částic.
Technická amorfní látka – má některé části pravidelné
Monokrystal – objem krystalu je tvořen jedním krystalem
Polykrystal – je tvořen z více krystalů (zrn)
Syntetické makromolekulární látky – částečně krystalická, struktura která obsahuje
pravidelné a nepravidelné uspořádání částic.
Sférolyty (forma, tvar) – kulovitě uspořádané krystalické oblasti které vyrůstají do prostoru
diagonálně. Velikost od 100um až po viditelné velikosti.
Krystalický podíl – dodává velkou mechanickou pevnost, velkou tvrdost, odolnost proti
rozpouštědlům a chemickým činidlům.
Amorfní část – dodává materiálu pružnost, houževnatost, ohebnost, odolnost proti nárazu ap.
![]() Množství krystalické
fáze se vyjadřuje objemovým podílem krystal fáze mluvíme o stupni krystality
Množství krystalické
fáze se vyjadřuje objemovým podílem krystal fáze mluvíme o stupni krystality
Struktura orientovaná se vyskytuje u makromolekulárních látek s lineárními řetězci. Kdy se řetězce orientují v určitém směru a dosahujeme potom toho, že se materiál mechanicky zlepší ve směru orientace.
PORUCHY V MŘÍŘCE
Bodové poruchy – Jednoduché
Vakance Schottkyho porucha
Intersticiály Frenkelova porucha
Lineární poruchy
Dislokace Spirálová porucha
Hranová porucha
Rovinné
Mozaika Hranice zrn
Vakance (bodová porucha) Intersiciály
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() Vyskytují se částice
Vyskytují se částice
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() Chybějící částice v polohách mezi
Chybějící částice v polohách mezi
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() v krystalové
mřížce uzlovými body mřížky
v krystalové
mřížce uzlovými body mřížky
![]()
![]()
![]()
![]()
![]()
Shottkyho porucha – Současný výskyt jedné Frenkelova porucha – Současný výskyt
vakance na místě kladného iontu v
![]() kladného a jedné intersticiální poloze
kladného a jedné intersticiální poloze
![]()
![]()
![]()
![]()
![]()
![]()
![]() vakance na
místě a kde dřív byl, vzniká
vakance na
místě a kde dřív byl, vzniká
záporného iontu. vakance
Lineární poruchy – mají rozměr srovnatelný s řádem uzlů
Hranová porucha – je vložená polorovina mezi dvě rovnoběžné roviny uspořádání
Spirálová porucha – vytváří spirálovou plochu okolo tzv. dislokační přímky
Rovinné poruchy – Představují nahromadění dislokací případně nečistot.
FÁZOVÉ SLOŽENÍ A ROVNOVÁHA SOUSTAV
Fáze – Je určité uspořádání atomů, které může každá látka za určitých okolností vytvořit.
Je určena z hlediska fyzikálního a chemického a má tyto vlastnosti stejné.
Je určena vazebnými silami a tepelným pohybem.
Výzkum se provádí makroskopickými technikami na změnách teploty, tlaku…
![]() Soustava – Jednosložková podle
Soustava – Jednosložková podle
Vícesložková počtu
Homogenní – tvořena jednou fází
Heterogenní – tvořena více fázemi
Změnou vnějších podmínek můžeme dosáhnout fázové přeměny (transformacím). Změní se fyzikální, mechanické, technologické vlastnosti. Cílem je snaha získat stav s minimální hodnotou entalpie.
Entalpie – určitý stav látky (stavová veličina) která je určená vnitřní energií, tlakem a
objemem soustavy
Jedna z těchto přeměn je krystalizace jejímž produktem je krystalická fáze.
Přeměny v tuhém skupenství jsou založené na přeměně uspořádaného tuhého roztoku v neuspořádaný a změně rozpustnosti tuh. na změně teploty.
Dělení podle rychlosti přeměny:
Difuzní – dochází k postupné přeměny fáze
Bezdifuzní – jedná se o náhlou strukturovou změnu, která je způsobená koordinovaným
pohybem velkého počtu atomu.
TECNOLOGIE ZALOŽENÁ NA ZMĚNÁCH A ROVNOVÁZE FÁZE
Výroba kovových skel – Proces založen na rychlém ochlazení tavenin slitin. Kdy nejvhodnější jsou kovy Niklu, Paladia, Platiny, Kobaltu, Teluru, Manganu, Lamtanu, Zirkonu – kapalná fáze velice stabilní.
Schopnost tvořit sklo je tím větší, čím větší je počet složek.
![]() Potřebná ochlazovací rychlost je
Potřebná ochlazovací rychlost je
Tepelné zpracování – Cílem je získávání materiálů s určitými fyzikálními a mechanickými vlastnostmi
Žíhání Vytvrzování Kalení Popouštění a zušlechťování
Chemicko-tepelné zpracování
Prášková metalurgie a výroba spékaných materiálů
Výroba prášků, následné zpracování lisem
Prášková metalurgie kovů a ocelí, vysokotavitelných kovů, spékaných karbidů,
kovokeramických materiálů
Pseudoslitina – výsledkem práškové metalurgie – spékání směsi dvou prášků kovů, které jsou
v tekutém stavu nerozpustné.
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 980
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2025 . All rights reserved