| CATEGORII DOCUMENTE |
| Astronomie | Biofizica | Biologie | Botanica | Carti | Chimie | Copii |
| Educatie civica | Fabule ghicitori | Fizica | Gramatica | Joc | Literatura romana | Logica |
| Matematica | Poezii | Psihologie psihiatrie | Sociologie |
NUTRITIA BACTERIANA
Pentru crestere sau supravietuire, bacteriile trebuie sa gaseasca in mediul ambiant, substante nutritive cu rol energetic, cu rol structural si uneori, nutrienti specifici (factori de crestere), cu rol functional esential. Ele trebuie sa se gaseasca in concentratii adecvate, deoarece concentratiile mari exercita efecte toxice. Unele substante au numai rol energetic, iar altele au atat rol structural cat si energetic.
Substantele energetice sunt oxidate in metabolismul celular si elibereaza energia. Ele pot fi minerale sau organice si au rolul de donatori de electroni sau de H, in cursul reactiilor catabolice. Cunoaterea exigentelor nutritive ale diferitelor bacterii este importanta pentru clasificarea bazata pe natura sursei energetice, pentru prepararea mediilor selective (cele care contin o singura sursa energetica, utilizata de unul sau de cateva tipuri de bacterii). De exemplu, un mediu sintetic care contine numai triptofanul ca sursa de carbon si energie permite creterea numai a celulelor de E. coli.
In functie de proportia in care substantele nutritive sunt necesare, se disting doua grupe: macronutrienti si micronutrienti.
Categoria substantelor macronutritive, cu rol structural si functional cuprinde:
sursa de azot, sub forma NH3 sau a sarurilor de amoniu in solutie, pe care le asimileaza majoritatea bacteriilor. Amoniul este asimilat direct in glutamina si glutamat, donorii esentiali pentru reactiile de biosinteza. Din punct de vedere energetic, procesul este cel mai convenabil. Sursele organice (aminoacizii) trebuie sa fie mai intai degradate la amoniu, iar sursele anorganice (nitratul, nitritul sau N2) trebuie reduse la amoniu, inainte de a fi asimilate. Putine bacterii folosesc nitratul, nitritul sau un compus azotat organic (aminoacizi, amine);
sursa de carbon. Pentru majoritatea bacteriilor, sursa de carbon asimilabila este un substrat organic. Un numar restrans de specii utilizeaza CO2 ca sursa de carbon asimilabil. Compuii organici cu carbon au rol dublu, fiind in acelai timp utilizati ca substrat energetic oxidabil dar si ca sursa de carbon asimilabil, o parte fiind degradata pentru a produce energie, iar o alta parte este asimilata pentru biosinteze;
substantele minerale cele mai importante sunt: HPO42-, SO42-, Cl-, K+, Na+, Mg2+. Ionii minerali intra in alcatuirea unor enzime sau a unor molecule cu rol de coenzime.
Fosforul, sub forma fosfatilor este folosit pentru sinteza acizilor nucleici si a fosfolipidelor. Majoritatea microorganismelor utilizeaza fosfatul anorganic (PO4), iar fosfatii organici, desi apar frecvent in natura sunt utilizati numai dupa actiunea fosfatazelor, care elibereaza fosfatul anorganic.
Sulful are rol structural, fiind component al unor aminoacizi (cisteina, metionina) si a unor vitamine (tiamina, biotina, acidul lipoic). Sulful este preluat sub forma de SO42- sau sulfid (S2-).
Potasiul are rol in activarea unor enzime, chiar a celor implicate in sinteza proteica.
Magneziul stabilizeaza ribosomii, acizii nucleici si este necesar pentru activitatea multor enzime, inclusiv a fosfotransferazelor.
Calciul are rol in stabilizarea peretelui celular bacterian si este un component esential al endosporului bacterian.
Sodiul este necesar pentru creterea bacteriilor halofile, in concentratii apropiate de limita solubilitatii NaCl in apa.
Unele sunt oligoelemente, necesare in concentratii foarte mici (Cu, Ni, Se, Mo, Mn, Fe, Co) si sunt aduse odata cu impuritatile altor compui minerali. Ionii minerali intra in alcatuirea unor enzime sau a unor molecule cu rol de coenzime.
Fierul se gasete in enzimele celulare cu rol in respiratie (citocromi).
Cobaltul este necesar numai pentru sinteza vitaminei B12. Daca vitamina se adauga in mediu, Co nu mai este necesar.
Zincul are rol structural in molecula unor enzime: anhidraza carbonica, alcool-dehidrogenaza, ARN- i ADN-polimeraza si influenteaza sinteza ARN. Pare sa modifice si sa stabilizeze membrana celulei, formand mercaptide cu gruparile thiol ale proteinelor si interactioneaza cu gruparile fosfat ale fosfolipidelor si - COOH ale acidului sialic.
Molibdenul se gaseste in enzimele denumite molibdoproteine, cu rol in reducerea asimilatorie a nitratului. Se gaseste in nitrogenaza, enzima care catalizeaza reducerea N2 in procesul fixarii biologice.
Cuprul intra in alcatuirea unor enzime respiratorii.
Manganul este activator al unor enzime ce actioneaza asupra compuilor ce contin fosfat. Se gasete in unele enzime SOD (enzime ce detoxifica formele toxice ale O2).
Nichelul intra in alcatuirea hidrogenazelor, cu rol de producere sau de inglobare a H2,
Tungstenul (Wolframul) si seleniul sunt necesare bacteriilor care cliveaza formiatul. Seleniul este parte a enzimei formiat-dehidrogenaza.
Apa reprezinta 80-90% din greutatea unor bacterii si este o componenta obligatorie a mediului nutritiv.
Tipuri de nutritie a microorganismelor
Tipurile trofice sau de nutritie a bacteriilor sunt conditionate direct de capacitatile de biosinteza. La randul lor, activitatile biosintetice sunt expresia complexitatii aparatului enzimatic celular.
Pentru a defini tipul de nutritie a unui microorganism trebuie luate in consideratie mai multe criterii:
capacitatea de a face biosinteza metabolitilor esentiali;
sursa dominanta de energie utilizata in procesele de biosinteza;
natura substratului folosit ca sursa reducatoare.
Dupa natura sursei de C, care reflecta capacitatea de a face biosinteza metabolitilor esentiali, bacteriile pot fi:
autotrofe
heterotrofe.
Microorganismele autotrofe folosesc CO2 ca unica sau principala sursa de carbon celular, iar cele heterotrofe folosesc substantele organice, atat ca sursa de carbon pentru biosinteze, cat si ca sursa de energie.
Marea varietate a tipurilor nutritionale intalnite la microorganisme nu poate fi exprimata numai in functie de natura sursei de carbon, fapt care a impus utilizarea unor noi criterii.
In functie de sursa dominanta de energie, bacteriile se pot grupa in doua categorii:
cele fototrofe (fotosintetizante) utilizeaza energia fotonica (luminoasa), pe care o convertesc in energie chimica, sub forma legaturilor macroergice din ATP;
cele chemotrofe (chemosintetizante) isi obtin energia prin reactii de oxido-reducere ale substratului chimic organic sau anorganic.
In functie de natura substratului folosit ca sursa reducatoare (donator de H+ sau de e-), microorganismele chemotrofe prezinta doua tipuri de metabolism energetic:
unele sunt litotrofe (litos, grec = piatra), adica utilizeaza ca donori de e-, diferite substante anorganice (H2, H2S, So, S2O32- (tiosulfat), Fe2+, NO2-, NH3), pe care le oxideaza (la apa, sulfat, Fe3+ i respectiv NO3), in reactii exergonice cuplate cu sinteza ATP;
altele sunt organotrofe, deoarece, ca donori de e- folosesc diferiti compui organici.
In functie de natura sursei de carbon, a sursei de energie i a substratului donor de potential reducator (H sau e-) se disting urmatoarele tipuri de nutritie:
nutritia fotolitotrofa; sursa de carbon este CO2, cea de energie este radiatia luminoasa, iar donorul de H este un compus anorganic (H2S, S0, H2, H2O). Aceasta modalitate de nutritie este caracteristica bacteriilor fotosintetizante din familiile Chromatiaceae, Chlorobiaceae, dar si pentru grupul Cyanobacteria, care fac fotosinteza dupa mecanismul molecular al fotosintezei plantelor superioare;
nutritie fotoorganotrofa; sursa de carbon este un compus organic (acizi grai, acizi organici sau aminoacizi, glucide, alcooli si chiar compui aromatici), care are rol si de donor de potential reducator (H+), iar sursa de energie este radiatia luminoasa. Acest tip de nutritie este caracteristic bacteriilor purpurii nesulfuroase din familia Rhodospirillaceae.
nutritie chimiolitotrofa; sursa predominanta de carbon este CO2. Potentialul reducator este furnizat prin reactiile de oxidare a unor compui anorganici (NH3, NO2, H2S, S0, Fe2+, H2), care au rolul de donori de protoni (H+). Nutritia chimiolitotrofa este caracteristica exclusiv unor grupe de bacterii: nitrat- si nitritbacterii, ferobacterii, bacteriile acetogene si metanogene sau cele care oxideaza CO;
nutritia chimioorganotrofa; sursa de carbon o constituie compuii organici, care au si rol de donor de potential reducator. Prin oxidarea lor se elibereaza energia necesara proceselor de biosinteza. Majoritatea bacteriilor sunt chimioorganotrofe: Bacillus, Clostridium, Pseudomonas, Lactobacillus, precum si toate bacteriile patogene sau potential patogene.
Nutritia autotrofa
Autotrofia nu se refera la natura sursei de energie folosita, ci la sursa de C. Autotrofia defineste capacitatea unor organisme de a face sinteza materiei organice din substante anorganice. Este o modalitate de nutritie a unor microorganisme care utilizeaza CO2 ca unica sau principala sursa de C, pe care il reduc la aldehida 3-fosfoglicerica. Sursele de azot sunt compui simpli: NH4+, NO2- sau chiar N2 molecular.
Bacteriile autotrofe (fotolitotrofe i chimiolitotrofe) au capacitati mari de biosinteza. Ele sintetizeaza toti metabolitii necesari, pornind de la surse anorganice de carbon si azot.
Energia necesara reducerii CO2 la compui organici este eliberata prin oxidarea unor compui anorganici: CO, NH3, NO2, Fe2+, H2S, So, S2O32-, H2 sau este chiar energia luminoasa. Energia eliberata prin oxidarea compuilor chimici anorganici sau cea luminoasa este stocata in ATP si utilizata pentru reactiile de reducere.
Fotosinteza
Fotosinteza este procesul biologic de transformare a energiei luminoase, in energie de legatura chimica, utilizabila in reactiile de biosinteza. Organismele fotosintetizante datoreaza aceasta capacitate, prezentei unor pigmenti sensibili la lumina, denumiti clorofile.
Majoritatea organismelor fotosintetizante sunt autotrofe, capabile sa utilizeze CO2 ca singura sursa de carbon.
Energia luminoasa este convertita intr-o serie de reactii, in energie chimica sub forma ATP si a potentialului reducator sub forma NADPH. Cele doua tipuri de molecule, intr-o succesiune de reactii, convertesc CO2 la glucoza, dupa urmatoarea reactie globala:
![]()
Fotosinteza este rezultatul a doua tipuri de reactii: reactii fotochimice la lumina si reactii la intuneric.
Reactiile la lumina. Clorofila absoarbe energia luminoasa si o convertete in energie chimica sub forma de ATP si de NADPH ca potential reducator al CO2 (fig. 48). Molecula de clorofila excitata si energizata dupa absorbtia cuantei de lumina, elibereaza un e-, care este acceptat indirect* de feredoxina sau de bacteriofeofitina (o bacterioclorofila a, fara Mg), ambele puternic reducatoare, cu potential redox scazut.
Transferul de electroni de la clorofila, la unul dintre reducatori constituie treapta conversiei luminoase in energie chimica.
Acceptorul primar de e-, al fotosistemului I nu a fost identificat. Ar putea fi un radical liber al clorofilei a. Acceptorul primar devine un reducator suficient de puternic pentru a reduce feredoxina, care la randul ei reduce NADP+ la NADP.
Sarcina pozitiva a moleculei de clorofila oxidata (dupa pierderea unui e-) este neutralizata de un alt e-, originar dintr-un citocrom situat pe cealalta fata a membranei. Astfel, intre citocromul oxidat si feredoxina redusa se creeaza o mare diferenta de potential electrochimic, a carui energie poate fi utilizata in doua moduri:
pentru a converti ADP la ATP, prin intermediul transportorilor de e-;
pentru reducerea NADP la NADPH, utilizabil in reactiile de biosinteza.
In reactiile la intuneric, energia stocata in ATP si NADPH este utilizata pentru a converti CO2 si H+ in glucoza si H2O:
![]()

Fig. 48. Reprezentarea schematica a reactiilor la lumina si la intuneric.
In fotosinteza plantelor superioare si a cianobacteriilor, e- pierdut de molecula de clorofila este recuperat pe seama oxidarii apei;
![]()
Rezultatul net al fotosintezei oxigenice este transferul ionilor de H+ din molecula apei, la CO2, printr-un proces de oxido-reducere in care apa este oxidata, iar CO2 este redus.
Potentialul redox al apei este + 0,81 V, net pozitiv fata de - 0,42 V al acceptorului intermediar necunoscut. De aceea, transferul de e- nu se poate face direct intre H2O si CO2. H2O nu poate reduce CO2, dar nici nu poate fi oxidata de CO2.
Energia furnizata de o singura cuanta de lumina nu este suficienta acestui proces. Este necesara energia furnizata de doua cuante, prin excitarea a doi centri de reactie la lumina. Cei doi centri de reactie ai clorofilei fotoactivate sunt legati in serie ca o pereche de baterii electrice si formeaza fotosistemele I si II. Ei absorb radiatii luminoase cu lungimi de unda uor diferite. Fotosistemul I al clorofilei, denumit P700, absoarbe radiatiile din domeniul rou indepartat, iar fotosistemul II, (P680) absoarbe radiatiile cu lungime de unda mai scurta. Ambele fotosisteme sunt variante ale clorofilei a .
Fotosistemul I realizeaza un transport ciclic al e- , in cursul caruia se sintetizeaza ATP si se genereaza NADPH (fotofosforilare ciclica). Circuitul e- este ciclic, adica e- se reintorc pe molecula clorofiliana de origine, dupa ce au parcurs un traseu format din cupluri redox.
Fotosistemul II are ca functie principala, fotoliza apei si participa la procesul de fotofosforilare neciclica. Electronii neciclici pierduti de molecula de clorofila sunt inlocuiti cu e- din ionii OH-, rezultati prin fotoliza apei. Molecula de clorofila P680, excitata de o cuanta de lumina, reduce un intermediar necunoscut (probabil feofitina a - o clorofila a fara atomul de Mg). Electronii nu se mai intorc pe molecula de origine a fotosistemului II, ci intra in circuitul fotosistemului I (fig. 49).

Fig. 49. Schema ''Z'' a fluxului de electroni in fotosinteza oxigenica a plantelor, algelor si a cianobacteriilor. Cele doua fotosisteme (I si II) sunt legate in serie. I = acceptorul intermediar neidentificat al fotosistemului II ; PQ = plastoquinona ; Cit = citocrom ; X = acceptorul neidentificat al electronilor in fotosistemul I; Fd = feredoxina ;. P680 si P700 sunt centrii clorofilieni de reactie ai fotosistemului II si respectiv I (dupa Brock, 1988).
Cianobacteriile realizeaza o fotosinteza oxigenica, asemanatoare ca mecanism, cu a plantelor superioare. Celulele vegetative poseda ambele fotosisteme (I si II), iar heterochitii au numai fotosistemul I (nu fotolizeaza apa).
Cele doua fotosisteme, in mod normal functioneaza corelat. In anumite conditii, unele cianobacterii realizeaza o fotosinteza anoxigenica, prin functionarea numai a fotosistemului I, obtinand potentialul reducator din alte surse decat apa (ca si bacteriile verzi i purpurii). Reducerea CO2 are loc in conditii de anaerobioza. Ca donori de e- folosesc H2S (pe care-l oxideaza la So extracelular) sau folosesc H2 pe care-l oxideaza sub actiunea unei hidrogenaze de inglobare. Potentialul reducator rezultat de oxidarea H2S sau H2 reduce NADP la NADPH.
In conditii naturale, H2S este un inhibitor al fotosistemului II si al fotosintezei oxigenice, dar induce sinteza unei enzime care permite cuplarea reducerii fotosintetice a CO2, cu oxidarea H2S la So. Aceasta reactie are loc in celulele de Oscillatoria limnetica, care face numai fotosinteza anoxigenica.
Fotosinteza bacteriana
Bacteriile fotosintetizante sulfuroase verzi (familia Chlorobiaceae, g. Chlorobium) sunt strict anaerobe si folosesc H2S ca donor de e-. Rezulta So, pe care il oxideaza la sulfat. Nu contin niciodata incluzii celulare de So. Reactia globala a oxidarii H2S este urmatoarea:
![]()
Bacteriile fotosintetizante purpurii sunt sulfuroase (Thiorhodaceae = Chromatiaceae) si nesulfuroase(Athiorhodaceae = Rhodospirillaceae).
Bacteriile sulfuroase purpurii (Chromatiaceae) oxideaza H2S, la So elementar, pe care-l depoziteaza in spatiul periplasmic. Dupa epuizarea H2S, So este oxidat la SO42-. Ele oxideaza si alti compui ai S, in special tiosulfatul (S2O32-), H2 si chiar substraturi organice (acizi dicarboxilici, acizi grasi, piruvatul). Ultimii au rolul nu numai de donori de e-, ci sunt utilizati si ca surse secundare de carbon, sursa principala ramanand CO2.
Bacteriile sulfuroase purpurii se gasesc in zonele anoxice iluminate ale mediilor aquatice unde se acumuleaza H2S, precum i in izvoarele sulfuroase care contin H2S de origine biologica sau geochimica.
Mediile cele mai favorabile pentru dezvoltarea bacteriilor sulfuroase sunt lacurile meromictice (permanent stratificate), datorita densitatii diferite a apei: in stratul inferior apa este salina, iar in partea superioara este apa dulce. Daca in stratul inferior este o concentratie suficienta de SO42-, prin reducerea respiratorie (anaeroba) se formeaza H2S, care difuzeaza spre zona iluminata, unde se dezvolta bacteriile sulfuroase purpurii si verzi.
Bacteriile purpurii nesulfuroase (Rhodospirillaceae) in absenta luminii oxideaza H2, sau diferiti compui organici (acizi organici, alcooli, glucide, compui aromatici), pe care ii utilizeaza atat ca donori de e- cat si ca surse de carbon. In anoxie realizeaza un metabolism anaerob sau de tip fermentativ, iar in aerobioza au un metabolism respirator. S-au denumit "nesulfuroase" deoarece s-a considerat ca nu pot utiliza H2S ca donor de potential reducator pentru reducerea CO2. Ulterior s-a evidentiat ca majoritatea speciilor utilizeaza H2S, dar tolereaza concentratii mai mici. La lumina sunt fotoorganotrofe si cresc in conditii de anaerobioza. Pentru nutritia fototrofa necesita aceiasi compui organici (acizi organici, alcooli, glucide, compui aromatici)
Bacteriile fotosintetizante poseda un pigment fotosintetic particular, denumit bacterioclorofila, repartizata in mici unitati elementare denumite cromatofori, dispersati in citoplasma bacteriana.
In fotosinteza bacteriana, conversia cuantei de lumina in energie de legatura chimica evolueaza ca o fotofosforilare ciclica, in care se sintetizeaza ATP si se genereaza baze nucleotidice piridinice reduse (NADPH). Sinteza ATP si generarea NADPH implica transportul e- printr-o catena de transport, localizata in membranele suport ale pigmentilor fotosintetizanti. Transportorii de e- ai catenei au localizare membranara si sunt cuplati in serie, in ordinea creterii potentialului redox. Unele componente ale catenei de transport al e- in fotosinteza se regasesc in catena de respiratie.
In fotosinteza bacteriana, transportul e- este ciclic. Fluxul de e- isi are originea in molecula de bacterioclorofila.
Clorofila in repaus are un potential redox pozitiv si trebuie sa reduca o molecula acceptoare cu potential redox foarte scazut. Este un transfer impotriva gradientului termodinamic.
Absorbtia unei cuante de lumina marete potentialul energetic al clorofilei si o transforma intr-un reducator puternic. Electronul moleculei de clorofila este cedat unui acceptor intermediar neidentificat (probabil, bacteriofitinei a, o bacterioclorofila a fara Mg). Intermediarul este un reducator puternic (cu potential redox negativ) si transfera e- unor componente cu potentiale redox progresiv mai mici (quinona, citocromi). Transferul este insotit de eliberarea energiei. Sub actiunea ATP-azei, care cupleaza scaderea potentialului redox, cu sinteza ATP, energia este stocata in molecula de ATP. Electronul se reintoarce pe molecula de origine si o readuce la potentialul redox initial.
Centrul de reactie al bacterioclorofilei este echivalent fotosistemului I de la plantele superioare si de la cianobacterii.
Pentru fixarea CO2, energia furnizata de ATP sintetizat sub actiunea ATP-azei nu este suficienta. Reducerea CO2 necesita un potential reducator sub forma NADPH. Dar bacteriile nu fac fotoliza apei. NADPH este furnizat prin oxidarea compuilor redui ai S (H2S, Na2S2O32-, So), a H2 sau a compuilor organici (succinat, malat, butirat). Toate aceste molecule au un potential redox negativ, dar mai putin negativ decat al cuplului NADP/NADPH. Oxidarea lor este cuplata cu generarea NADPH. Electronii rezultati din oxidarea lor intra in catena de transport a fotosintezei, la nivelul citocromilor si reduc NADP la NADPH, cu consum de ATP.
Transportul e- de la donorii exogeni la un acceptor (NADP+), cu potential redox foarte scazut se numeste transport inversat. El are loc cu consum de ATP si este necesar fixarii reductive a CO2. ATP necesar reducerii NADP la NADPH corespunde consumului energetic al reducerii CO2. De exemplu, cresterea in prezenta H2S este insotita de formarea S elementar, care ramane la exteriorul celulelor bacteriene sulfuroase verzi sau este depozitat intracelular de cele purpurii (fig. 50).
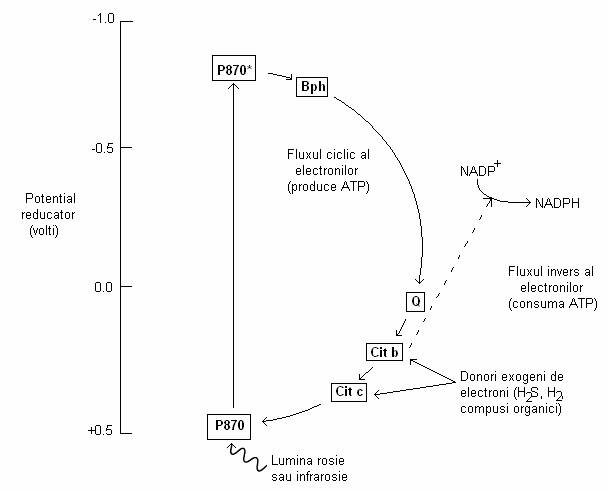
Fig. 50. Fluxul de electroni in fotosinteza anoxigenica a bacteriilor. P870 = centrul de reactie al bacterioclorofilei;
Bph = bacteriofeofitina; Q = quinona; Cit = citocrom (dupa Brock, 1988)
Fotosinteza bacteriana este un proces foarte restrans in natura, dar probabil a fost foarte important in atmosfera primara a planetei, lipsita de O2, bogata in H2 si a contribuit la acumularea substantelor organice.
Nutritia chimiolitotrofa
Nutritia chimiolitotrofa, cunoscuta exclusiv la bacterii, are un rol deosebit de important in natura, deoarece reoxideaza anumiti compui minerali si ii reintegreaza in circuitul natural. Procesele de oxidare a unor substraturi anorganice sunt specifice anumitor tipuri de bacterii specializate sub raport fiziologic, Gram negative, adeseori mobile, unele strict aerobe.
Substratul anorganic oxidat are rolul de sursa de e- (potential reducator), pentru reducerea CO2, utilizat ca sursa de carbon. Acceptorul final de e- este O2. Metabolismul chimiolitotrof de obicei implica procese respiratorii aerobe. Chimiolitotrofele au catena transportoare de e- asemanatoare cu acelea ale chimioorganotrofelor si genereaza forta proton-motrice care determina sinteza ATP.
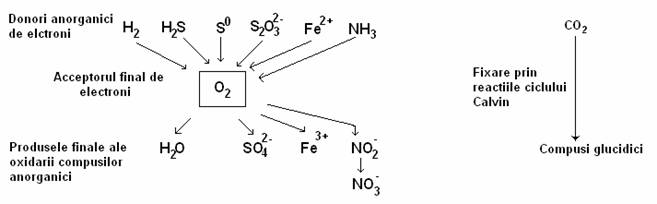
Fig. 51. Reprezentarea schematica a fluxului de electroni si a CO2 la bacteriile chimiolitotrofe.
Bacteriile care oxideaza hidrogenul (hidrogen-bacteriile)
H2 este substratul pentru creterea unei mari diversitati de bacterii. Cele H2-oxidante (Pseudomonas, Alcaligenes etc.) cresc cu H2 si CO2 ca unica sursa de energie si respectiv C, in prezenta O2. Sunt litotrofe facultative deoarece bacteriile hidrogen-oxidante comuta alternativ intre metabolismul chimiolitotrof si cel chimio-organotrof deoarece cresc pe o gama larga de substraturi organice, pe care le oxideaza si le utilizeaza ca donori de e- si ca surse de carbon, dar totdeauna ii pastreaza capacitatea de nutritie chimiolitotrofa prin oxidarea H2 si de a face asimilarea reductiva a CO2 pe calea ciclului Calvin (calea ribulozo-fosfatului), dupa urmatoarea reactie globala:
![]()
H2 este oxidat, iar O2 este acceptorul final de e-, dupa reactia globala:
![]()
Cele mai multe hidrogen-bacterii cresc chimioautotrof prin oxidarea H2 in conditii de microaerobie(5-10% O2), deoarece hidrogenazele sunt sensibile la O2.
Energia rezultata este folosita pentru reducerea CO2 la compui organici.
Organismele care folosesc un compus anorganic ca sursa de energie si un compus organic ca sursa de carbon se numesc mixotrofe.
Cand cresc autrotrof, hidrogen-bacteriile fixeaza CO2 prin seria de reactii a ciclului Calvin, iar cand cresc heterotrof, enzimele ciclului Calvin sunt represate si se induce sinteza enzimelor implicate in oxidarea compusului organic.
Hidrogen-bacteriile contin totdeauna in echipamentul lor enzimatic, una sau doua hidrogenaze*, enzime care leaga H2 si il oxideaza, fie pentru a produce ATP sau il utilizeaza ca potential reducator pentru creterea autotrofa.
In functie de metalele componente ale situsului activ, hidrogenazele sunt clasificate in 3 grupe: cu NiFe, cu Fe si fara metale. Majoritatea hidrogenazelor bacteriene contin NiFe.
Unele sunt hidrogenaze legate de membrana citoplasmatica (sau "particulate"), iar altele au localizare citoplasmatica (sau "solubile").
Hidrogenazele legate de membrana au rol in metabolismul energetic. Dupa legarea H2 la situsul activ al enzimei, molecula este oxidata, protonii sunt transferati pe catena de respiratie pana la O2.
Hidrogenazele citoplasmatice au rol in generarea potentialului reducator pentru creterea autotrofa. Ele preiau H2 si reduc NAD+ la NADH. Acesta este fosforilat, iar NADPH este utilizat ca reducator in ciclul Calvin.
Uneori hidrogenaza este bidirectionala: oxideaza H2 si rezulta H+ sau reduce H+ si rezulta H2
![]()
Hidrogenazele oxideaza H2 numai la concentratii mai mari decat cele din atmosfera: in rizosfera plantelor de orez, in izvoarele geotermale, in platformele de material vegetal in descompunere, in nodozitatile fixatoare de N2, pentru ca bacteroizii nu au Hup (hidrogenaza de inglobare). Toate bacteriile fixatoare de N2 au o hidrogenaza care oxideaza H2. Ele contribuie la diminuarea pierderii potentialului reducator sub forma de H2 in nodozitatile fixatoare de N2 ale radacinilor plantelor leguminoase. Rolul ei este de a readuce in fluxul energetic al celulei, H2 care rezulta din activitatea nitrogenazei.
H2 este utilizat ca substrat pentru crestere de diferite bacterii anaerobe, in special metanogene, pentru ca este precursor al CH4, in solul anoxic. Multe bacterii heterotrofe oxideaza H2, folosindu-l ca potential reducator, dar nu ca unica sursa de energie (de exemplu, E. coli, Azospirillum).
Bacteriile
carboxidotrofe. CO este un poluant atmosferic*.
La om, expunerea la nivelul urban al CO (100 ppm) si formiat provoaca simptome variate, interpretate gresit ca viroze respiratorii. Toxicitatea acuta se produce consecutiv expunerii la concentratii mai mari, prin acumularea produselor de ardere in spatii inchise. CO are afinitate speciala pentru atomii de metal legati de proteine. Toxicitatea CO pentru om se atribuie afinitatii inalte pentru toate proteinele ce contin Fe hemic, scazand capacitatea hemoglobinei de a lega O2. CO este inhibitor al enzimelor cu Fe nehemic, inclusiv hidrogenaza si nitrogenaza. Mamiferele produc CO endogen prin degradarea hemului. Hbg discrimineaza intre CO endogen si exogen. Fara discriminare, CO de origine endogena s-ar lega cu 20% din proteinele cu hem din organism.
Indepartarea CO este, in primul rand, rezultatul oxidarii fotochimice, dar este utilizat intr-o masura semnificativa de catre microorganisme. Unele hidrogen-bacterii, un grup fiziologic foarte specializat, folosesc CO ca unica sursa de energie si il oxideaza sub actiunea carbon-monoxid-dehidrogenazei (enzima cu Mo), la CO2, pe care il fixeaza in reactiile ciclului Calvin. Electronii care deriva din oxidarea CO intra in catena transportoare, la nivelul careia se sintetizeaza ATP.
S-au definit doua sisteme microbiene care utilizeaza CO: unul aerob si altul anaerob. Deoarece CO are afinitate mare pentru Fe diferitelor enzime, bacteriile carboxidotrofe aerobe (Ps.carboxydomonas, Alcaligenes carboxydomonas) cupleaza oxidarea CO, cu respiratia insensibila la CO, dupa reactia globala:
![]()
Enzima care oxideaza CO contine Mo. Consumul CO de catre microorganisme este un proces ecologic foarte semnificativ, deoarece o cantitate mare de CO este generata din diferite surse, dar concentratia sa in aerul atmosferic n-a crescut corespunzator. Bacteriile carboxidotrofe din straturile superficiale ale solului reprezinta probabil cea mai semnificativa capcana pentru CO in natura.
Alte bacterii care oxideaza CO sunt cele acetogene. Ele catalizeaza aceiasi reactie, cu o enzima (CO-dehidrogenaza) ce contine Ni, enzima care se gasete si la bacteriile sulfat-reducatoare.
CO este consumat de bacteriile metanogene care au CO-dehidrogenaza cu Ni si de bacteriile fototrofe care hidrolizeaza CO cu H2O si rezulta H2 + CO2.
In afara de oxidarea bacteriana, CO poate fi oxidat de monooxigenaze, fara sa fie folosit pentru cresterea bacteriana.
Bacteriile metanogene
Unele bacterii metanogene oxideaza H2 si utilizeaza e- si energia rezultata pentru reducerea CO2, la compui glucidici si CH4. Sunt organisme strict anaerobe.
Metanul este cel mai redus compus organic si este rezultatul final al reactiilor de reducere pe care le realizeaza bacteriile metanogene. Procesul are loc in mediile anaerobe: rumenul ierbivorelor, intestinul terminal al termitelor, in digestoarele (bazinele instalatiilor in care se face epurarea) de ape menajere, in sedimentele apelor marine si dulci.
O trasatura fiziologica importanta a metanogenelor este aceea ca folosesc un numar limitat de substraturi simple pentru metanogeneza si au necesar crescut de Ni.
Unele metanogene, folosesc numai amestecul de H2 si CO2, dar multe oxideaza formiatul, iar cateva oxideaza CH3COOH, CH3OH sau CH3NH2 (metilamina), dar nu folosesc CO2 si H2.
Bacteriile metanogene din g. Methanobacterium, Methanosarcina, Methanospirillum) produc metan printr-o reactie definitorie si caracteristica grupului: reducerea CO2 intr-o reactie in care H2 este utilizat ca donor de e-. H2 este oxidat intr-o reactie producatoare de energie:
![]()
Circa l/3 din cantitatea de CH4 produsa in natura se formeaza prin aceasta reactie, restul avand originea in grupul metil al acetatului.
Metanobacteriile sunt chimiolitotrofe, deoarece se dezvolta intr-un mediu care contine o solutie minerala apoasa si o atmosfera formata din CO2 i H2. Mecanismele reducerii CO2 pentru sinteza compusilor organici nu se cunosc.
Bacteriile metanogene produc CH4 nu numai prin reducerea CO2, ci si prin oxidarea unor substraturi organice, precursoare directe ale CH4:
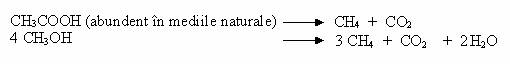
Formiatul este un substrat energetic utilizat de multe bacterii metanogene, rezultand prin clivarea piruvatului la acetil-CoA si formiat. Formiatul nefiind un precursor direct al metanului, este mai intai oxidat la CO2 si H2 :

In cea de a II-a treapta, CO2 este redus la CH4.
Cele mai bune substraturi naturale pentru producerea CH4 sunt CO2, H2 si acetatul
Metanogenele utilizeaza H2 de origine abiogena, component al fluidului geotermal.
Alta sursa abiogena de H2 este Fe metalic, care sufera spontan reactia chimica:
![]()
In mediile naturale, CH4 si CO2 se formeaza ca rezultat al degradarii materiei organice in conditii anoxice si cu cantitate limitata de NO3-, SO4- sau Fe3+.
Metanogeneza este un proces tipic de acceptare a e- terminali in procesele de descompunere a materiei organice din apele dulci, din mlatini, orezarii, din tractul digestiv al rumegatoarelor.
CH4 este rezultatul cooperarii metabolice a cel putin trei grupe fiziologice de bacterii ce formeaza un lant trofic, in care acetatul este principalul intermediar metabolic: bacterii fermentative primare, secundare si doua tipuri de metanogene.
Intr-o prima etapa, polimerii (polizaharide, proteine, acizi nucleici, lipide) sunt convertiti la oligomeri si monomeri (glucide, aminoacizi, purine, pirimidine, acizi grasi si glicerol) sub actiunea enzimelor hidrolitice extracelulare, produse de bacteriile fermentative primare. Ele fermenteaza monomerii rezultati, la acizi grai, succinat, acetat, lactat, alcooli. Unele produse de fermentatie (acetatul, H2, CO2 si alti compui C1) pot fi convertiti direct de bacteriile metanogene la CH4 si CO2.
Degradarea altor produse de fermentatie (acizii organici cu catena mai lunga de 2 atomi de C, alcoolii care contin mai mult decat un atom de C si a compuilor aromatici), este catalizata de fermentatorii secundari, reprezentati de bacteriile sulfat reducatoare. Ele convertesc substratul la acetat, CO2, H2 si uneori formiat, pe care le utilizeaza metanogenele.
Bacteriile metanogene realizeaza treapta finala a lantului trofic anaerob, producand CH4 din, acetat sau din CO2 si H2. Din aceasta cauza, in cele mai multe habitate, metanogenele depind de convietuirea in asociatii cu alte bacterii anaerobe care convertesc materia organica complexa la precursorii metanului.
Degradarea substantei organice cu formare de CH4 este un proces care elibereaza o cantitate mica de energie, comparativ cu respiratia aeroba sau anaeroba, pentru ca metanogeneza este ultima treapta care are loc dupa ce au fost redui alti acceptori de e-. CH4 ca produs de fermentatie, depoziteaza o parte importanta a energiei disponibile in substratul initial, care este eliberata prin oxidarea aeroba a CH4 de catre bacteriile metan-oxidante.
Cantitatea mica de E disponibila pentru conversia materiei organice la CH4, obliga microorganismele participante la o cooperare foarte eficienta. Cooperarea lor este atat de accentuata, incat nu pot exista unele fara altele si se numete relatie sintrofica.
Avantajul este ca organismele sunt specializate metabolic, dar eficienta metabolica a asociatiei depinde de eficienta transferului metabolitilor intre parteneri: fluxul H2 intre cele care-l produc si metanogenele care-l consuma este invers proportional cu distanta dintre ele. Transferul optim al metabolitilor se face cand cei doi parteneri se gasesc in contact strans, adica sunt atasati unul de celalalt si formeaza un agregat celular sau flocon. Astfel de flocoane se formeaza in digestoarele anaerobe ale apelor uzate, in care sunt degradati acizii grasi.
Importanta ecologica a bacteriilor metanogene
Bacteriile metanogene realizeaza importante reactii terminale in habitatele anaerobe, modificand semnificativ proportia produselor finale ale proceselor fermentative. Ele intra in competitie cu alte bacterii consumatoare de H2: cu cele sulfat-reducatoare si cu cele acetogene.
Analiza gazelor continute in stratul de gheata din Groenlanda arata ca valoarea concentratiei atmosferice a CH4 a fost stabila (0,7 ppm) pe o perioada de circa l0 milenii, dar a crescut constant in ultimii l50-250 de ani, ajungand la l,6 ppm.
CH4 produce un puternic efect de sera. Dei reprezinta numai 0,5% din cantitatea de CO2, CH4 contribuie cu circa 25% din efectul de sera.
CH4 are rol in reactiile chimice din stratosfera, care duc la formarea si distrugerea O3.
Sursele de CH4 sunt biogene i abiogene. O contributie deosebita o au bacteriile metanogene din rumenul rumegatoarelor, ca si descompunerea deeurilor menajere si vegetale. Orezariile, ca si tinuturile naturale umede (turbariile, tundra) sunt surse importante de CH4. Recuperarea si arderea CH4 rezultat din degradarea materiei organice ar duce la creterea concentratiei atmosferice a CO2, un gaz cu un efect de sera mult mai scazut.
Sursele abiogene de H2 stimuleaza producerea biogena a CH4: H2 din ariile geotermale si cel rezultat din reactia chimica spontana a Feo metalic cu protonii:
![]()
Metanul atmosferic este rezultatul unor activitati umane nebiogene: exploatarea miniera a carbunelui.
Bacteriile care oxideaza sulful si compusii sai
Sulful este un element important pentru nutritia microorganismelor, atat sub forma sa cea mai oxidata (SO42-), cat si cea mai redusa (S2- din H2S sau din sulfuri), dar si in forma sa intermediara de S elementar (So). Conversia S de la o forma chimica la alta este predominant, rezultatul activitatii bacteriene.
Se disting 2 clase de bacterii chimiolitotrofe care oxideaza compusii redusi ai S:
cele care cresc la pH neutru
cele care cresc la pH acid. Unele dintre acidofile pot folosi i Fe2+ ca donor de e-.
Compusii cu S cei mai folositi ca donori de e- in nutritia chimiolitotrofa sunt:

In aceste reactii se elibereaza cantitati mari de E. O parte genereaza forta proton-motrice, utilizata in sinteza ATP.
In reactiile de oxidare a H2S, So i S2O32-, unul dintre produse este H+. Se formeaza H2SO4 si pH scade chiar sub valoarea 1.
Prin oxidarea H2S (forma cea mai redusa a S) se formeaza So foarte instabil. Unele bacterii care oxideaza H2S depun So sub forma incluziilor citoplasmatice. So constituie rezerva de energie, deoarece dupa epuizarea H2S, celula ii obtine energia prin oxidarea So din incluzii.
So adaugat in mediu este utilizat ca donor de e-. Bacteriile sulfuroase cresc atasate pe particula de S, datorita insolubilitatii So si ii obtin energia prin oxidarea atomilor de sulf. Progresiv, pe masura ce este oxidata, particula de sulf trece in solutie.
In conditii de autotrofie, bacteriile sulfuroase fixeaza CO2 pe calea ciclului Calvin.
Bacteriile sulf-oxidante (Beggiatoa, Thiobacillus )sunt chimiolitotrofe facultative, deoarece se pot dezvolta si organotrof in prezenta unor substraturi organice. Beggiatoa oxideaza H2S din apele uzate si acumuleaza granule de So in citoplasma, pe care il poate oxida la SO42-. Sursa de C este reprezentata de compusii organici. Cresc organotrof in rizosfera plantelor din mediile inundate (orez), anoxice, la granita dintre mediul anoxic al solului si mediul aerob al radacinii, unde oxideaza H2S, avand rol benefic pentru planta. Plantele favorizeaza creterea bacteriei in rizosfera, datorita producerii catalazei.
Beggiatoa, Sphaerotilus formeaza flocoane laxe si produc fenomenul de "umflare" a namolului activ atunci cand devin preponderente fata de bacteriile zoogleale.
Unele bacterii sulf-oxidante cresc numai in conditii de mixotrofie. Ca sursa de energie folosesc H2S si un compus organic.
Bacteriile care oxideaza compusii fierului
Oxidarea aeroba a Fe, de la starea feroasa (Fe2+) la cea ferica (Fe3+) este o reactie furnizoare de energie pentru unele bacterii.
Bacteriile din g. Gallionella, Thiobacillus ferrooxidans oxideaza Fe2+ la Fe3+. Cantitatea de energia rezultata din acest proces este mica, fiind folosita pentru fixarea CO2. De aceea, bacteriile ferice trebuie sa oxideze o cantitate mare de Fe2+ pentru cretere. Facultativ sunt organotrofe.
Fe3+ formeaza un precipitat (Fe(OH)3), insolubil in apa. Bacteriile care oxideaza compuii Fe, oxideaza si compuii S si sunt acidofile obligate, pentru ca la pH neutru, in conditii aerobe, Fe2+ este insolubil si foarte instabil, deoarece se oxideaza spontan la Fe 3+.
La pH neutru, Fe2+ este stabil numai in conditii de anaerobioza. La pH acid, Fe2+ este stabil si solubil in apa. De aceea, bacteriile care oxideaza compuii Fe sunt acidofile obligate.
Cea mai cunoscuta bacterie chimiolitotrofa care oxideaza atat compuii Fe cat si ai S este Th. ferooxidans, foarte comuna in apele acide.
Pirita (FeS2) este principala sursa de Fe2+ si oxidarea sa este benefica in practica mineritului deoarece reactia elibereaza Fe, dar este dezastruoasa din punct de vedere ecologic pentru ca acidifica mediul.
Compusii Fe si ai S sunt oxidati de Sulfolobus (Archaea), in izvoarele termale acide, in izvoarele de mina, la temperaturi de pana la l00o. Oxideaza Fe2+, H2S, So si diferiti compui organici. Creste autotrof si heterotrof.
Bacteriile care oxideaza amoniacul si nitritul
Cei mai comuni compusi anorganici, utilizati ca donori de e- sunt NH4+ i nitritul (NO2-), fiind oxidati in aerobioza de bacteriile nitrificatoare, cu o larga distributie in sol.
NH3 rezultat in procesul de amonificare este oxidat de microorganisme, la nitrati, forma utilizabila a compuilor cu azot, de majoritatea plantelor si microorganismelor. Oxidarea NH3 la nitrati este un proces biologic complex, denumit nitrificare, realizat de bacterii chemolitotrofe obligat aerobe, care nu tolereaza prezenta substantelor organice in mediul de cretere. Efectul lor pare a fi chiar toxic, deoarece inhiba creterea autotrofa.
Oxidarea biologica a NH3 la nitrati se desfaoara in trepte:
in prima etapa, NH3 este oxidat la nitriti, de catre nitritbacterii (Nitrosomonas, Nitrospira, Nitrosolobus):
![]()
In reactie, cei doi e- sunt necesari pentru reducerea unui atom de oxigen, la H2O. Amoniacul este oxidat de amonium-monooxigenaza (proteina membranara). Se formeaza NH2OH (hidroxilamina) si H2O, iar hidroxilamin-reductaza (enzima periplasmica) oxideaza NH2OH la NO2-, eliberand 4 e- (nitritarea).
in etapa a II-a, nitritii sunt oxidati la nitrati, de catre nitratbacterii (Nitrobacter):
![]()
Cea mai mare parte a energiei este eliberata in prima etapa. Oxidarea NH3 si a NO2 furnizeaza potentialul reducator necesar fixarii CO2(sursa majora de C) pe calea ciclului Calvin. O2 este acceptorul final de e-. Nitrit- si nitrat-bacteriile traiesc in asociatii stranse in sol si au rol important in fertilitatea acestuia.
Bacteriile amonium-oxidante au capacitatea de a oxida si alti compui: CO, CH3OH, CH4, hidroxil-amina, propilenul, fenolul etc. Cele mai multe din aceste reactii sunt catalizate de AMO sau de metan-monooxigenaza (MMO). Cele doua enzime au proprietati comune.
Oxidarea anaeroba a NH4+. Organisme neidentificate, care traiesc in apa menajera uzata, in conditii de anaerobie si cu un supliment de NO3- pentru stimularea denitrificarii, oxideaza NH4+ la N2:
![]()
Reactia anamox este foarte exergonica. Descoperirea anamox a discreditat ideia mai veche ca amoniul este stabil in conditii anaerobe si ca ar fi oxidat numai de bacteriile aerobe nitrificatoare.
Oxidarea unora dintre compuii anorganici (H2, NH3, NO2) este realizata si de unele bacterii chimioorganotrofe (heterotrofe), dar ele nu cresc pe medii anorganice deoarece nu pot utiliza CO2 ca sursa de carbon. Din aparatul lor enzimatic lipsesc enzimele ciclului Calvin.
Deoarece moleculele anorganice pe care le oxideaza contin o cantitate mica de energie, microorganismele chimiolitotrofe se dezvolta anevoios si furnizeaza o masa celulara saraca. Pe de alta parte, fixarea reductiva a CO2 in ciclul Calvin necesita un potential reducator ridicat, pentru a aduce C din CO2, la nvelul de oxidare caracteristic glucidelor.
Chimiolitotrofia este o proprietate fiziologica exceptionala, prezenta numai la procariote. Bacteriile chimiolitotrofe convertesc CO2 la compui organici, in absenta procesului fotosintetic.
Fixarea CO2 la chimiolitotrofe. Ciclul Calvin
Calea principala prin care CO2 este incorporat in substante organice a fost descrisa de Calvin, Benson si Basshan (l946), la algele verzi unicelulare Chlorella pyrenoidosa i Scenedesmus obliquus, utilizand CO2 marcat cu Cl4. Ciclul lui Calvin este cunoscut si sub denumirea de ciclul ribulozodifosfatului (RuDP).
Toate organismele necesita carbon pentru sintezele celulare. Chiar si la heterotrofe, o parte a atomilor de carbon ii are originea in CO2. La autotrofe, tot carbonul organic provine din fixarea CO2.
Fixarea CO2 in ciclul Calvin are loc intr-o serie de reactii ciclice, la intuneric, utilizand ATP si potentialul reducator sub forma NADPH, generate in reactiile de fotosinteza (la lumina) sau in cursul proceselor de oxidare a substratului anorganic.
Reactiile ciclului Calvin (fig. 53) sunt cunoscute si sub denumirea de ciclul reductiv al pentozelor. Procesul fixarii CO2 se desfaoara in 4 faze (fig. 52):

Fig 52. Reactiile enzimatice esentiale ale ciclului Calvin. a. Reactia catalizata de ribulozo-difosfat-carboxilaza. b. Treptele conversiei acidului 3-fosfogliceric la gliceraldehid-3-fosfat. c. Conversia ribulozo-5-fosfatului la ribulozo-difosfat, catalizata de fosforibulokinaza (dupa Brock, 1988).
Enzima cheie a ciclului este ribulozo-1,5-difosfat carboxilaza ce catalizeaza reactia dintre CO2 si ribulozo-difosfat. Se formeaza doua molecule de acid fosfogliceric. Atomul de C al CO2 este incorporat in una din cele doua molecule de acid fosfogliceric.
In faza a II-a acidul fosfogliceric este redus la gliceraldehid-3P:
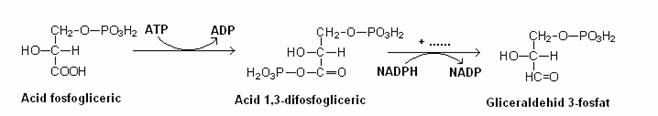
In faza de regenerare, atomul de C ajunge la nivelul reducerii din glucide:

In faza de sinteza a materialului celular se sintetizeaza glucide din acid 3-fosfogliceric.
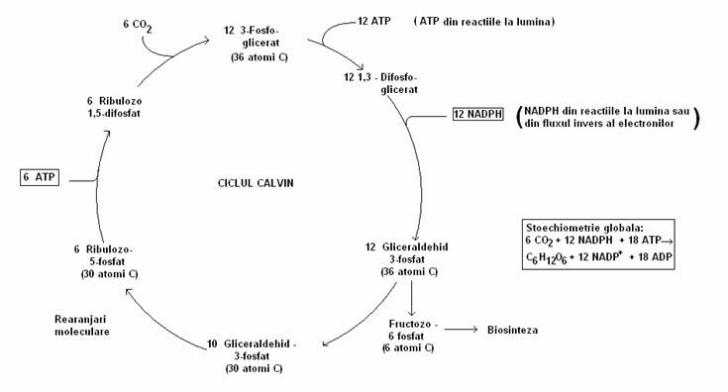
Fig. 53. Schema ciclului Calvin. Pentru fiecare 6 molecule de CO2 fixate, este produsa o molecula de fructozo-6-fosfat.
In reactiile la lumina, ATP i NADPH produse in exces sunt depozitate sub forma amidonului sau a altor compui glucidici. La bacteriile verzi, produsele de rezerva sunt glicogenul i acidul poli-b-hidroxibutiric.
Nutritia organica a chimiolitotrofelor
Toate microorganismele autotrofe folosesc aceiasi sursa de C (CO2), dar sursa de energie este diferita. Unele sunt litotrofe, iar altele sunt fototrofe. Termenul autotrof semnifica posibilitatea utilizarii CO2 ca sursa de C.
Toate microorganismele presupuse anterior a fi strict (obligat) autotrofe sunt de fapt autotrofe facultative, deoarece se pot dezvolta si heterotrof, prin metabolizarea unor compui organici adaugati in mediu (de exemplu, acetatul). Hidrogen-bacteriile utilizeaza ca potential reducator (donori de protoni), glucidele si acizii organici, in functie de conditiile de mediu.
Faptul ca microorganismele autotrofe sunt facultativ heterotrofe are o semnificatie secundara. Esentiala ramane capacitatea lor de nutritie autotrofa, ce consta in incorporarea CO2 in compui organici, proces denumit fixarea CO2.
Sursa de azot este NH3, NO3- sau N2. Din compusii anorganici simpli, ele sintetizeaza toate moleculele organice caracteristice organismelor vii.
Cel putin o parte a carbonului celular poate fi obtinuta din surse organice, care sunt utilizate preferential fata de CO2, daca ele constituie un amestec in proportii adecvate. Plasticitatea metabolica adaptativa a microorganismelor merge de la capacitatea de crestere autotrofa, pana la cea de crestere heterotrofa, in functie de conditiile de mediu.
In vitro, chmiolitotrofele au o capacitate limitata de a utiliza compuii organici ca sursa de carbon si energie. Compusii organici pot inlocui numai partial CO2 ca sursa de carbon, cel putin pentru izolatele proaspete de bacterii chimiolitotrofe, deoarece sunt inhibitori ai cresterii datorita efectelor toxice: piruvatul are efect toxic; acetatul este cel mai bine utilizat dintre compuii organici, iar aminoacizii si zaharurile sunt asimilate intr-o masura mai mica. Aminoacizii sunt inhibitori ai cresterii.
Mecanismul inhibitor al cresterii, ca si in cazul bacteriilor heterotrofe este dezechilibrul cantitativ al aminoacizilor. Acest mecanism este sugerat de faptul ca toxicitatea aminoacizilor individuali pentru chimiolitotrofele obligate poate fi reversata de alti aminoacizi sau de amestecul lor echilibrat.
Chimiolitotrofele pastreaza o dependenta partiala de CO2, care este fixat in ciclul Calvin. Exista insa diferente ale gradului de sensibilitate: un compus organic care la o concentratie prag are efect toxic pentru o specie de microorganisme, poate fi stimulator pentru altele.
Capacitatea limitata a chimiolitotrofelor de a asimila compusii organici s-a explicat prin absenta mecanismelor ce mediaza transportul diferitelor molecule nutritive.
In concluzie, relatiile bacteriilor chimiolitotrofe cu compusii organici sunt complexe si acopera un spectru larg, de la o utilizare minimala pana la sustinerea completa a creterii.
Nutritia chimioorganotrofa (heterotrofa)
Majoritatea bacteriilor au o nutritie de tip chimioorganotrof. Ele nu au capacitatea de a folosi moleculele anorganice simple ca sursa reducatoare si potential reducator. Din punct de vedere fiziologic sunt foarte heterogene. In raport cu bacteriile chimiolitotrofe, cele chimioorganotrofe au numeroase incapacitati de sinteza si in consecinta sunt dependente de prezenta in mediu, a compuilor organici pe care ii folosesc ca sursa de carbon pentru sinteza propriilor molecule si ca sursa de energie in reactiile de catabolism aerob sau anaerob.
Mediul de crestere trebuie sa asigure prezenta metabolitilor esentiali pe care celulele nu-l pot sintetiza.
In conceptia actuala, unificatoare cu privire la metabolismul bacterian, practic toate bacteriile au nevoie de acelasi set de metaboliti esentiali, deoarece caile metabolice sunt comune. Diferentele intre autotrofe si heterotrofe constau in gradul diferit de complexitate a moleculelor pe care celulele le iau din mediu.
Bacteriile heterotrofe izolate din mediile naturale sunt prototrofe, adica se dezvolta pe un mediu minimal care contine o sursa organica de carbon si energie i un compus anorganic cu azot. Din acesti compusi, ele ii sintetizeaza toti metabolitii esentiali.
Experimental, prin mutageneza, din tulpinile prototrofe se obtin mutante auxotrofe, care necesita adaugarea in mediul nutritiv a unuia sau mai multor factori de crestere, datorita pierderii cailor corespunzatoare de sinteza.
Printre bacteriile heterotrofe, gradul de dependenta fata de complexitatea mediului este foarte variabil. La unele bacterii patogene, nevoia de compui organici compleci este foarte mare si de aceea nu pot fi cultivate decat pe medii la care se adauga lichide biologice: ser sanguin, sange, lichid ascitic.
Unele microorganisme heterotrofe (patogene sau saprobionte) nu au fost cultivate pe medii inerte, oricat de complexe, ci numai pe un substrat viu (culturi de celule, ou embrionat, organisme animale). Heterotrofia este interpretata ca rezultat al unui proces de evolutie, la care echipamentul enzimatic s-a simplificat in sensul pierderii capacitatii de a face biosinteza unor enzime, ceea ce se reflecta in incapacitatea de a sintetiza anumiti metaboliti esentiali. Acesti metaboliti trebuie adaugati in mediul de cretere.
In concluzie, echipamentul enzimatic al microorganismelor heterotrofe este mai simplu decat al celor autotrofe. In grupul larg al organismelor heterotrofe exista de asemenea o scara ampla a diversitatii capacitatilor de sinteza, de la cele prototrofe, capabile sa creasca pe medii minimale, pana la cele cu incapacitati multiple de sinteza a unor substante care trebuie adaugate in mediul de cultivare, denumiti factori de crestere sau vitamine ale microorganismelor.
Capacitatile de biosinteza realizeaza un continuum descrescator de la microorganismele autotrofe care ii sintetizeaza toti metabolitii esentiali, la cele heterotrofe, dependente de numeroi factori de crestere. Trecerea de la nutritia autotrofa la cea heterotrofa o realizeaza microorganismele prototrofe, care cresc pe un mediu minimal ce contine un compus organic (glucidic) ca sursa de carbon si energie si o sursa de azot anorganic.
Factorii de crestere
Notiunea "factori de crestere" s-a definit odata cu constatarea ca unele microorganisme cresc numai daca, in afara de sursele de azot si de carbon propriu-zise, in mediu se mai adauga o serie de substante esentiale pentru metabolismul lor.
Factorii de crestere sunt metaboliti esentiali, indispensabili mentinerii viabilitatii si creterii, pe care microorganismele nu pot sa-i sintetizeze.
Data fiind unitatea fundamentala a mecanismelor biochimice ale tuturor celulelor bacteriene, necesarul de factori de crestere este unitar in intreaga lume bacteriana. Deosebirea esentiala consta in originea lor. Bacteriile prototrofe sintetizeaza toti metabolitii esentiali pornind de la o sursa organica de carbon si energie. La bacteriile prototrofe, factorii de cretere au origine endogena si nevoia celulei pentru aceste molecule este mascata.
Bacteriile autotrofe au cele mai mari capacitati de biosinteza. Ele sintetizeaza toti factorii de crestere. Cele prototrofe au capacitati intermediare, iar cele heterotrofe au pierdut diferite capacitati de biosinteza: unii factori de crestere pot fi sintetizati, dar cei care nu se sintetizeaza trebuie adaugati in mediul de crestere, din surse externe.
Nevoia de factori de crestere este individuala pentru fiecare tulpina bacteriana si de aceea notiunea are un caracter relativ si se definete numai in raport cu un mediu de baza. Factorii de crestere sunt molecule mici, niciodata mari si indeplinesc urmatoarele functii:
precursori ai unor molecule cu rol structural (aminoacizi, peptide, baze purinice sau pirimidinice si acizi grasi;
factori catalitici cu rol de coenzime, denumite generic ''vitamine' datorita rolului analog cu acela al vitaminelor celulei eucariote.
Factorii de crestere cu rol structural au actiune cantitativa, adica nivelul creterii culturii celulare este proportional cu concentratia factorului de crestere cu care se suplimenteaza mediul unei tulpini auxotrofe. Concentratia de 10 mg/ml este optima.
Purinele si pirimidinele sunt componente ale nucleotidelor, dar intra si in alcatuirea unor coenzime. Ele pot fi adaugate in mediu sub forma bazei libere sau sub forma unui nucleozid. Forma nucleotidica (care contine grupul fosfat) nu este accesibila, deoarece in aceasta forma compusul nu traverseaza membrana celulei.
Incapacitatea de a sintetiza un aminoacid este datorata absentei enzimelor necesare catalizei reactiilor corespunzatoare.
Factorii de crestere cu rol structural conditioneaza desfaurarea biosintezei macromoleculelor (proteine, acizi nucleici, lipide).
Factorii de crestere cu rol catalitic au actiune oligodinamica si de aceea sunt necesari in cantitati foarte mici (l mg/ml). Din aceasta categorie fac parte vitaminele, care intra in alcatuirea coenzimelor. Majoritatea microorganismelor sintetizeaza toate componentele coenzimelor, dar cele cu una sau mai multe incapacitati de sinteza trebuie aprovizionate cu aceste enzime sub forma vitaminelor.
Acidul para-amino-benzoic (APAB) este precursorul acidului folic, iar acesta, sub forma acidului tetrahidrofolic are rol in metabolismul compuilor cu un atom de carbon si in transportul grupului formil si metil. Actiunea APAB este inhibata de sulfamide, care se substituie APAB prin competitie. Astfel, sinteza acidului folic si toata calea metabolica dependenta de acidul folic este blocata.
Biotina este o vitamina purtatoare a COO- in biosinteza acizilor grai, in reactiile de -decarboxilare si in cele de fixare a CO2 in reactiile ciclului Calvin. Este un derivat ciclic al ureii. Avidina - proteina specifica albuului de ou, leaga ferm biotina, care este astfel inactivata. Prin incalzire, avidina se denatureaza, se inactiveaza si pierde capacitatea de a lega biotina.
Acidul lipoic are rol in transferul H2 in reactiile de decarboxilare oxidativa a piruvatului si alfa-cetoglutaratului.

Acidul nicotinic este precursorul NAD, la randul sau avand rol in transferul e- in reactiile de oxido-reducere.
Acidul pantotenic este precursorul coenzimei A. Coenzima A activeaza acetilul din diferitii sai compui. CoA este factor de crestere pentru L. bulgaricus.
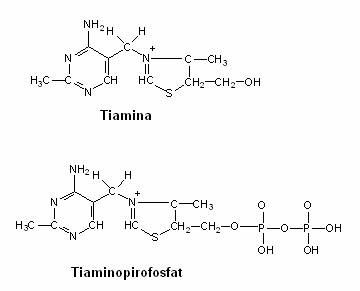
Tiamina (vitamina B1) are rol in reactiile de α-decarboxilare. Tiamin-pirofosfatul este coenzima decarboxilazelor (fig. 55), avand rol in decarboxilarea oxidativa a acidului piruvic (in glicoliza) si a acidului α-cetoglutaric in ciclul Krebs.
Riboflavina (vitamina B2) este precursorul FMN si FAD, componente ale flavoproteinelor, cu rol in transportul e-.
Piridoxina (vitamina B6) este coenzima cu rol in metabolismul aminoacizilor si cetoacizilor (coenzima a reactiilor de dezaminare si decarboxilare).
Cobalamina (vitamina B12) catalizeaza reactia de sinteza a dezoxiribozei, fermentatia glutamatului etc. Contine Co legat cu mare afinitate.
Vitamina K are rol in transportul e- si in sinteza sfingolipidelor.
Coenzima M (CoM) este necesara unor bacterii metanogene si are rol in metanogeneza.
Hidroxamatii sunt compui care leaga Fe, il solubilizeaza din compuii sai si il transporta in celula.
Hematina (factorul X) intra in alcatuirea hemoproteinelor (citocromi, catalaza) care au rol in transportul e-, pe catena de respiratie celulara.
Factorii stimulatori de cretere sunt substante neesentiale pentru creterea si multiplicarea unor microorganisme, dupa adaugarea lor in mediu. Microorganismele sintetizeaza substantele din aceasta categorie, dar in cantitati insuficiente, care nu satisfac integral necesitatile dezvoltarii optime a culturii. Prin urmare, creterea are loc cu o rata scazuta. Adaugarea factorului stimulator al creterii, restabilete rata optima de crestere si diviziune a celulelor.
Semnificatia biologica a factorilor de cretere. Dupa A. Lwoff (l944) nevoia de factori de crestere ar reflecta procesul de evolutie regresiva a unor microorganisme, prin pierderea selectiva a unor capacitati de sinteza. Evolutia organismelor ar fi insotita in mod obligatoriu de pierderea unor functii, si in special a celor de biosinteza.
Incapacitatea de sinteza poate fi de tip calitativ si se manifesta prin dependenta totala de un factor de cretere sau de tip cantitativ, ca o consecinta a diminuarii unei activitati functionale, care continua sa se exprime intr-o masura detectabila. Deficitul cantitativ se compenseaza prin suplimentarea mediului cu un factor stimulator al creterii.
Aplicatii practice. Nevoia de factori de cretere a unor microorganisme este atat de specifica, incat gradul de cretere al culturii unui microorganism auxotrof este proportional cu concentratia factorului in mediu. Tulpinile de microorganisme care manifesta o dependenta stricta si specifica fata de un factor al mediului sunt folosite pentru dozarea cantitativa a factorului de cretere. Dozajul microbiologic este adesea singura posibilitate de evaluare cantitativa a unui facor de crestere. Metoda se bazeaza pe utilizarea unui mediu care satisface toate exigentele nutritive ale tulpinii test, cu exceptia factorului care se dozeaza. Cresterea culturii este proportionala cu concentratia factorului in mediu.
Metoda se aplica pentru dozarea aminoacizilor, tiaminei, riboflavinei, acidului pantotenic, acidului nicotinic, vitaminei B12, biotinei, piridoxinei. Dozarea biologica este considerata a fi mai sensibila decat oricare metoda chimica.
Dependenta unor microorganisme de factorii de crestere este utila in studiile genetice.
Incapacitatea de sinteza a unui metabolit esential este rezultatul unei mutatii. Tulpinile auxotrofe (care necesita suplimentarea mediului cu un factor de crestere) se obtin prin mutageneza dintr-o tulpina bacteriana prototrofa (capabila sa creasca pe un mediu minimal). De exemplu, o tulpina auxotrofa ce nu sintetizeaza histidina (His-) necesita adaugarea acestui aminoacid in mediu.
Incapacitatea de sinteza poate fi unica (pentru un singur metabolit) sau multipla si constituie un caracter marcant (marker genetic) al tulpinii bacteriene. Tulpinile mutante auxotrofe sunt instrumente esentiale de lucru in domeniul geneticii microorganismelor, deoarece permit studiul modalitatii de transmitere in descendenta a unei capacitati de biosinteza, detectabila prin teste relativ simple de cultivare pe medii cu sau fara factori de crestere.
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 5255
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2025 . All rights reserved