| CATEGORII DOCUMENTE |
| Astronomie | Biofizica | Biologie | Botanica | Carti | Chimie | Copii |
| Educatie civica | Fabule ghicitori | Fizica | Gramatica | Joc | Literatura romana | Logica |
| Matematica | Poezii | Psihologie psihiatrie | Sociologie |
PROTECTIA METALELOR SI ALIAJELOR IMPOTRIVA COROZIUNII
Protectia impotriva coroziunii poate fi realizata pe mai multe cai in functie de natura mediului si conditiile tehnologice de exploatare, care sunt prezentate sintetic in tabelul 15.
Tabelul 15
Metode de protectie impotriva coroziunii
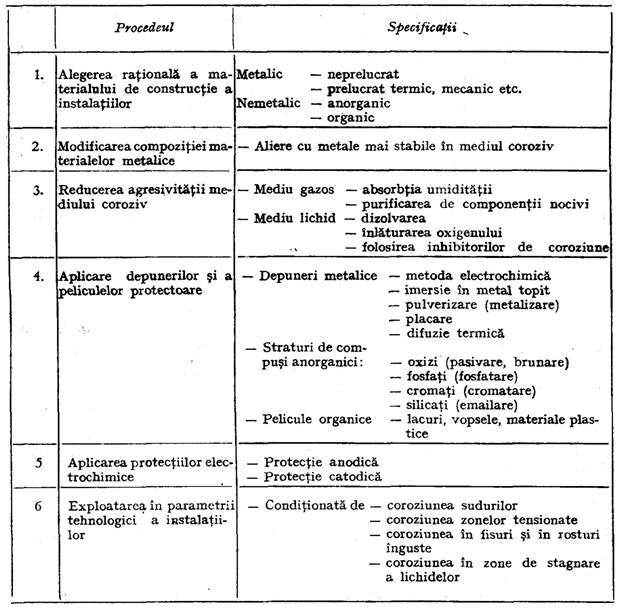
Practica de pina acum ne arata ca nu se poate obtine o protectie eficienta prin aplicarea unei singure metode, ci este necesar, de cele mai multe ori, sa se aplice 2 3 sau chiar mai multe metode pentru a se realiza o protectie anti-coroziva.
In contextul acestor aspecte, stabilirea unei solutii de protectie impotriva coroziunii, trebuie conceputa astfel ca prin efectul tehnic sa se realizeze eficienta economica maxima.
Evident, din totalitatea metodelor incluse in clasificarea prezenta, se mentioneaza doar o parte din cele utilizate in mod frecvent, in tehnica protectiei anticorozive.
Alegerea rationala a materialelor de constructie a instalatiilor
In functie de natura coroziva a mediului, de parametrii de functionalitate ai utilajului si de costuri se alege materialul care are cea mai buna comportare. De multe ori insa din considerente economice se prefera materialele mai putin rezistente dar mai ieftine.
In cazul folosirii materialelor metalice exista cai suplimentare de imbunatatire a rezistentei anticorozive, cum sunt prelucrarea termica si prelucrarea mecanica.
In ce priveste alegerea materialelor nemetalice trebuie avut in vedere ca: majoritatea prezinta o conductibilitate termica slaba si o rezistenta mecanica si uneori termica, necorespunzatoare utilizarii lor independente. De aceea ele se folosesc sub forma de captuseli pentru utilaje, chituri, straturi protectoare sau la confectionarea de piese mici (pompe, tevi, ventile etc).
2. Reducerea agresivitatii mediului corosiv
Actiunea coroziva a unui mediu se poate reduce prin modificarea compozitiei acestuia, metoda care se aplica in unele cazuri din practica cum sunt : transportul si depozitarea materialelor la cazanele de abur, evaporatoare sisteme de racire etc.
Daca mediul este gazos se procedeaza prin absorbtia agentilor agresivi cu materiale absorbante, in special silicagel pentru umiditate.
Daca mediul coroziv este lichid, acesta se prelucreaza fie pentru a indeparta agentul oxidant (oxigenul dizolvat), fie prin adaugarea unor substante care reduc viteza de distrugere a metalului numite inhibitori de coroziune.
indepartarea oxigenului se poate realiza prin degazare termica, dezoxige-nare chimica sau pe cale electrochimica.
Degazarea termica, se bazeaza pe micsorarea solubilitatii si a presiunii partiale a gazelor dizolvate in apa (oxigen, bioxid de carbon) cu cresterea temperaturii. Apa este introdusa in degazatoare unde este incalzita la 120C si pulverizata pentru a se asigura o suprafata mare de contact intre faza lichida si gazoasa.
Prin dezoxigenarea chimica, oxigenul dizolvat, este legat de diferite substante. De exemplu, la prelucrarea apelor din cazanele.de presiune joasa si medie, dezoxigenarea se realizeaza cu substante reducatoare cum ar fi, sulfit de sodiu, bioxid de sulf. Reactia simplificata de dezoxigenare a apei cu sulfit de sodiu este:
![]() 2Na2SO3
+ O2 2Na2SO.
2Na2SO3
+ O2 2Na2SO.
Sulfatul de sodiu rezultat nu este coroziv.
In unele centrale electrice se foloseste cu rezultate bune dezoxigenarea cu hidrat de hidrazina (N2H4 . H2O). La incalzire, hidratul de hidrazina se oxideaza dupa reactia globala:
![]()
Trebuie avut in vedereca reactivii de dezoxigenare trebuie bine dozati spre a evita o serie de reactii secundare nedorite. Dezoxigenarea electrochimica consta in trecerea apei printr-un sistem de celule de electroliza, prevazute cu electrozi de otel, in care oxigenul se consuma in urmatoarele procese:
la catod:![]() {reactie de
reducere);
{reactie de
reducere);
la anod:![]() (reactiede
oxidare).
(reactiede
oxidare).
sau,
![]()

Fig. 54. Modul de actiune a unui inhibitor de coroziune
a) mediu coroziv cu inhibitor de coroziune; b) absorbtia moleculelor inhibitorului pe suprafata metalului; 1-grupare cu afinitate fata de suprafata metalica; 2 radical molecular hidrofob.
Metoda asigura indepartarea totala a oxigenului, dar are dezavantajul ca apa epurata trebuie filtrata pentru separarea precipitatelor formate.
Inhibitorii de coroziune, dupa natura procesului pe care-1 inhiba se pot grupa in inhibitori anodici Si inhibitori Catodici atit anorganici cat si de natura organica.
Ca inhibitori organici de coroziune se pot folosi diferite amine, piridine, tiouree, chinolene si alti compusi care se absorb la suprafata metalului (fig. ) scazind viteza procesului anodic sau a procesului catodic sau pe amindoua.
Acesti inhibitori se folosesc mai ales la combaterea coroziunii in medii acide.
Dintre inhibitorii anodici mai importanti sunt oxidantii (K2Cr207, NaNO3), iar din categoria inhibitorilor catodici fac parte substantele reducatoare care consuma oxigenul dizolvat in apa, trecind la produsi inofensivi din punct de vedere coroziv.
In cadrul Institutului Politehnic Bucuresti se desfasoara importante activitati de cercetare si productie privind realizarea si imbunatatirea inhibitorilor de coroziune, sub aspectul sporirii actiunii selective a acestora pentru a facilita folosirea lor in procesul de decapare in care agentul de lucru sa distruga stratul de oxizi fara a afecta metalul suport.
Produsele sunt livrate sub denumirea de "Cosintam'.
3. Modificarea compozitiei materialelor metalice
Pentru elaborarea unor materiale metalice rezistente la coroziune, in practica se aplica o metoda de frinare a proceselor anodice prin schimbarea compozitiei acestora, adica prin adaugarea unor componenti de aliere la metalul sau aliajul de protejat.
Dintre diversele tipuri de aliaje, mai stabile sunt cele cu structura chimica omogena, de solutii solide.
Cercetind comportarea anticoroziva a solutiilor solide, Tammann a stabilit o regula, numita regula limitelor de rezistenta chimica sau regula n/8.
Dupa aceasta regula, rezistenta la coroziune a aliajelor cu structura de solutii solide creste brusc cu variatia compozitiei, in momentul cind proportia din aliaj a componentului stabil, fata de a componentului instabil in mediu coroziv, atinge fractiunea n/8, unde n este un numar intreg.
Valoarea limitei de stabilitate este in functie de caracterul mediului dat si de natura componentului rezistent. Actiunea protectoare exercitata de metalul mai nobil din solutia solida poate fi explicata printr-un efect caracteristic de ecranare.
Se poate considera ca in primele momente ale contactului cu electrolitul, se corodeaza metalul mai putin nobil, obtinindu-se o suprafata formata din componentul mai nobil, care protejeaza aliajul impotriva coroziunii.
Aceasta protectie este realizata numai daca distantele interatomice ale metalului protector sunt mai mici decat diametrul ionilor din mediul de coroziune.
in cazul coroziunii aliajelor cu structura eterogena, este mai dificil de a stabili reguli de comportare, din cauza actiunii simultane si adeseori contrare, a mai multor factori. Se pot constata, totusi unele reguli in ce priveste influenta structurii asupra vitezei de coroziune.
Comportarea aliajelor care constau din doua faze diferite - metalul de baza si un component structural - depinde de polaritatea celor doi constituenti.
Daca metalul de baza functioneaza ca anod si nu se pasiveaza, iar componentul structural joaca rol de catod, are loc o intensificare a coroziunii metalului de baza, fata de coroziunea aceluiasi metal in stare pura.
Daca metalul de baza tinde sa se pasiveze in mediul dat, prezenta incluziunilor catodice poate sa inlesneasca pasivarea, si ca urmare, coroziunea sa fie atenuata.
Pentru a facilita intelegerea acestor procese se prezinta efectele de aliere a unor elemente chimice.
Cromul, ca element de aliere, mareste rezistenta la coroziune a tuturor otelurilor inoxidabile, formind la suprafata acestora, un strat pasiv de acoperire. La un continut de 12 13% (in prezenta unei proportii mici de carbon) capacitatea de pasivare creste brusc, fapt care se remarca, in special cu ocazia masurarii potentialului. Otelul inoxidabil cu un continut de 12 17% crom si 0,1 0,5% carbon (otel inoxidabil martensitic) prezinta o usoara tendinta de coroziune sub tensiune, in special in atmosfera marina.
Nichelul, alaturi de crom, sporeste rezistenta la coroziune a aliajelor, in solutii acide, alcaline sau de saruri, prin formarea si stabilizarea unei pelicule protectoare; se asemenea, modifica structura aliajului, imbunatatindu-i caracteristicile de ductilitate, rezistenta mecanica si capacitate de sudare.
Aliajul binar, Fe-Cr, in prezenta unei cantitati bine stabilite de nichel, formeaza grupa otelurilor inoxidabile, numite austenitice, dintre care, otelul Cr-Ni, 18 8, constituie tipul fundamental.
Molibdenul, adaugat in proportie de 2 4% la otelul
austenitic Cr Ni, 18 8, formeaza o alta
grupa importanta de oteluri care poarta denumirea de 18 8
Rolul molibdenului este mai dificil de tratat. Se apreciaza ca prezenta lui intensifica polarizarea anodica, adica tinde sa reduca viteza de crestere a alveolelor de coroziune, atunci cind acestea se formeaza intimplator.
Titanul, niobiul si tantalul, se adauga aliajelor pentru prevenirea coroziunii intercristaline, prin formarea unor carburi stabile. Aceste elemente poarta numele de elemente stabilizatoare. Se mentioneaza totusi ca otelurile cu continut din elementele stabilizatoare, prezinta si unele dificultati tehnologice, evidentiate mai ales in procesul de sudura al pieselor cu sectiuni mari. in acest sens sunt cunoscute fenomenele de coroziune in lama de cutit - a cusaturilor sudate in otelurile austenitice stabilizate cu titan sau niobiu.
4. Aplicarea de depuneri si pelicule protectoare
Metoda protectiei prin depuneri protectoare consta in acoperirea suprafetei metalice cu un strat, care constituie o bariera intre suprafata de protejat si mediul coroziv.
Acoperirea suprafetelor metalice poate fi realizata cu straturi metalice sau nemetalice, sau cu unii compusi rezistenti la coroziune.
Depunerea straturilor metalice protectoare
Straturile metalice protectoare pot fi depuse prin imersie in metal topit, placare, pulverizare (metalizare), difuziune termica si pe cale electrochimica.
Imersia in metal topit consta din introducerea obiectului intr-o baie de metal topit si apoi racirea lui in aer. Straturile obtinute sunt compacte, aderente, insa neomogene din punct de vedere al grosimii lor.
Pe aceasta cale se depun zincul, staniul si plumbul mai ales pe table, sirme si obiecte de uz casnic din otel.
Placarea sau metoda mecano-termica consta in laminarea sau presarea la cald a celor doua metale.
In practica este raspindita placarea otelului carbon cu otel inoxidabil, cupru,-nichel, tantal, aliaj monel etc.
Metalizarea consta in trimiterea pe suprafata ce trebuie protejata a unui metal topit puternic dispersat cu ajutorul aerului comprimat.
Metalul lovindu-se de suprafata de protejat este retinut sub forma unei depuneri solzoase. Prin aceasta metoda se pot depune: aluminiul, zincul, cadmiul, staniul, plumbul, nichelul, bronzul si otelul inoxidabil.
Depunerile prin difuziune termica se obtin prin contactul dintre suprafata de acoperit si pulbere sau vaporii de metal protector la temperaturi inalte (oxiacetilenice, in arc electric sau jet de plasma).
Se depun pe aceasta cale zincul, aluminiul, cromul si siliciul.
Depunerea metalelor pe cale electrochimica se realizeaza prin electroliza solutiilor apoase de saruri simple sau complexe care contin ionul metalului ce trebuie depus. Piesa de acoperit constituie catodul, iar anodul poate fi confectionat fie dintr-un material inert (anod insolubil) fie din metalul care urmeaza sa fie depus (anod solubil).
In prezent se folosesc in scopul depunerii ca straturi protectoare aproximativ 35 metale si aliaje. Toate depunerile care se obtin pe un electrod introdus intr-o solutie apoasa a unui electrolit, ca urmare a trecerii curentului electric, poarta numele de depuneri electrochimice conventionale. In contrast, se vor defini ca, neconventionale, acele depuneri la care tehnologia mentionata este modificata. Din motive chimico-fizice, un mare numar de metale nu se pot depune din baile conventionale. in principiu, se mentioneaza trei posibilitati de modificare a conditiilor obisnuite de depunere, modificari care de fapt s-au realizat in practica.
Diferitele tipuri de depuneri neconventionale, permit in general sa se obtina caracteristici deosebit de interesante din punct de vedere mecanic, cu duritate ridicata, rezistenta la coroziune, la uzura, la solicitari termice.
5. Factorii care influenteaza depunerile metalelor pe cale electrochimica.
Marimea, grosimea si forma stratului de metal protector depus electrochimie, determinate de conditiile utilizarii materialului protejat depind, in principal, de densitatea de curent folosita, de natura metalului, de compozitia si pH-ul mediului electrolitic, de temperatura, de starea suprafetei metalului suport, de suprafata catodica care se modifica in timpul depunerii.
Starea suprafetei metalului suport. Calitatea stratului de metal protector depus electrochimie este puternic influentata de suprafata metalului suport, stratul protector fiind eficient numai daca este depus pe suprafete metalice perfect curate. Impuritatile aflate pe piesele metalice pot fi: grasimi, uleiuri, praf de slefuire, nisip, grafit, oxizi in forma de rugina, tunder, arsuri de recoacere care s-au format in cursul fabricatiei. Pentru indepartarea acestor impuritati obiectele ce se protejeaza cu straturi metalice se supun unor lucrari de pregatire prealabila a suprafetelor, operatii ce sunt descrise in continuare.
Degresarea obiectelor se face in scopul indepartarii materiilor grase, de orice natura, operatie efectuata pina cind suprafata piesei metalice este udata continuu cu apa.
Degresarea cu solventi este tipul cel mai cunoscut, intrucat este cel mai simplu. Se utilizeaza fie benzine usoare, fie benzenul sau produse clorurate.
Cind se trece insa la degresarea metalelor intr-o linie continua de productie, nu se recomanda utilizarea solventilor ai caror vapori ar face explozie la cea mai mica scinteie, ci solventi clorurati (tricloretilena, percloretilena) care nu prezinta pericolul amintit. Si in acest caz vaporii au o anumita nocivitate; folosirea lor este reglementata. Atelierele de degresare cu solventi trebuie sa fie prevazute cu sisteme de ventilatie. In cazul unor cantitati foarte mari utilizate, se izoleaza statia de degresare, iar comenzile se realizeaza din exterior.
Calitatile bailor de degresare chimica sint: randamentul pe unitatea de suprafata, rapiditatea si usurinta de clatire a piesei, stabilitatea pina la fierbere (intrucat adeseori solutiile de degresare sunt folosite la temperaturi ridicate).
Conditiile de degresare sunt date in tabelul VI.
Decaparea obiectelor se efectueaza in scopul indepartarii in special a straturilor de oxizi metalici de pe suprafata acestora.
In principiu, fiecare tratament de decapare, trebuie sa fie precedat de o degresare pentru indepartarea oricarei urme de grasimi. In caz contrar, intervine o diferentiere a gradului de decapare, avind drept consecinta o eroziune in relief. Degresarea preliminara se face, de regula, in mediu alcalin, la cald, sau cu diferiti solventi.
Demetalizarea este un caz particular de decapare care consta in a indeparta un metal depus electrolitic, prin pulverizare, prin imersie etc, astfel incat sa se recupereze metalul depus dar si metalul de baza.
Densitatea de curent. Formarea depozitului catodic cuprinde doua procese care se desfasoara paralel: aparitia germenului cristalin si cresterea mai departe a cristalelor.
Structura depozitului catodic depinde in special de modul cum se desfasoara cresterea mai departe a centrelor de cristalizare.
Daca viteza de aparitie a germenilor cristalini depaseste viteza de crestere a cristalului, cristalele abia aparute inceteaza sa mai creasca si apar noi centre de cristalizare; se obtin depozite formate din cristale mici, compacte si lucioase ca in cazul fierului si nichelului.
Viteza de crestere a germenilor cristalini este influentata de densitatea de curent.
La densitati mici de curent are loc numai o polarizare de concentratie slaba si viteza de crestere a germenilor cristalini depaseste viteza lor de aparitie, deci se vor obtine depozite macrocristaline sub forma de spirale sau piramide care se dezvolta pe masura ce electroliza avanseaza.
Pe masura ce densitatea de curent si polarizarea creste, viteza de formare a germenilor cristalini se mareste si depozitul devine din ce in ce mai micro-cristalin, avind o granulatie fina.
La densitati foarte mari de curent, concentratia ionilor de metal din imediata vecinatate a cristalelor scade puternic, cristalele tind sa creasca orientindu-se spre straturile solutiei in care concentratia acestor ioni este mai mare. in acest caz depozitul are o structura dendritica sau spongioasa.
Adeseori densitatea de curent poate influenta si textura depozitului cristalin. Diferitele fete ale cristalului nu sunt identice din punct de vedere energetic si prin urmare potentialul de descarcare poate fi diferit pe diferitele fete ale cristalului. De aceea, la o anumita densitate de curent, deci la o anumita supratensiune, va fi favorizata cresterea unei anumite fete a cristalului, ceea ce duce la o anumita textura a metalului depus.
Reducerea ionilor de hidrogen. in procesele electrochimice de reducere si depunere a ionilor metalici din solutii apoase de saruri, la catod are loc simultan si reducerea ionilor de hidrogen, deoarece in aceste solutii in afara cationilor metalici exista intotdeauna ioni H+ , care pot influenta procesele catodice.
Participarea ionilor H+ la reactia catodica si la transportul sarcinii electrice cauzeaza o modificare a pH-ului in stratul precatodic. Astfel, daca viteza de descarcare a ionilor H+, depaseste viteza lor de transport in stratul precatodic, solutia saraceste in ioni H+ si pH-ul se modifica.
Cind pH-ul atinge valori la care unii cationi formeaza hidroxizi greu solubili sau saruri bazice se formeaza precipitate care influenteaza negativ depozitul metalic. Pentru a compensa variatia de pH in stratul precatodic se adauga substante cu actiune tampon (acid boric, saruri de amoniu).
Daca viteza de descarcare a H+ este mai mica decat viteza de transport spre catod, aciditatea solutiei va creste, ceea ce va micsora randamentul depunerii metalului. in acest caz variatiile de pH sunt micsorate prin agitarea si incalzirea solutiei.
In cazul in care potentialul catodului este mai negativ decat V (potentialul de descarcare a hidrogenului in solutii apoase) atunci se va produce reducerea catodica a ambilor ioni.
Daca potentialul electrodului e mai pozitiv decat
potentialul de echilibru al hidrogenului, nici hidrogenul si nici
metalul nu se pot reduce; daca potentialul are o valoare situata
intre potentialul de echilibru al metalului eeM si ![]() are loc numai reducerea
hidrogenului si la valori mai negative decat seM are loc reducerea
simultana a celor doi ioni.
are loc numai reducerea
hidrogenului si la valori mai negative decat seM are loc reducerea
simultana a celor doi ioni.
Pe linga cele prezentate, este posibila dizolvarea (absorbtia) hidrogenului atomic in metale, care poate sa produca denaturari in reteaua cristalina a metalului, micsorind calitatile depozitului, deoarece aparitia substantelor straine la suprafata depozitului metalic in crestere impiedica descarcarea ionului metalic si incorporarea lui in reteaua cristalina. Acest efect este cu atit mai pronuntat cu cat tendinta de pasivare a metalului este mai mare, care este favorizata de oxigenul dizolvat, impuritati constituite din substante organice si otravuri catalitice etc.
Din acest punct de vedere proprietatile electrochimice ale fierului si nichelului obtinuti pe cale electrolitica din solutii apoase se deosebesc de proprietatile acelorasi metale dupa incalzirea ulterioara, in urma careia s-a eliminat H.
Straturi protectoare de compusi anorganici. Depunerile de natura anorganica - oxizi, fosfati, cromati, silicati, se folosesc larg in industrie atit pentru protectia anticoroziva cat si in scop decorativ. Peliculele de oxizi si fosfati, pe fier servesc uneori, pentru obtinerea straturilor intermediare, in vederea aplicarii lacurilor si vopselelor.
Straturi oxidice. Formarea unor pelicule de oxizi aderenti la suprafata metalelor si aliajelor determina o crestere a rezistentei acestora la coroziune datorita deplasarii potentialului lor in sens pozitiv (pasivizare) trecind din stare activa in stare pasiva.
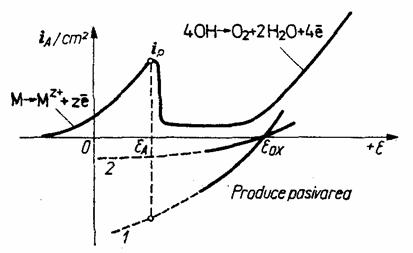
Fig. 55. Conditiile de pasivare a unui metal in contact cu o solutie oxidanta:es potential stationar; eox -potential redox; curba 1 reducerea oxidantului care poate produce pasivarea: curba 2 reducerea oxidantului care nu poate produce pasivarea.
Stabilirea domeniului corespunzator formarii peliculelor pasive de oxizi, rezistente la coroziune, se realizeaza prin studierea diagramelor de dizolvare anodica stabilita prin metoda potentiostatica.
Pe suprafata metalului decurg doua procese: oxidarea si reducerea. Tranzitia de la starea activa la starea pasiva va fi obtinuta prin suprapunerea unei curbe de polarizare catodica peste curba anodica (fig. 55).
Din diagrama rezulta ca un metal prezentind tranzitia activ-pasiv se va pasiva spontan daca densitatea curentului catodic la potentialul de pasivare, ic(ep) este egala sau mai mare decat densitatea curentului anodic, critic, ip.
Acest criteriu serveste la definirea indicelui de pasivitate P, care reprezinta o masura a tendintei de pasivare spontana a unui metal intr-un mediu dat:
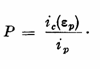
Daca P 1 aliajul se pasiveaza spontan, daca P < 1 sistemul nu poate trece spontan din starea activa in starea pasiva.
Cele mai multe metale se pasiveaza in medii oxidante, cum sunt: HNO3, HClO3, KClO3, K2Cr2O7, KMnO4. Unele metale, ca: Ti, Cr, Al, TI, se pasiveaza prin simplul contact cu oxigenul din aer si ramin in stare pasivatacat timp pelicula superficiala de oxid nu este deteriorata de alti factori externi (prezenta ionilor Br , Cl I a solutiilor alcaline pentru Al, Zn sau factori mecanici).
Oxidarea (brunarea) fierului si a otelului se efectueaza pe cale chimica; conditiile de lucru si compozitia solutiei utilizate, sunt cuprinse in tabelul 16.
Durata operatiei de oxidare este in functie de compozitia otelului: cel cu continut de carbon sub 0,4% precum si otelurile aliate, se oxideaza mai greu.
Tabelul 16.
Oxidarea (brunarea) fierului si a otelului

Oxidarea aluminiului (eloxarea) se realizeaza prin tratarea metalului in diferite conditii (tabelul 17) stratul protector format fiind oxidul de aluminiu A12O3, dur si cu bune proprietati dielectrice.
In procesul de eloxare, in functie de electrolitul de baza, stratul de oxid de aluminiu format poate fi poros (cu acid sulfuric 10%, pori de 120 ; cu acidoxalic 2%, pori de 170 A; cu acid fosforic 4%, pori de 330 A) sau neporos (acid boric). Piesele eloxate neporos se folosesc in electrotehnica la obtinerea condensatoarelor.
Tabelul 17.
Oxidarea aluminiului

In unele cazuri se procedeaza si la colorarea pieselor eloxate, operatie ce poate fi facuta atit cu coloranti organici cat si cu substante anorganice. Pentru obtinerea culorii de bronz se poate folosi: acetat de cobalt 50 g/l si KMnO4 25 g/l. Pentru inchiderea porilor se procedeaza la compactizare, care se realizeaza prin fierbere in apa timp de 30 minute, care determina hidratarea oxidului de aluminiu si trecerea acestuia in boemita, AlO(OH) care are volumul mai mare. Daca compactizarea se face in solutie de K2Cr2O7 5%, timp de 15 minute, se obtine si culoarea galben.
Cromatarea se realizeaza prin introducerea pieselor de prelucrat, intr-o solutie cu continut de acid cromic sau bicromat, in prezenta unui acid (H2SO4), cind se formeaza pe suprafata obiectului, pelicule de cromati a caror grosime ajunge la 0,5 mm. Rolul peliculelor este de a mari rezistenta la coroziune in conditii atmosferice; ele servesc in general, drept grund anticorosiv si de marire a aderentei sub lacuri si vopsele.
Utilizind o solutie formata din: anhidrida cromica 150 g/l si acid sulfuric (d = 1,84 g/cm3) 3 4 g/l la temperatura camerei, dupa 3 10 secunde, se pot obtine pe piese, pelicule de cromat, neporoase si lucioase.
Pelicule protectoare din compusi organici. Protectia impotriva coroziunii se poate realiza si prin utilizarea unor substante peliculogene (din compusi organici) capabile sa produca dupa aplicarea lor pe suprafata metalica, o pelicula continua, rezistenta, etansa si aderenta la suprafata protejata.
Peliculele din substante organice asigura protectia metalelor si aliajelor prin izolarea suprafetei acestora de mediul coroziv. Domeniul primordial de utilizare a acestui procedeu de protectie impotriva coroziunii il constituie protejarea metalelor si aliajelor in conditii atmosferice, in apa, sub pamint precum si in medii chimice agresive.
Ansamblul operatiilor prin care suprafetele metalice se acopera cu pelicule organice de protectie, aderente si cu aspect decorativ corespunzator, constituie ceea ce se defineste sistem de vopsire.
Constituentii lacurilor si vopselelor anticorosive. intr-un sistem de vopsire, in functie de suprafata protejata si destinatia obiectului, se folosesc diferite materiale ce pot fi grupate in:
vopsele care sunt suspensii de pigmenti in uleiuri sicative, in rasini sintetice, in apa, care, prin uscare, dau o pelicula mata pina la semilucioasa;
lacuri care sunt solutii incolore sau slab colorate ale unor rasini naturale sau sintetice, intr-un dizolvant oarecare, cu sau fara adaos de ulei vegetal sica tiv;
emailuri care sunt suspensii de pigmenti in lacuri, dau pelicule dure si foarte lucioase;
chituri si grunduri, suspensii de materiale de umplutura si pigmenti in ulei sicativ sau in lacuri care se aplica direct pe suprafata ce urmeaza sa fie vopsita, in vederea umplerii porilor materialului respectiv si asigurarii unei mai bune aderente a vopselelor si lacurilor la suprafata protejata.
in unele sisteme de vopsire, uneori se pot intilni toate aceste produse, aplicate in urmatoarea succesiune de straturi, pornind de la suprafata metalului: grund, chit, vopsea si lac.
Substantele organice care formeaza pelicula (filmul protector) sunt uleiurile vegetale constituite din amestecuri de gliceride (esteri ai glicerinei cu diversi acizi grasi nesaturati si saturati). Dintre acizii grasi frecvent intilniti in uleiurile vegetale se mentioneaza urmatorii acizi nesaturati:
- acidul oleic: CH3 (CH2)7 CH=CH (CH2)7 COOH
- acidul linolic:
CH3 CH2 CH=CH CH2 CH=CH CH2 CH=CH (CH2)7 COOH
- acidul oleostearic:
CH3 (CH2)3 CH=CH CH=CH CH=CH (CH2)7 COOH
iar, ca acizi grasi saturati se amintesc: acidul stearic si palmitic.
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 3116
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2026 . All rights reserved