| CATEGORII DOCUMENTE |
| Alimentatie nutritie | Asistenta sociala | Cosmetica frumusete | Logopedie | Retete culinare | Sport |
DOCUMENTE SIMILARE |
||||
|
||||
I.1.Scurt istoric
Reactiile enzimatice au fost folosite din timpurile cele mai vechi pentru fabricarea vinului, a otetului, a berii si a branzei. O cercetare sistematica a lor a fost intreprinsa abia in epoca moderna. In 1713, Raumur a observat dizolvarea carnii in sucul stomacal al ciorii. De asemenea, fiziologul Spallanzani (1783) a hranit animalele cu bucati de carne invelite in retele de sarma si a observat dizolvarea carnii in stomac.
Stahl, fondatorul teoriei flogisticului, explica fermenatia ca un proces in care una din substantele prezente transmite "miscarea sa interna" substantei care fermenteaza (1697). In 1680, van Leeuwenhoeck a observat la microscop celulele drojdiei de bere, dar aceasta descoperire nu a fost luata in seama timp de doua secole. Lavoisier (1789) a facut un bilant de materiale al fermentatiei, aratand ca oxigenul, hidrogenul si carbonul din zahar se regasesc in alcoolul si bioxidul de carbon ce iau nastere. Continuarea acestor idei a condus la ecuatia lui Gay-Lussac a fermentatiei alcoolice.
Cagnard-Latour si, simultan si independent, Ktzing (1838) au atribuit fermentatia alcoolica celulelor din drojdie, considerate ca fiinte vii, probabil de natura vegetala. In aceste observatii isi are originea teoria vitalista a fermentatiei. Sustinatorul principal al acestei teorii, Pasteur, a publicat in 1857 cercetarea sa celebra asupra fermentatiei alcoolice, in care sustine sau sugereaza ca fermentatia este un proces legat direct de metabolismul celulelor drojdiei. Liebig (1839) considera dimpotriva ca fermentatia este o descompunere a zaharului, datorita unor vibratii moleculare provocate de fenomenele chimice din celulele vii ale drojdiei.
In jumatatea a doua a secolului al IXX-lea, in urma lucrarilor lui Pasteur, multi chimisti faceau deosebire intre fermentii formati sau figurati presupusi legati inseparabil de anumite elemente din celule sau chiar considerati identici cu celula vie, si fermenti neformati sau solubili, de tipul acelora din sucurile digestive sau din extractele apoase ale diferitelor materiale biologice. Fermentii neformati sunt deci substante care isi exercita actiunea si in afara celulei vii. Termenul enzima, pentru a desemna fermentii neformati, a fost introdus de Khne, in 1878.
Buchner (1897) a izolat din drojdia de bere un suc liber de orice celula si totusi capabil sa provoace fermentatia. Acest suc contine deci o enzima pe care Buchner a numit-o zimaza. Aceasta este de fapt un amestec de mai multe enzime, dupa cum s-a dovedit mai tarziu. In urma acestor descoperiri, deosebirea dintre termenii ferment si enzima a pierdut semnificatia sa. In cursul secolului al IXX-lea, au fost preparate multe extracte de enzime. Astfel, dupa ce Kirchoff a observat, in 1820, ca o componenta glutinoasa din bobul de orez incoltit, numit malt, transforma cantitati de amidon mult mai mari decat propria sa greutate, intr-un zahar solubil, maltoza, Dubrunfaut a gasit, in 1830, ca extractul apos, limpede, de malt are aceeasi actiune solubilizanta asupra amidonului ca maltul insusi. Din acest extract, Payen si Persoz (1833) au izolat prin precipitare cu etanol, prima enzima, amilaza, sub forma unui material solid alb, amorf, capabil sa solubilizeze o cantitate de amidon de 2000 de ori mai mare decat propria sa greutate. In 1830, Robiquet si Boutron-Chalard au descoperit hidroliza amigdalinei, cu extract de migdale amare, iar in 1837, Liebig si Whler au izolat enzima respectiva, numind-o emulsina. Printre primele enzime izolate, vom mai mentiona: pepsina din sucul gastric (Schwann, 1836); trepsina din sucul pancreatic (Khne, 1848); lipaza (Claude Bernard , 1849); invertaza (Mitscherlich, 1841; Berthelot, 1860); ureeaza (Musculus, 1882), etc.
Un moment istoric deosebit de important este recunoasterea clara, de catre Berzelius, in 1835, a caracterului catalitic al reactiilor enzimatice, precum si a rolului esential pentru viata animalelor si a plantelor jucat de aceste reactii.
I.2.Generaliati
Enzimele sunt catalizatori biochimici propriu-zisi, asadar sunt compusi care maresc viteza reactiilor chimice ce se desfasoara in sistemele biologice, fara sa se consume in cursul lor.
S-au efectuat lucrari numeroase de-a lungul anilor dovedindu-se prin acestea ca enzimologia constituie studiul bazelor moleculare ale vietii.
Enzimele sunt probabil mai importante decat orice alt element activ ca ajutor al digestiei si sanatatii. Pana acum s-a aratat ca sute de enzime au un rol vital in construirea sanatatii, datorita contributiei lor la procesul de digestie. Studiile viitoare probabil vor arata ca enzimele au un rol mult mai important pentru sanatate decat se cunoaste in prezent.
Nu putem trai mult fara enzime. De fapt, conceptia in sine este dependenta de aceste elemente. Ele functioneaza ca un catalizator care face ca celulele corpului sa functioneze eficient. Din momentul nasterii, enzimele fac viata posibila prin actiunile lor, reparand si construind corpul si celulele creierului. Acesti lucratori actioneaza in corp si in creier in cel mai fantastic si puternic mod. Ele lucreaza pentru o sanatate deplina. Enzimele reprezinta insasi forta intangibila a vietii. Omul nu poate reusi sa creeze enzime vii asa cum natura poate crea. Daca ar fi putut, ar fi reusit sa creeze viata sau sa readuca la viata materia moarta.
Exista miliarde de enzime in corpul nostru, si sunt sute de tipuri diferite de enzime gasite in sange, care vor descompune 5 milioane de molecule de peroxid in apa si oxigen in 60 secunde. Enzimele intestinale pot descompune moleculele de zahar si grasimi care sunt de 1 milion de ori mai mari decat greutatea lor.
Corpul nostru produce enzime atunci cand sanatatea nostra este echilibrata. Ele efectueaza toata munca din corp. Ele sunt responsabile cu lupta impotriva infectiilor, cu digestia, cu refacerea corpului - functiile lor sunt infinite. Ele lucreaza non-stop si nu obosesc niciodata sau nu-si inceteaza lucrul daca sanatatea este echilibrata. Cand sanatatea nu este in echilibru, atunci este o deficienta enzimatica. Enzimele pot fi usor extrase din alimente nutritive usor de digerat, care sunt alimente crescute intr-un sol sanatos, nefertilizat, si care sunt preparate special prin mixare, germinare, fermentare si cantitati mici de suc, nu prin gatire. Aceste enzime extind energia vitala a corpului catre o stare totala de bine. Consumarea alimentelor sanatoase este cea mai eficienta cale de a suplimenta rezerva de enzime existenta in corp, pentru a imbunatati sistemul digestiv. Cele mai importante enzime care au fost izolate in hrana sanatoasa sunt: cytochrome oxidase, un anti-oxidant necesar pentru respiratia celulelor; lipase, enzima care descompune moleculele de grasime; protease, enzima care ajuta la diestia proteinelor; amylase, enzima care faciliteza digestia amidonului; catalase, enzima ce catalizeaza descompunerea apei oxigenate in apa si oxigen in tesuturi; peroxidase, enzima ce actioneaza in acelsi mod, dar la nivel celular; transhydrogenase, enzima care ajuta in pastrarea tonusului muscular al inimii si SOD (Super Oxide Dismutase), o enzima care previne imbatranirea. Enzima pepsine ajuta la digestia proteinelor si transformarea lor in aminoacizi. Acesti aminoacizi sunt apoi transportati prin sistemul circulator in tot corpul, pentru ca acesta sa primeasca energie si sa se auto-vindece.
Exista multe motive pentru care enzimele sunt atat de importante. De exemplu, lipsa enzimelor este un factor major in declansarea leucemiilor. Atunci cand mancarea gatita intra in corp, acesta trebuie sa compenseze prin consumarea propriilor rezerve enzimatice. Este interesant de notat ca, atunci cand aceste enzime scad in calitate si putere, scade capacitatea corpului de a prelucra grasimi grele, proteine si calorii in exces. Atunci corpul devine slab si, in final, bolnav. Lipsa enzimelor este un factor important ce contribuie la majoritatea problemelor de sanatate, de la racelile comune pana la probleme mult mai grave, ca SIDA si cancerul. Aportul enzimelor va echilibra corpul, va remedia deficientele si va elimina toxinele.
Echilibrul fragil al corpului este creat si mentinut de enzime. Ele sunt instrumentele necesare pentru a forma calciul. Nu exista enzime in mancarea gatita. De fapt, mancarea gatita extrage elementele din oase si secreta elementele din rinichi. Deficientele rezultate pot cauza o slaba coordonare musculara. Unul dintre cele mai importante roluri ale enzimelor este de a ajuta procesarea fierului, care duce oxigenul peste tot in corp, pentru a fi depozitat in miliarde de celule ale epidermei si ale creierului. Avem aproximativ 5-6 miliarde de globule rosii in sange, si enzimele au nevoie de fier ca material de lucru. De asemenea, enzimele au nevoie de iod, care ajuta glanda tiroida in reglarea greutatii.
Multi oameni au oasele fragile datorita lipsei enzimelor din hrana gatita si din alimentele toxice. Fara enzime, calciul nu poate fi bine folosit. Trebuie sa nu uitam niciodata ca proteinele pe care le consumam vor fi ineficiente fara enzimele care sa le transforme in aminoacizi. Fara enzime, corpul nu se poate vindeca singur de infectii sau nu poate avea un sange sanatos. Enzimele preiau alte elemente si le transforma in cele necesare organismului.
Un rol foarte important al enzimelor este acela ca ele regleaza functionarea creierului. Creierul nu poate emite alerte atunci cand mancarea nu este nutritiva. Mancarea nehranitoare consuma energia din creier chiar si atunci cand dormim. De cele mai multe ori oamenii au probleme cu somnul datorita deficientei enzimatice din mancarea gatita sau toxica.
Fara enzime nu exista nici o cale de a ne proteja de imbolnaviri. Cand vom realiza cat este de important sa avem o sanatate perfecta vom intelege cat este de important sa ne ferim de mancarea gatita sau denaturata in orice fel, si vom apela la alimentele vii pentru o adevarata nutritie.
I.3.Natura proteica a enzimelor
Prin diferite operatii de purificare, s-a reusit sa se obtina preparate de cateva mii de ori mai active decat extractele de la care se pornise. S-a dovedit astfel ca enzimele sunt catalizatori extrem de activi chiar in concentratii foarte mici.
Prima enzima izolata in stare pura, cristalizata, a fost ureeaza (Sumner, 1962). Aceasta a fost obtinuta dintr-o varietate de fasole prin extragere cu apa si precipitarea extractului cu acetona. Au fost izolate apoi in stare cristalizata, prin salifiere din solutie apoasa cu sulfat de amoniu si sulfat de magneziu la un aumit pH, pepsina si tripsina (Northrop si Knitz, 1929) fermentul galben de oxidare, papaina, carboxipeptidaza, tirosinaza, catalaza, cateva dehidrogenaze si multe alte enzime.
Metodele pentru obtinerea enzimelor pure si masurarea greutatilor lor moleculare sunt identice acelora folosite la purificarea proteinelor. De fapt, toate enzimele cristalizate obtinute pana astazi s-au dovedit a fi fie proteine simple, fie proteide cu o grupa prostetica definita.
Inca inainte de izolarea enzimelor in stare pura era cunoscuta natura lor proteica. Se stie de mult ca enzimele nu sunt dializabile, si deci sunt substante macromoleculare, si ca ele sunt inactivate prin incalzire in aceleasi conditii in care sunt denaturate proteinele. Acei reactivi care denatureaza sau precipita proteinele inactiveaza fara exceptie enzimele. Uneori, denaturarea insotita de inactivarea enzimelor este reversibila. Prin hidroliza enzimelor se formeaza aminoacizi care se obtin si din proteine. S-au masurat grautatile moleculare ale multor enzime si s-a determinat succesiunea completa a aminoacizilor din ribonucleaza si din alte enzime.
Solubilitatea enzimelor este asemanatoare cu a globulinelor. Este posibil ca in multe celule intreaga sau aproape intreaga plasma consta din enzime. Ca toate proteinele, enzimele sunt antigeni specifici, provocand, atunci cand sunt introduse in sangele unui animal, formarea de anticorpi.
Se cunosc diferite metode pentru determinarea activitatii enzimatice, ca de exemplu: masurarea gazului degajat (CO2) sau consumat (O2), cand este cazul; urmarirea spectrofotometrica a disparitiei substratului sau acumularii produsului de reactie; consumarea unui colorant.
I.4.Activitatea catalitica a enzimelor
Enzimele sunt, precum s-a mai spus, catalizatori organici produsi de celula vie actionand asupra anumitor substante numite substraturi. In marea lor majoritate, enzimele catalizeaza reactia unei substante organice cu un compus anorganic liber sau cedat de alt compus organic (apa, acid fosforic, hidrogen, oxigen, etc.). Legile catalizei se aplica fireste si la enzime. Enzimele, ca toti catalizatorii, nu catalizeaza decat reactii termodinamic posibile, decurgand in sensul stabilirii unui echilibru. Reactiile enzimatice prezinta insa unele deosebiri caracteristice fata de reactiile catalitice obisnuite, omogene sau eterogene.
Activitatea enzimelor. Cand o reactie poate fi catalizata atat de o enzima cat si de substante simple se constanta de obicei ca reactia enzimatica decurge cu viteza mult mai mare; cu alte cuvinte, reactia enzimatica are o energie de activare mult mai mica. Astfel s-a stabil ca este necesara o concentratie de ioni de hidrogen de 10 milioane de ori mai mare decat de invertaza pentru a hidroliza o anumita cantitate de zaharoza, intr-un timp dat, la 37˚.
Datorita acestei enorme activitati catalitice, sunt suficiente de obicei concentratii foarte mici de enzima pentru a obtine efecte considerabile.
Activitatea enzimelor nu dureaza indefinit ca acea a catalizatorilor simpli si este in general mai scurta decat aceea a catalizatorilor heterogeni. In cazul reactiilor enzimatice, cu cat trece timpul, cu atat cantitatea de substrat transformata in unitatea de timp se micsoreaza, iar dupa un timp mai lung reactia practic inceteaza. Inactivarea enzimelor se explica prin denaturarea lor sau prin alte transformari datorita caracterului lor de proteine globulare. Celulele vii sintetizeaza enzime fara incetare.
Temperatura optima a reactiilor enzimatice. Viteza reactiilor enzimatice creste ca a celor mai multe reactii intre molecule covalente, cu temperatura, potrivit cunoscutei reguli a lui van't Hoff, si anume o urcare a temperaturii cu 10˚ produce o crestere a vitezei de reactie cu un coeficient 1.5 - 3. Cresterea aceasta se observa insa numai la temperaturi joase. Odata depasita o anumita temperatura optima, la care viteza este maxima, aceasta scade, iar la temperaturi mai inalte, reactia inceteaza. Fenomenul se explica prin faptul, semnalat mai sus, ca la temperaturi mai inalte, enzimele sunt inactivate prin denaturarea componentei proteice. Cele mai multe enzime devin complet inactive intre 50-80˚. Temperatura optima nu poate fi insa exact definita, caci ea variaza in limite largi, cu concentratia enzimei, cu concentratia ionilor de hidrogen si cu prezenta diferitelor impuritati ale preparatului enzimatic sau ale substratului.
Influenta pH-ului.
Dupa cum a aratat Srensen (1909), activitatea enzimelor depinde,
intr-o foarte mare masura de concentratia ionilor de hidrogen
din solutie. Curbele reprezentand variatia vitezei de reactie cu
pH-ul prezinta de obicei un maxim pronuntat la un anumit pH, in timp
ce la valori ale pH-ului diferind cu ![]() 1
fata de acest maxim, viteza de reactie prezinta valori considerabil
mai mici. Din cauza acestei particularitati este necesar ca in cursul
reactiilor enzimatice sa se mentina pH-ul optim constant,
prin folosirea de tampoane.
1
fata de acest maxim, viteza de reactie prezinta valori considerabil
mai mici. Din cauza acestei particularitati este necesar ca in cursul
reactiilor enzimatice sa se mentina pH-ul optim constant,
prin folosirea de tampoane.
Specificitatea enzimelor. O anumita enzima catalizeza numai un numar mic de reactii si de multe ori o singura reactie, spre deosebire de catalizatori obisnuiti anorganici (acizi, baze, catalizatori de hidrogenare, etc.) care activeaza practic toate reactiile posibile de un anumit tip.
Se disting multe tipuri si grade de specificitate in actiunea enzimelor. In primul rand trebuie mentionata specificitatea stereochimica, care consta in aceea ca o enzima care catalizeaza reactia unui compus optic activ este fara actiune asupra enantiomerului sau si in general, asupra izomerilor sterici ai acestui compus, supusi acelorasi conditii. Fenomenul a fost observat intai la Pasteur, care l-a folosit ca o metoda pentru separarea izomerilor optici. Vom mai aminti aici dehidrogenaza lactica din muschi, o enzima care lucreaza in colaborare cu DPN, si care dehidrogineaza acidul L-lactic la acid piruvic si hidrogeneaza acidul piruvic numai la acid L-lactic, fiind inactiva fata de acidul D-lactic. In multe microorganisme exista insa o enzima care actioneaza in mod similar dar specific numai asupra acidului D-lactic. De asemenea, peptidazele actioneaza numai asupra aminoacizilor din seria L, iar arginaza transforma prin hidroliza in ornitina si uree,numai L-arginina si este fara actiune asupra D-argininei.
Din alt punct de vedere se disting intre o asa-numita specificitate de reactie si o specificitate de substrat a enzimelor. Prima se refera la reactantul anorganic care ia parte la reactie: apa in reactiile de hidroliza, acidul fosforic in reactiile cu fosforoliza, hidrogenul in reactiile catalizate de dehidrogenaze. Specificitatea de substrat priveste natura reactantului organic, stiut fiind ca enzimele care hidrolizeaza, de exemplu, hidratii de carbon nu hidrolizeaza proteine, cele care hidrolizeaza dipeptide nu hidrolizeaza polipeptide.
Specificitatea de substrat se manifesta in forme nenumarate si sta la baza clasificarii enzimelor, dupa cum se va vedea mai departe. Important este faptul ca, diferitele enzime prezinta fata de substaturile respective grade diferite de specificitate. Vom distinge 3 grade sau tipuri de specificitate enzimatica. Pentru ilustrarea fenomenului vom considera o reactie de hidroliza schematizata:
![]()
Sunt cazuri, desi rare, cand numai natura legaturii dintre A si B determina specificitatea, natura componentelor A si B fiind indiferenta; se vorbeste in aceste cazuri de o specificitate redusa. Un exemplu este acela al lipazelor din pancreas si ficat, care hidrolizeaza esterii celor mai variati acizi carboxilici cu alcoolii de diferite tipuri, printre care si trioli cum este glicerina. Nu toate esterazele sunt insa atat de putin specifice.
Un al doilea tip de enzime poseda o specificitate limitata, numita specificitate de grup. In cazul unei reactii de hidroliza, cum este aceea considerata mai sus, enzimele de acest tip cer ca A sa fie de un anumit tip, natura componentei B fiind indiferenta. Un exemplu de enzima inzestrata cu asemenea specificitate este acela al a-glicozidazei (maltazei) din sucul intestinal al mamiferelor si al b-glicozidazei (emulsina). Fiecare din aceste enzime hidrolizeaza atat dizaharide cat si glicozide; ele sunt deci specifice numai pentru restul de monozaharida si intr-o mare masura indiferente pentru natura agliconului.
Al treilea tip de specificitate, numita specificitate absoluta, se caracterizeaza prin aceea ca enzima este adaptata unui substrat unic, "intocmai ca o cheie in broasca ei". In schema de mai sus, ambele componente A si B trebuie sa fie de un anumit fel dat, pentru ca enzima sa actioneze. Acest tip de specificitate este mult raspandit; datorita aceste particularitati exista in natura un numar atat de mare de enzime. Vom mentiona, ca exemplu, maltaza din bobul de orz incoltit, care, spre deosebire de a-glicozidazele mentionate, hidrolizeaza numai maltoza, dar este fara actiune asupra altor dizaharide sau a-glicozide. In mod similar, tanaza hidrolizeaza numai esterii acizilor benzoici substituiti cu cel putin doua grupe OH in alte pozitii decat orto fata de carboxil, iar clorofilaza nu hidrolizeaza decat cele doua clorofile a si b; fumaraza nu aditioneaza apa decat la acidul fumaric spre a da nastere acidului (-)-malic.
Formarea unui complex intermediar intre substrat si enzima. Se stie ca actiunea unui catalizator consta in participarea sa efectiva la reactia chimica. Un catalizator se deosebeste de un reactant obisnuit numai prin aceea ca el se regenereaza necontenit in cursul procesului chimic. Enzimele nu difera, in aceasta privinta, de catalizatorii simpli. Specificitatea enzimelor sugereaza participarea enzimei la reactia chimica, adica la formarea unui complex intre enzima si substrat.
Masuratorile cinetice sprijina aceasta conceptie. In majoritatea cazurilor, in conditii comparabile, viteza reactiei enzimatice este proportionala cu concentratia enzimei. De obicei, proportionalitatea aceasta se observa numai in stadiul initial al reactiei; pe masura ce concentratia produsilor de reactie creste, viteza de reactie scade datorita unui efect inhibant al acestor produsi. De aceea se iau in consideratie pentru comparatie numai vitezele initiale ale reactiilor enzimatice.
Pornind de la o cantitate fixa de enzima si marind progresiv, intr-o serie de experiente succesive, concentratia substratului, viteza de reactie initiala creste din ce in ce mai incet cu concentratia substratului, pana ce atinge o valoare constanta maxima, dincolo de care viteza nu mai variaza cu concentratia. La concentratii mici de substrat, reactia este de ordinul I, iar la concentratii mari devine de ordinul zero fata de substrat.
Aceste observatii au dus la conceptia ca intre enzima (E) si substrat (S), se formeaza printr-o reactie reversibila ascultand de legea maselor, un complex labil. Acest complex reactioneaza apoi irversibil, cu viteza mare, cu un reactant, dand produsul de reactie (P) si regenerand catalizatorul:
![]()
Coenzime (cofactori). In afara de enzima si substrat, mai este necesara de multe ori prezenta altor substante pentru ca reactia enzimatica sa se produca. La fermentatia alcoolica, pe langa prezenta unei enzime termolabile, nedializabile, este necesara si o coenzima termostabila si dializabila. Mai tarziu, coenzimele fermentatiei alcoolice (cocarboxilaza si codehidraza I) au fost izolate si de asemenea au fost izolate coenzimele altor procese enzimatire; structura acestor coenzime a fost apoi determinata. In unele cazuri, s-a putut stabili exact functiunea indeplinita de coenzima in procesul enzimatic.
Coenzimele isi indeplinesc functiunea catalitica asupra substratului numai in prozenta unei enzime. Aceasta din urma este specific adaptata substratului; o coenzima poate cataliza uneori reactiile unui numar mare de substraturi, asociata insa de fiecare data cu o alta enzima. Coenzimele sunt, deci, mai putin specifice decat enzimele.
In timp ce enzima fixeaza si uneori activeaza substratul, coenzima participa la reactie, adica sufera o transformare chimica. In stadiul urmator al procesului, coenzima modificata revine la starea initiala, fiind gata pentru o noua reactie. Cum reactiile respective sunt foarte rapide, sunt sufiente concentratii mici de coenzima.
Pentru exemplificare vom aminti rolul jucat de codehidraza I in fermentatia alcoolica. In colaborare cu dehidrogenaza fosfatului de trioza, codehidraza I catalizeaza transformarea fosfatului glicerinaldehidei in acid D-fosfogliceric, trecand ea insasi in hidrocodehidraza; aceasta din urma reduce un anumit acceptor de hidrogen, acetaldehida, regenerand codehidraza I. Legata de alte proteine, hidrocodehidraza hidrogeneaza alti acceptori de hidrogen. Codehidrazele sunt, deci, coenzimele unor reactii de transfer de hidrogen, de la un donor la un acceptor de hidrogen.
Intalnim un mecanism similar in reactiile de transfer de acetil, in care intervine coenzima A. Aceasta reactioneaza cu un donor de acetil, in prezenta unei enzime specifice, trecand in acetil-coenzima A, cu grupa CH3CO legata de S. Acetil coenzima A difuzeaza apoi prin solutie pana intalneste o alta enzima cu ajutorul careia cedeaza grupa acetil unui acceptor. Eliberata de grupa acetil, coenzima A reia acest joc. Acidul adenosin-trifosforic functioneaza in mod similar ca o coenzima transmitatoare de fosfat.
Sistemele enzimatice care contin un metal in grupa prostetica sau sub alta forma, indispensabil activitatile lor sunt numite metaloenzime. Flavoproteinele contin in afara de proteina si FAD (flavin-adenin-dinucleotida), si un metal, ca fier (succino-dehidrogenaza), molibden (xantin-oxidaza) sau altele. Uneori ionii metalici joaca rolul de activatori, de exemplu Mg2+ pentru multe enzime de fosforilare. Mecanismul actiunii specifice a acestor metale nu este cunoscut.
Coenzimele respiratiei. Este cunoscut rolul important al reactiilor de oxidare cu oxigen molecular, pentru producerea energiei necesare functiilor vitale ale organismelor. Nu exista nici o enzima capabila sa transfere direct unei molecule de oxigen hidrogenul eliminat de substraturile curente din organismele vii. Pentru a se combina cu oxigenul, este necesara interventia unui sistem complex de enzime si coenzime. Enzimlele fac parte din clasa oxido-reductazelor (dehidrogenaze si oxidaze). Hidrogenul cedat de substrat este intai acceptat ce DPN (codehidraza I), asociate dupa caz cu o enzima specific adaptata substratului. Soarta coenzimelor hidrogenate care se formeaza depinde de conditiile anaerobe sau aerobe in care are loc reactia. In conditii anaerobe, hidrocodehidraza cedeaza hidrogenul unui acceptor din mediul de reactie.
Proprietatea aceasta a dehidrogenazelor de a transfera hidrogen din substrat la diferiti acceptori a fost descoperita de Thunberg in 1917. Tehnica folosita de acest cercetator pentru a decela transferul anaerob de hidrogen s-au mai corect pentru a pune in evidenta prezenta unui sistem enzimatic capabil de a transfera hidrogen, consta in folosirea colorantului albastru-metilen ca acceptor. Aceasta se decoloreaza trecand in leucoderivatul sau.
Nici in conditii aerobe, hidrogenul din hidrocodehidraza nu este cedat direct unei molecule de oxigen, ci el este intai transferat altor sisteme enzimatice care abia ele pot reactiona cu oxigenul. Sunt mai multe cai posibile prin care hidrogenul substratului poate ajunge la oxigen. Un astfel de lant de reactii este redat in urmatoarea schema.
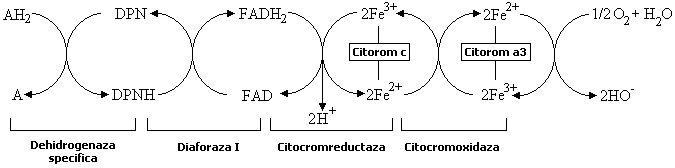 Hidrogenul
cedat de substratul AH2, de exemplu codehidrazei I, este transferat
flavin-adenin-dinucleotidei. De aici inainte, atomii de hidrogen se desfac in
protoni si electroni: primii trec in solutie (sub forma de ioni
de hidroniu), iar electronii reduc fierul din citocrom, de la starea
trivalenta la starea bivalenta. Citocromul c redus reduce citocromoxidaza (citocrom a3) care este singura capabila de a ceda
electroni oxigenului. Citocromii sunt deci transferaze de electroni (oxidaze
aerobe). In schema de mai sus sunt identificate (pe randul de jos) enzimele ce
actioneaza in acest proces complicat.
Hidrogenul
cedat de substratul AH2, de exemplu codehidrazei I, este transferat
flavin-adenin-dinucleotidei. De aici inainte, atomii de hidrogen se desfac in
protoni si electroni: primii trec in solutie (sub forma de ioni
de hidroniu), iar electronii reduc fierul din citocrom, de la starea
trivalenta la starea bivalenta. Citocromul c redus reduce citocromoxidaza (citocrom a3) care este singura capabila de a ceda
electroni oxigenului. Citocromii sunt deci transferaze de electroni (oxidaze
aerobe). In schema de mai sus sunt identificate (pe randul de jos) enzimele ce
actioneaza in acest proces complicat.
Transferul hidrogenului in etape, de la substrat la molecula de oxigen, face posibila utilizarea, pentru nevoile organismului, a energiei degajate. Se stie ca aceasta energie se inmagazineaza in legaturile bogate in energie ale resturilor de fosfat in ATP sintetizat simultan cu reactiile de oxidare. S-a aratat, in mai multe cazuri, de exemplu la oxidarea acidului b-hidroxibutiril in prezenta unui sitem enzimatic respirator complet, ca la consumarea unui atom de oxigen apar 3 molecule de ATP. In unele cazuri se stie in ce mod o reactie de dehidrogenare este cuplata cu o sinteza de ATP.
Centre active ale enzimelor. Se stie ca nu toate enzimele necesita colaborarea unei coenzime. Coenzimele intervin mai ales in reactiile de transfer: de hidrogen, de electroni, de grupe de fosfat, de acetil, etc. Numeroase enzime, printre care si hidrolazele isi exercita actiunea lor enzimatica fara interventia unei coenzime. Enzima este activa numai in forma ei nativa, caci prin denaturare activitatea specifica a enzimelor dispare. Activitatea enzimatica este insa restabilita atunci cand enzima poate fi regenerata, adica atunci cand poate fi reconstituita structura tertiara sau cuaternara a proteinei distrusa prin denaturare.
Se stie insa ca nu toata catena polipeptidica a enzimei participa la actul propriu-zis al catalizei, ci numai o mica portiune a ei, numai anumite grupe, dintr-o regiune bine delimitata a catenei polipeptidice, asa numitul centru activ al enzimei. La aceasta constatare s-a ajuns prin experiente de inhibare a activitatii enzimei blocand centrul activ cu anumiti reactivi cu care acesta se combina. Inhibitorii de acest fel actioneaza in proportie stoechiometrica fata de enzima, ceea ce este un indiciu ca ei reactioneaza cu anumite grupe ale catenei polipeptidice.
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 2985
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2025 . All rights reserved