| CATEGORII DOCUMENTE |
| Astronomie | Biofizica | Biologie | Botanica | Carti | Chimie | Copii |
| Educatie civica | Fabule ghicitori | Fizica | Gramatica | Joc | Literatura romana | Logica |
| Matematica | Poezii | Psihologie psihiatrie | Sociologie |
- covalenta în grupele principale este egala cu 8 minus numarul grupei – aceasta reprezinta chiar numarul de electroni necesari pentru completarea octetului,
- prin legaturi covalente se formeaza molecule.
Exemple:
H2 H•
+ H• ![]() H H
H H
F – F (v. Fig. 3.2)
![]()
![]() F2
F2
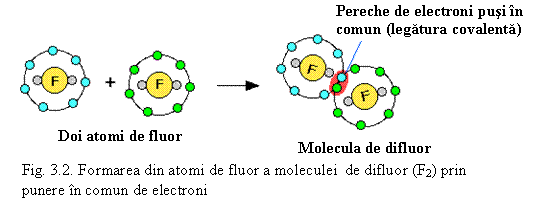
Analog se poate scrie formarea legaturilor covalente simple si pentru alte elemente din perioada a 2-a:
H – F; H–O–H; :NH3; CH4
Perechile de electroni neangajate în legǎturi se numesc electroni neparticipanti.
Se mai pot forma si legaturi multiple între atomi de acelasi fel. De exemplu mentionam:
:Ö=Ö: :N≡N: =C=C= -C≡C-
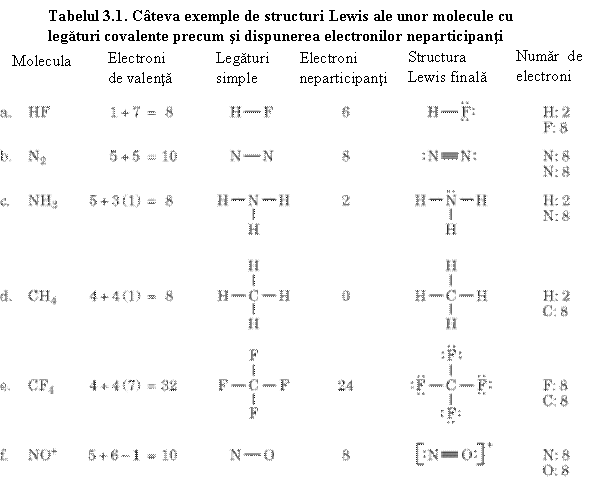
Dar pot lua nastere legaturi multiple si între atomi diferiti, ca de exemplu: O=C=O, O=S=O, H–C≡N. Câteva exemple de molecule covalente sunt prezentate în tabelul 3.1
Caracteristicile legaturii covalente sunt:
- este orientata în spatiu
- este rigida (atomii ocupa pozitii fixe),
- este saturata,
- este foarte puternica,
- prin covalente se formeaza molecule independente (în stare gazoasa) sau retele atomice (în stare solida),
- la moleculele formate din atomi diferiti, apare fenomenul de polarizare
Caracteristicile substantelor cu legaturi covalente difera în functie de moleculele substantelor dar si în functie de retelele rezultate.

Substantele cu molecule mici (O2, N2, CO2, NH3, etc; substante organice)
- sunt gaze sau lichide la temperatura ordinara,
- au temperaturi de topire (tt) si de fierbere (tf) joase,
- între molecule exista forte de atractie slabe – van der Waals,
-sunt solubile în solventi organici,
- solutiile sunt neelectroliti.
Legatura covalenta polara.
Din punct de vedere al naturii atomilor constituenti, moleculele pot fi:
Molecule homonucleare – formate din atomi identici – au norul electronic simetric.
Molecule heteronucleare – formate din atomi diferiti – norul electronic este asimetric iar perechea de electroni de legatura este atrasa mai mult de atomul mai electronegativ (densitatea de sarcina negativa este mai mare în jurul atomului mai electronegativ).
Centrul sarcinilor pozitive si negative nu mai coincid iar rezultatul este acela ca apare o polaritate a moleculei. Aceasta poarta numele legatura covalenta polara. Notatia generala este:
Aδ+ - B δ-
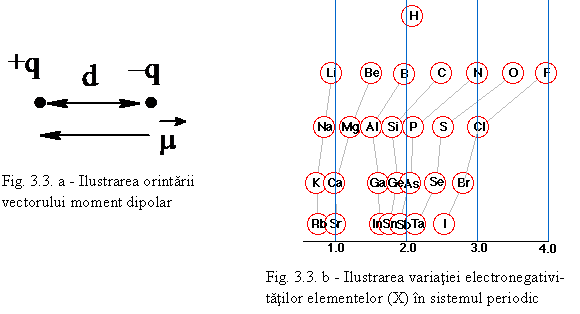
Molecula are un moment electric de dipol: μ= q.d (fig. 3.3 – a) q fiind sarcina electrica iar d – distanta între sarcini μ având unitatea debye - D (1 D = 3,336.10-30 C.m). De exemplu, pentru acid fluorhidric notatia obisnuita este: H δ+ - Fδ- unde δ este sarcina partiala (fractiune din sarcina electronului e). Din sarcina partiala se poate calcula procentul de ionicitate (δ/e).100. Gradul de ionicitate se poate determina experimental. Acesta depinde de diferenta de electronegativitate dintre cele doua elemente (vezi fig 3.3. b).
Daca notam cu XA -electronegativitatea elementului A formata din semisuma energiei de ionizare EA si afinitatii pentru electroni AA:
XA = (EA+ AA)/2
Se stie ca daca diferenta XA – XB > 1,8 atunci ionicitatea i > 55% si legatura ionica predomina. Cu XA , XB s-au notat electronegativitatile atomilor A si B.
În moleculele poliatomice, momentul electric dipolar este suma vectoriala a momentelor tuturor legaturilor polare. Daca legaturile polare sunt simetrice, momentele se anuleaza si μ = 0.Exemple:
O δ-/2=C δ+=O δ-/2 μ = 0 - în consecinta molecula este nepolara.
 S
δ-/2=C δ+=S δ-/2 μ
= 0 - analog ca mai sus, este o
molecula nepolara.
S
δ-/2=C δ+=S δ-/2 μ
= 0 - analog ca mai sus, este o
molecula nepolara.
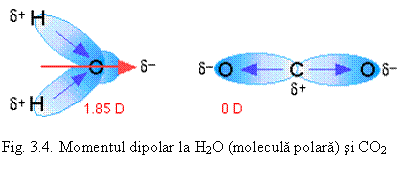
Daca molecula are un moment de dipol diferit de zero, înseamna ca structura acesteia este asimetrica. Exemple: H2O, SO2, NH3 (vezi fig. 3.4 ).
Cu cât sunt mai diferite electronegativitatile elementelor (vezi fig. 3.3 – b), cu atât polaritatea moleculei creste. Substantele cu molecule polare se dizolva în apa – are loc disocierea în ioni cu formare de electrolit. Datorita polaritatii moleculei de apa, are loc fenomenul de hidratare a ionilor în solutie.
La limita, legatura polara devine legatura ionica. Legatura polara este intermediara între legatura covalenta si cea ionica. Atomul electronegativ are un exces de electroni (si o sarcina electrica q). În functie de aceasta sarcina distingem cazurile:
q = 0 - legatura covalenta pura,
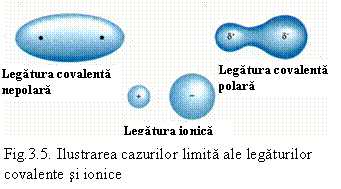 q > 0 si q < e - legatura covalenta polara,
q > 0 si q < e - legatura covalenta polara,
q = n.e – legatura pur ionica (e fiind sarcina electronului) - vezi si fig. 3.5.
De fapt numai în stare gazoasa ionii au sarcini întregi. În cristalele ionice solide sarcinile ionilor sunt subunitare sau ceva mai mici de un numar întreg.
Legatura coordinativa (donor – acceptor)
Este o legatura covalenta în care perechea de electroni de legatura provine de la un singur atom – donor. Atomul care accepta perechea de electroni – acceptor. Reactia poate fi scrisa:
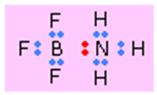
:NH3 + BF3 = H3N → BF3
Sageata indica aici o legatura donor-acceptor, amoniacul fiind donorul iar atomul de bor (B) care are în BF3 doar 6 electroni de legatura în jurul sau este acceptorul. Situatia electronilor este ilustrata mai jos unde perechea de electroni cedata de amoniac este colorata în rosu:
Combinatiile formate prin legaturi coordinative – denumite combinatii complexe – sunt formate dintr-un ion central (metal) si liganzi. Liganzii pot fi molecule neutre sau anioni. Numarul de liganzi care înconjoara ionul central poarta numele de numar de coordinatie. Exemple de formare a denumirilor:
[Cu(NH3)4]2+ + 2Cl- - clorura tetraaminocupru(II)
[Co(NH3)6]2+ + 2Cl- - clorura hexaaminocobalt(II)
Na+ + [Ag(CN)2]- - dicianoargentat de sodiu
4K+ + [Fe(CN)6]4- - ferocianura de potasiu sau hexacianoferat de potasiu.
Teoria mecanic-cuantica a covalentei
Covalenta ia nastere prin contopirea orbitalelor atomice care duc la formare de orbitale moleculare care apartin întregii molecule.
Mecanica cuantica – calculeaza (cu aproximatie) ecuatiile si geometriile orbitalelor moleculare.
Etapele formarii legaturii covalente conform mecanicii cuantice:
- redistribuirea orbitalelor atomice,
- suprapunerea (întrepatrunderea) orbitalelor atomice (OA)cu formarea de orbitale moleculare (OM),
- ocuparea OM cu perechi de electroni.
Se pot combina orbitale atomice de simetrie (orientare) potrivita si de energie apropiata. Procesul are loc cu eliberare de energie – proces spontan starea rezultata (molecula) este mai stabila decât atomii izolati.
Exista doua metode matematice de tratare a legurii chimice:
- metoda orbitalelor moleculare (OM)
- metoda legaturii de valenta (LV) – sau metoda perechilor de electroni de legatura. Acestea difera mai mult prin modul matematic de tratare concluziile fiind similare.
Metoda LV e mai simpla si poate exprima formare multor molecule. Dar nu toate legaturile chimice se pot reduce la perechi de electroni – sunt cazuri în care participa mai multi electroni (ex. în benzen - legaturi delocalizate). Metoda OM poate însa rezolva numai molecule mai simple, pentru cele mai complicate calculele sunt insurmontabile.
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 253
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2026 . All rights reserved