| CATEGORII DOCUMENTE |
| Astronomie | Biofizica | Biologie | Botanica | Carti | Chimie | Copii |
| Educatie civica | Fabule ghicitori | Fizica | Gramatica | Joc | Literatura romana | Logica |
| Matematica | Poezii | Psihologie psihiatrie | Sociologie |
Solutii tampon. Solutiile de acizi si baze īsi modifica foarte mult pH-ul la diluare sau la adaugare de acid sau baza. Exista īnsa solutii care īsi mentin practic pH-ul la diluare sau la adaugare de acid sau baza, datorita proprietatii de a opune un fel de rezistenta elastica oricarei īncercari de a le mari sau micsora concentratia īn ioni de hidrogen. Aceste solutii poarta numele de solutii tampon.
Solutiile tampon sunt formate din amestecuri de acid slab si o sare a sa cu o baza tare, precum si dintr-o baza slaba si o sare a sa cu un acid tare, de exemplu: Acid acetic + acetat de sodiu; Acid carbonic + carbonat de sodiu; Acid fosforic + fosfat de sodiu; Hidroxid de amoniu + clorura de amoniu etc.
La īncercarea de marire a aciditatii unei solutii tampon prin adaos de acid, anionul sarii din amestecul tampon formeaza cu ionul H+ adaugat un acid slab ionizat opunāndu-se cresterii aciditatii, iar la adaugare de baza, ionul de hidrogen al acidului din amestecul tampon formeaza apa cu ionul OH- opunāndu-se astfel cresterii bazicitatii. Pentru exemplificare, se ia un amestec tampon format din acid acetic + acetat de sodiu. Īn solutie acidul acetic ionizeaza foarte putin fiind un acid slab. Solutia va contine īn totalitatea ei deci un numar mare de molecule de acid acetic, dar si un numar mare de ioni acetat proveniti prin disocierea acetatului de sodiu care, disociaza total fiind un electrolit tare.
La adaos de HCl se produce reactia:
CH3COOH + (CH3COO- + Na+) + (H+ + Cl-) 2CH3COOH + (Na+ + Cl-)
cānd se consuma ionii H+ adaugati de catre CH3COO- din sare, cu formare de molecule de acid.
La adaos de NaOH se produce reactia:
CH3COOH + (CH3COO- + Na+) + (Na+ + OH-) = 2(CH3COO- + Na+) + H2O
cānd se consuma ionii OH- adaugati de catre ionii H+ ai acidului acetic. Acetatul rezultat va hidroliza dupa ecuatia:
(CH3COO- + Na+) + H2O
![]()
CH3COOH + (Na+ + OH-)
dar gradul de hidroliza fiind slab, va rezulta o cantitate de ioni OH- cu mult mai mica decāt cea adaugata sub forma de NaOH.
Se considera amestecul tampon HX + MX, īn care acidul slab va ioniza dupa ecuatia:
![]() HX + H2O H3O+
+ X-
HX + H2O H3O+
+ X-
Cum [H3O+]
= [X-], constanta de aciditate capata forma: ![]() Facānd
abstractie de faptul ca protonul este hidratat, īn loc de H3O+
se va folosi īn continuare H+, deci:
Facānd
abstractie de faptul ca protonul este hidratat, īn loc de H3O+
se va folosi īn continuare H+, deci:![]() īn care
[HX], concentratia acidului ramas neionizat, se aproximeaza ca
fiind egala cu concentratia initiala a acidului Ca.
Conform relatiei, pH-ul dat numai de acid va fi:
īn care
[HX], concentratia acidului ramas neionizat, se aproximeaza ca
fiind egala cu concentratia initiala a acidului Ca.
Conform relatiei, pH-ul dat numai de acid va fi: ![]() Īn
solutia tampon existānd si sarea MX, pH-ul este influentat de
prezenta acesteia, iar valoarea sa se calculeaza, unde:
Īn
solutia tampon existānd si sarea MX, pH-ul este influentat de
prezenta acesteia, iar valoarea sa se calculeaza, unde:
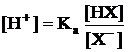
La echilibru,
concentratia ionilor X- poate fi considerata egala cu
concentratia sarii Cs, deci [X-] = Cs,
īncāt, īnlocuind pe [HX] cu Ca, relatia devine: 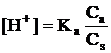 deci:pH = -lgKa - lgCa
+ lgCs Relati
arata ca īn solutiile tampon, concentratia ionilor H+
depinde de constanta de aciditate a acidului slab si de raportul
concentratiilor componentilor (acid si sare) si nu depinde
de dilutie. De aceea, o solutie tampon acid acetic-acetat de sodiu
diluata de 10 ori, īsi modifica pH-ul numai cu 0,02
unitati de pH, iar diluata de 100 ori, cu 0,1 unitati
de pH.
deci:pH = -lgKa - lgCa
+ lgCs Relati
arata ca īn solutiile tampon, concentratia ionilor H+
depinde de constanta de aciditate a acidului slab si de raportul
concentratiilor componentilor (acid si sare) si nu depinde
de dilutie. De aceea, o solutie tampon acid acetic-acetat de sodiu
diluata de 10 ori, īsi modifica pH-ul numai cu 0,02
unitati de pH, iar diluata de 100 ori, cu 0,1 unitati
de pH.
Nu orice amestec tampon are aceeasi putere de tamponare,īntelegānd prin aceasta, puterea de a mentine pH-ul constant. Puterea de tamponare acido-bazica P se poate exprima prin indicele de tamponare, care consta īn raportul dintre adaosul de acid tare sau de baza tare dL, exprimat īn echivalenti la litru si variatia pH-ului:
P = dL / dpH
Odata depasita aceasta capacitate de tamponare a amestecului tampon, pH-ul solutiei va fi dat de excesul de acid tare sau de baza tare adaugat. Deci, actiunea de tamponare este limitata de capacitatea de tamponare.
La un amestec tampon ce contine un acid slab si sarea sa cu o baza tare, pH-ul nu depinde practic de temperatura, īn timp ce la solutiile tampon formate din baze slabe si sarurile lor cu un acid tare, pH-ul depinde sensibil de temperatura. Alegerea amestecului tampon se face īn functie de valoarea pH-ului ce trebuie mentinut constant precum si de sistemul ce trebuie tamponat deoarece, componentii solutiei tampon pot interveni īn reactii perturbānd procesele studiate. Exista tabele cu diferite sisteme tampon.
Solutiile tampon īndeplinesc un rol deosebit īn fenomenele biochimice care se produc īn organismul animal si vegetal, sub actiunea catalitica a unor enzime. Īn cazul cānd se produce o modificare a pH-ului, mediul lupta de la sine printr-un sistem de tamponare de care dispune, pentru mentinerea echilibrului. Īn sānge, pH-ul este mentinut constant prin actiunea a doua sisteme tampon: fosfat monosodic-fosfat disodic si acid carbonic-bicarbonat de sodiu. Sistemele tampon au o mare importanta īn agricultura. Solul arabil manifesta o actiune de tamponare pronuntata cu ajutorul fosfatilor, carbonatilor si al complexului adsorbtiv din sol. Solurile bine tamponate sunt cele mai favorabile unei bune dezvoltari a culturilor, ele fiind cele mai putin predispuse la modificarea pH-ului sub influenta diferitilor factori fizici si īn special chimici, cum sunt īngrasamintele chimice.
Īn analiza chimica, mentinerea constanta a pH-ului cu ajutorul solutiilor tampon este deosebit de utilizata, deoarece valoarea pH-ului poate determina sensul unei reactii.
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 284
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2025 . All rights reserved