| CATEGORII DOCUMENTE |
| Astronomie | Biofizica | Biologie | Botanica | Carti | Chimie | Copii |
| Educatie civica | Fabule ghicitori | Fizica | Gramatica | Joc | Literatura romana | Logica |
| Matematica | Poezii | Psihologie psihiatrie | Sociologie |
Structura atomului explicata prin mecanica ondulatorie ( mecanica cuantica
Fizicianul francez L.de Broglie a considerat ca fiecarei particule i se poate asocia o unda. O particula īn miscare trebuie sa posede deci o lungime de unda
λ=h/mv , unde : h= constanta lui Plank=6,626.10-34js
m=masa particulei;
v=viteza particulei.
Daca masa este mare, λ devine foarte mic (īsi pierde semnificatia fizica )
Daca masa este mica , λ devine masurabil. Deci mecanica ondulatorie are importanta pentru particule mici ( deci si pentru electron ).
Pozitia geometrica a electronului īn miscare nu poate fi determinata cu precizie , se stabileste numai probabilitatea de a gasi electronul īntr-un punct. Conform principiului nedeterminarii al lui Heisenberg , nu se poate determina simultan pozitia si viteza electronului; rezulta deci ca electronul poate fi considerat ca fiind extins īntr-un nor de electricitate negativa ,numit nor electronic , a carui densitate variaza din loc īn loc.
Un orbital este o regiune din spatiu din jurul nucleului , īn care este cuprins un nor electronic datorat prezentei a cel mult 2 electroni.
Orbitalii s au simetrie sferica cu nucleul atomului situat īn centrul sferei . Densitatea electronica maxima este delimitata de o sfera cu raza 0,53 Å
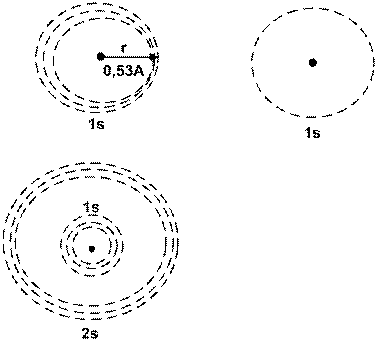
Reprezentarea schematica a orbitalului s (cercul) indica granita aproximativa a densitatii de 90% a sarcinii . Regiunea de densitate electronica maxima 2s este delimitata de regiunea de densitate maxima 1s printr-o suprafata nodala . Fiecare strat contine cāte un orbital de tip s.
Orbitalii p au simetrie bilobala , apar īncep nd cu n=2 si au numarul cuantic secundar l=1 . Fiecare substrat de tip p contine 3 orbitali p care sunt distribuiti de-a lungul a 3 axe perpendiculare, cu nucleul īn origiunea axelor de coordonate.

Dispunerea spatiala a orbitalilor se realizeaza īn asa fel īncāt īntre orbitali distantele sunt maxime si egale.
Orbitalii d
, īn numar de 5 , au doua planuri nodale si īn consecinta
4 lobi. Orbitalii ![]() ,
, ![]() ,
, ![]() ,sunt asemanatori , sunt situati īn
cele 3 planuri perpendiculare ale axelor de coordonate , dar īnclinati cu
,sunt asemanatori , sunt situati īn
cele 3 planuri perpendiculare ale axelor de coordonate , dar īnclinati cu ![]() fata
de orbitalii p. Orbitalul
fata
de orbitalii p. Orbitalul ![]() este simetric
īn raport cu axa z.
este simetric
īn raport cu axa z.
Orbitalul![]() asemanator cu orbitalul
asemanator cu orbitalul ![]() , dar este rotit cu 45
, dar este rotit cu 45![]() fata
de axa z, lobii sai fiind orientati de-a lungul axelor x si y.
fata
de axa z, lobii sai fiind orientati de-a lungul axelor x si y.

Orbitalii d apar incepānd cu stratul 3.
Orbitalii f, in numar de 7, cu forme mai complicate apar numai īn straturile cu n=4,5.
Repartizarea electronilor īn orbitalii īnvelisului de electroni al unui atom respecta urmatoarele reguli:
Electronii ocupa, in stare fundamentala, nivelele cu cea mai joasa energie(energie minima īnseamna stabilitate maxima)
Principiul
excluziunii a lui Pauli conform caruia un orbital are maximum 2![]() cu spinul
opus (spin- miscarea de rotatie a
cu spinul
opus (spin- miscarea de rotatie a ![]() īn jurul
axei sale).
īn jurul
axei sale).
Rezulta ca exista 2![]() electroni
pentru toti orbitalii cu acelasi n;
electroni
pentru toti orbitalii cu acelasi n;
Regula lui Hund, conform careia distributia electronilor se realizeza astfel īncāt numarul electronilor cu spinul paralel,īn orbitali cu aceeasi energie, sa fie maxim.
Orbitalii sunt deci conceputi, īn teoria mecanic cuantica, ca niste portiuni din spatiu, din vecinatatea nucleului, diferentiati prin energia si geometria(sau simetria lor) si care pot fi/sau nu ocupati cu electroni.
Rezulta deci ca īnvelisul de electroni are cel putin 4 tipuri de substraturi care contin orbitali de aceeasi energie.Respectiv substratul de tip s cu 1 orbital, substratul de tip p cu 3 orbitali, substratul d cu 5 orbitali, substratul f cu 7 orbitali.
Nivelul de energie al substraturilor din īnvelisul
de ![]() creste dinspre nucleu spre straturile
periferice astfel :
creste dinspre nucleu spre straturile
periferice astfel :
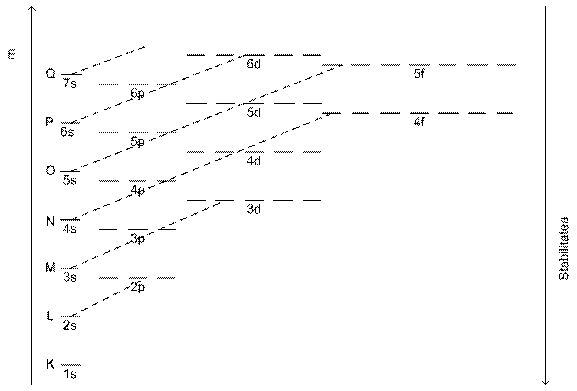
Deci īnvelisul de electroni are 7 straturi (
K,L,M,N,O,P,Q ), numarul maxim de electroni este dat de relatia 2![]()
Prin gruparea unor substraturi cu energii apropiate rezulta 7 nivele de energie cu urmatoarea componenta:1s/ 2s 2p/ 3s 3p/ 4s 3d 4p/5s 4d 5p/6s 4f 5d 6p/7s 5f 6d
Completarea
cu ![]() se
realizeaza īncepānd cu stratul 1( cu energia cea mai scazuta).
se
realizeaza īncepānd cu stratul 1( cu energia cea mai scazuta).
Īn functie de substratul, respectiv orbitalul, īn care se afla electronul distinctiv, se cunosc 4 blocuri de elemente:
1) Elemente de tip s apartinānd grupelor principale I si I;.
2) Elemente de tip p apartinānd grupelor principale III VIII;
3) Elemente de tip d apartinānd grupelor secundare (elemente tranzitionale ) si
4) Elemente de tip f: lantanidele si actinidele
Marea majoritate a elementelor sunt metale (80% din totalul elementelor) ele sunt situate īn stānga sitemului periodic (grupa I si II, partial III, IV, V, VI toate elementele grupelor secundare,toate lantanidele si actinidele).
Metalele au ca tendinta
generala de a ceda ![]() deci se vor gasi īn majoritatea combinatiilor
chimice sub forma de ioni pozitivi.
deci se vor gasi īn majoritatea combinatiilor
chimice sub forma de ioni pozitivi.
Nemetalele sunt situate īn
partea dreapta a sistemului periodic, ele au ca tendinta
acceptarea de electroni ![]() sau punerea īn
comun de
sau punerea īn
comun de ![]() , deci se vor gasi īn combinatii sub
forma de ioni negativi sau legati prin legaturi covalente.
, deci se vor gasi īn combinatii sub
forma de ioni negativi sau legati prin legaturi covalente.
Īntre structura īnvelisului de electroni al unui element si pozitia lui īn sitemul periodic este o strānsa corelatie:
Numarul stratului īn curs de completare (numarul cuantic principal) este egal cu numarul perioadei;
Numarul ![]() de pe ultimul
strat (suma
de pe ultimul
strat (suma ![]() din subtraturile
s si p) indica numarul grupei principale;
din subtraturile
s si p) indica numarul grupei principale;
Elementele cu ![]() distinctiv
īntr-un substrat d se gasesc īn grupele secundare.
distinctiv
īntr-un substrat d se gasesc īn grupele secundare.
Ex:
Mg (z=12) 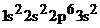 se
gaseste īn perioada a 3-a grupa a II-a A
se
gaseste īn perioada a 3-a grupa a II-a A
Br (z=35) ![]() perioada
a 4-a, grupa a VII-a A;
perioada
a 4-a, grupa a VII-a A;
Fe (z=26) ![]() perioada
a 6-a, grupa a VII-a B (secundara)
perioada
a 6-a, grupa a VII-a B (secundara)
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 280
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2025 . All rights reserved