| CATEGORII DOCUMENTE |
| Alimentatie nutritie | Asistenta sociala | Cosmetica frumusete | Logopedie | Retete culinare | Sport |
Tratament
1. Tumorile superficiale ale vezicii urinare (stadiile Ta, T1)
Protocolul Asociatiei Romane de Urologie
(Revista Romana de Urologie, vol V, nr 3-4, 1999, pag. 211)
1. Rezectia transuretrala cu biopsii de pat si margini tumorale
2. Tratament instilational cu BCG sau citoststice
3. Electrorezectia transvezicala
4. Laser-vaporizarea
5. Alte operatii (cistectomia partiala, radicala).
Tratamentul leziunilor Ta-T1 (dupa Ghidul European Association of Urology) [169]
Parametrii cu valoare prognostica pentru recidiva , in ordine descrescatoare sunt:
1. Numarul tumorilor prezente in momentul diagnosticului
2. Rata recidivelor; o recidiva la 3 luni
3. Dimensiunile tumorii: o tumora voluminoasa are sanse de recidiva mai mare
4. Gradul de anaplazie.
Pentru evolutia spre infiltratie, elementele G si T sunt cele mai importante. Tumorile de la nivelul colului vezical au prognosticul rezervat, recidivand la 5 ani 21%.
Tumorile vezicale superficiale (TVS) se divid pe baza factorilor de prognostic in:
tumori cu risc scazut: unice,Ta, G1, sub 3cm
tumori cu risc mare: T1G3, multifocale sau cu recidive multiple, Cis
intermediare: toate celelalte tumori , Ta-1, G1-2, multifocale, peste 3 cm.
O instilatie cu citostatic (epirubicin sau mitomycine) sub 6 ore dupa TUR pentru TVS scade rata recidivelor cu 50% (Osterlinck)
1.1. Rezectia transuretrala sau/si fulguratia
Metoda de electie in tratamentul tumorilor vezicale superficiale este rezectia endoscopica transuretrala (TUR-V). Aceasta se efectueaza dupa pregatirea preoperatorie prealabila a pacientului, in continuarea cistoscopiei exploratorii si sub aceeasi anestezie.
Rezectia endoscopica reprezinta tratamentul primar al tumorilor vezicale superficiale, cu viza de radicalitate, care permite pe langa indepartarea intregii tumori vizibila miscroscopic, obtinerea de specimen pentru examenul histopatologic de diagnostic si stadiere; controlul rezectiei prin prelevarea de biopsii din suprafata de rezectie, cat si prelevarea de biopsii randomizate pentru a controla starea uroteliului macroscopic normal.
Prin specimenele tumorale recoltate, rezectia endoscopica permite obtinerea diagnosticului de certitudine de tumora maligna, evaluarea profunzimii invaziei parietale - T, deci si a radicalitatii rezectiei si stabilirea grading-ului histologic de malignitate - G.
Se recomanda biopsii randomizate mai ales in caz de tumori multiple si mai mari de 3 cm [103].
Prelevarea de biopsii de camp urotelial vezical aparent normal, este in prezent o atitudine disputata intre partizanii ideii ca, in acest fel este posibila descoperirea concomitentei Tis, mult mai agresiva decat tumora primara exofitica si cei care invoca riscul implantarii iatrogene de celule tumorale, exfoliate in timpul cistoscopiei si rezectiei, in zonele de mucoasa denudata de aceste biopsii.
Alte avantaje ale rezectiei endoscopice in tratamentul tumorilor vezicale superficiale sunt:
comoditatea atat pentru pacient cat si pentru operator, mai ales cand se efectueaza cu control pe monitor.
este bine tolerata.
exclude plaga parietala cu toate complicatiile care deriva de aici (mai rau tolerata, cu dureri la mobilizare, supuratii, dehiscente, fistule, insamantare tumorala pe transa de sutura, restante tumorale neobservate, etc).
permite mobilizarea precoce a pacientului.
A. Tehnica rezectiei standard
Distingem 3 modalitati de efectuare (Mauermayer, Dragan P) [163]:
Rezectia orizontala sau rezectia paralela. Este practicata in cazul tumorilor de marime mijlocie, solitare, situate la distanta de orificiile ureterale. Indepartarea tesutului tumoral se efectueaza in straturi succesive, suprapuse, paralele cu baza tumorii. Se ajunge, treptat la baza tumorii ce se va putea rezeca corect, cu hemostaza adecvata.


a. b.
Figura 75. a,b) Rezectie transuretrala a unei tumori vezicale superficiale.
Se evidentiaza muschiul vezicii urinare.
Rezectia verticala: consta in indepartarea tumorii de sus in jos, pe un ax perpendicular pe baza tumorii. Frecvent aceste 2 metode se folosesc asociat.
Rezectia primara a pediculului: utilizata in cazul tumorilor mici, papilare, pediculate, atunci cand abordarea pediculului se poate face din lateral. Partea exofitica urmeaza sa fie extrasa ca atare sau morselata cu ansa rezectoscopului.
Trebuie sa se faca distinctia dintre tesutul tumoral si cel sanatos. Stratul muscular are o coloratie roza si aspect reticulat al fasciculelor sale; tesutul grasos este galben stralucitor. Tesutul perivezical o arie gri sau albastruie. Tesutul tumoral este amorf, gelatinos.
II. Rezectia transuretrala de tip diferential (TURV-D)-Biopsia Bressel:
Rezectia endoscopica de tip diferential (dupa Prof. Dragan P) permite reconstructia fidela a tumorii vezicale, poate depista daca tumora a fost indeparatata in totalitate sau daca persista tesut tumoral in una dintre cele 6 fragmente rezecate. Tehnic, se efectueaza in felul urmator:
se rezeca partea exofitica a tumorii (constituind esantionul 1)
se rezeca din marginile patului tumoral, orele 12,3,6,9 (esantioanele 2,3,4,5) pentru a evidentia tesutul tumoral restant
se efectueaza o biopsie din centrul patului tumoral (esantionul 6).
Cele 6 esantioane se examineaza de catre anatomo-patolog. Daca unul dintre esantioane este pozitiv se repeta rezectia, in aceiasi maniera, din zona respectiva.
Limitele rezectiei endoscopice transuretrale sunt date de:
imposibilitatea pasajului prin uretra (stricturi, cai false, tumori prostatice voluminoase, etc).
localizarea tumorii intr-o zona greu accesibila (perete vezical anterior in imediata vecinatate a colului vezical).
tumora situata in diverticul vezical (risc mare de perforatie vezicala).
asocierea tumorii cu alte leziuni (litiaza vezicala multipla sau voluminoasa).
purtatorii de stimulator cardiac (risc de dereglare a acestuia).
Complicatiile rezectiei endoscopice transuretrale pot fi:
sindromul post-TUR - se datoreaza rezorbtiei unei cantitati mari de lichid de spalare in circulatia sanguina, conducand la cresterea valorilor tensiunii arteriale, tahicardie, dispnee si falsa anemie (prin dilutia mare). Se intalneste foarte rar pentru ca, de obicei, suprafata de rezectie la nivelul peretelui vezical nu este mare.
infectia urinara - poate aparea ca urmare a nerespectarii regulilor de asepsie si antisepsie in timpul operatiei.
hemoragia masiva - este, de obicei, controlabila tot endoscopic, prin electrocoagulare locala. In caz de hemoragie masiva incontrolabila endoscopic, aceasta se rezolva chirurgical deschis imediat, sub aceeasi anestezie.
perforatia vezicala - poate fi subperitoneala sau intraperitoneala. Perforatia vezicala subperitoneala, care lasa peritoneul indemn, se poate rezolva favorabil printr-o sonda uretro-vezicala, atunci cand perforatia este mica si este recunoscuta imediat. Daca perforatia este mare, nu este recunoscuta imediat in timp util sau in caz de perforatie intraperitoneala, rezolvarea trebuie sa fie imediata prin chirurgie deschisa (in primul caz - incizie, aspiratie, sutura si drenaj, iar in al doilea - laparotomie abdominala cu aspiratie, lavaj abundent, sutura si drenaj multiplu).
rezectia incompleta a tumorii - este poate cea mai grava complicatie a rezectiei endoscopice. Facuta cu buna stiinta sau nerecunoscuta si fara control al rezectiei sau abandonata fara nici un gest ulterior de completare, acest fapt atrage o foarte mare responsabilitate din partea medicului terapeut si agravarea stadiului initial al bolii care ar fi putut beneficia de tratament curativ.
O metoda mai noua in tratamentul endoscopic al tumorilor vezicale superficiale se bazeaza pe utilizarea LASER-ilor medicali si anume vapozarea tumorilor cu LASER (Light Amplification by Stimulated Emission of Radiation).
Avantajele acestei metode constau in posibilitatea efectuarii sub analgo-sedare in doze mici, utilizarea unui instrumentar mai fin ce traumatizeaza mai putin mucoasele si efectuarea hemostazei concomitent cu vaporizarea tumorii, ceea ce ar conduce la minimalizarea posibilitatii de diseminare a celulelor tumorale pe cale hematogena. Cel mai folosit LASER este Neodynium - YAG. Dezavantajul major al acestei metode este dat de imposibilitatea recoltarii de specimen tumoral pentru examenul histopatologic.
1.2. Cistectomia
Cistectomia totala este rar necesara la pacientii cu tumori superficiale; exeptie fac doar tumorile papilare nerezecabile sau/si carcinoamele in situ care nu raspund la terapia intravezicala. Pentru aceste cazuri selectionate, rata de supravietuire este buna. Brackner si col. afirma ca pacientii in stadiile Ta si T1 tratati prin cistectomie au avut rata de supravietuire comparabila cu a persoanelor de aceeasi varsta cu ei din populatia sanatoasa.
Amling [7], pe 220 de cazuri cu Ta, Tis, T0 sau T1 cu G mare sau recidive multiple, a efectuat cistectomie. Mortalitatea a fost de 2,3%. Supravietuirea la 5 ani a fost de 88%, 100%, 80% si respectiv 76%.
Memorial Hospital, pe 76 de pacienti cu cistectomie pentru tumori vezicale superficiale are urmatoarele supravietuiri la 5 respectiv 10 ani: Tis - 96%; T1 - 91,7%; respectiv 83% [48].
Statistica de la Mainz pe 246 de cazuri a continut 55 de cazuri pT1 cu cistectomie imediat dupa diagnostic, cu o supravietuire la 5 ani de 90% [239]. Alti 39 de pacienti cu pT1 au fost operati dupa prima recidiva. Supravietuirea acestora la 5 ani a fost de 28,5% (Stockle) [239].
La pacientii cu tumori vezicale de grad mare cu o responsivitate scazuta la terapia conservatoare si la care s-a efectuat imediat cistectomia, rata de supravietuire la 5 ani a fost de aproape 80%, spre deosebire de alti pacienti la care s-a temporizat cistectomia si la care in momentul deciziei de a efectua cistectomia aveau deja infiltrare musculara sau chiar mai mult, si deci un prognostic rezervat (Freeman si col., 1995) [46]. 182 de pacienti cu Ta, Tis, T1 la 34% pe piesa de cistectomie tumora a fost invaziva, si numai limitate la peretele vezical (organ confined). La cazurile cu <pT2N0 media de supravietuire a fost de 10,2 ani. La cazurile >pT3a N+ supravietuirea a fost de 6,9 ani.
Intr-adevar la pacientii cu tumori de grad mare, tumori superficiale cu recurenta crescuta sau Tis, la momentul cand se ia in calcul cistectomia, aproximativ 1/3 aveau evidente microscopice de stadiu mai avansat si aproximativ din pacientii cu stadiu crescut (invazie musculara sau chiar mai mult) aveau deja extensie extravezicala sau metastaze.
In concluzie, cu cat cistectomia (la pacientii cu risc crescut) se efectueaza mai repede cu atat posibilitatea de vindecare este mai mare (Malkowicz 1990, Wishnow, 1992) [136,181,259].
1.3. Tratamentul adjuvant
Teoretic, tumorile vezicale superficiale papilare T1 pot fi vindecate radical prin exereza completa in timpul rezectiei endoscopice. Cu toate acestea, aproximativ 50% dintre acestea recidiveaza in primii 5 ani dupa indepartarea tumorii primare si 80% in urmatorii 10 ani. Nu rareori, recidivele au o evolutie mai agresiva decat tumora primara, spre invazie si/sau metastazare.
Tratamentul tumorilor vezicale superficiale, in afara rezectiei transuretrale a acestora, presupune in majoritatea cazurilor si o forma de complementare terapeutica.
Diferitele forme de complementare terapeutica urmaresc:
prevenirea aparitiei recidivelor sau
prelungirea intervalului de timp in aparitia recidivelor si
eventual, scaderea grading-ului.
Tratamentul adjuvant al tumorilor vezicale superficiale este variat si include ca posibilitati chimioterapia sistemica, chimioterapia instilationala, imunoterapia instilationala, chimio-imunoterapia intravezicala, imunoterapia orala si radioterapia.
1.3.1. Tratamentul sistemic
Chimioterapia sistemica si-a diminuat importanta in tratamentul tumorilor vezicale superficiale atat de mult incat, in ultima vreme, nici nu mai este pomenita. Ea a fost mult depasita de tratamentul intravezical, mai ieftin, mult mai bine suportat si mult mai usor de administrat.
Cel mai eficace citostatic s-a dovedit a fi Cisplatinum-ul care, folosit singur, are rezultate favorabile in aproximativ 30% din cazuri. Din aceasta cauza, acesta a fost inclus in aproape toate schemele terapeutice care au fost folosite in diverse combinatii de-a lungul timpului.
Cele mai folosite combinatii in tratamentul tumorilor vezicale superficiale au fost: M-VAC (Metotrexat, Vinblastina, Adriamicin si Cisplatinum) si CMV (Cisplatinum, Metotrexat si Vinblastina). O comparatie intre cele doua scheme terapeutice a aratat o rata de raspuns favorabil mult mai buna in cazul M-VAC (69%) fata de CMV (28%) [273].
1.3.2. Tratamentul intravezical
Dupa rezectia endoscopica a tumorii vezicale primare, exista 60 - 80% sanse de recidiva. Majoritatea recidivelor sunt tumori noi.
Instilatiile intravezicale cu diferiti agenti antitumorali au demonstrat ca produc rezultate benefice in tratamentul sau profilaxia tumorilor vezicale.
Rezultatele studiilor efectuate au aratat un beneficiu semnificativ statistic in tratamentul adjuvant, instilational intravezical cu agenti citotoxici sau imunomodulatori.
Particularitatile fiecarui caz in parte sunt factori importanti in a determina care dintre pacienti si pentru cat timp va beneficia de tratamentul adjuvant.
Din acest punct de vedere, concluziile EORTC (European Organisation for Research and Treatment of Cancer ) sunt [103]:
1. pacientii cu mai putin de o recidiva/an sau cu tumora primara si solitara pTaG2-G3 sau pT1G1-G2-G3 pot beneficia de o singura instilatie cu agent citotoxic la 6 - 24 ore dupa TUR-V.
2. tumora solitara pTaG1 poate fi tratata numai prin TUR-V.
3. terapia adjuvanta cu agenti citotoxici trebuie instituita cat mai repede posibil dupa TUR-V.
4. pentru pacientii tratati cu agenti citotoxici imediat dupa TUR-V (6 - 24 ore), o cura de 6 luni este suficienta sau de 12 luni la pacientii la care, dintr-un motiv sau altul, instilatia intravezicala imediata nu se poate efectua.
5. agentii terapeutici citotoxici: Thiotepa, Epodyl, Mitomycin C, Doxorubicin si Cis-platinum, au avut rezultate comparabile in toate studiile efectuate.
6. la pacientii cu risc mic sau mediu de recidiva, Mitomycin C si BCG si-au dovedit cea mai buna eficacitate in a preveni recidivele in timp ce, la pacientii cu risc crescut, BCG este mult superior Mitomycin C sau Doxorubicinei.
7. tratamentul de prima linie al Cis este BCG.
8. BCG poate fi folosit cu succes ca tratament de linia a doua in caz de esec a chimioterapiei intravezicale.
Intrebarile la care insa nu s-a obtinut raspuns sunt [103]:
1. Daca rezultatele tratamentului profilactic depind de dozele folosite si
2. Daca un tratament de linia a doua cu chimioterapice are eficienta la pacientii la care a esuat terapia intravezicala primara cu chimioterapic sau imunoterapic cu BCG.
Chimioterapia intravezicala
Majoritatea cazurilor cu cancer vezical prezinta modificari pre-noeplazice ale uroteliului, pe toata suprafata lui, detectabile histologic la momentul diagnosticului tumorii primare.
Acest lucru traduce ceea ce poarta denumirea de "maladie de camp urotelial". Timpul necesar acestor modificari sa progreseze catre formarea tumorii si factorii ce intervin in cresterea tumorala nu sunt inca foarte bine cunoscuti.
Probabil ca principala cauza a aparitiei recidivelor tumorale se datoreaza modificarilor in campul urotelial, dar se banuieste si posibilitatea implantarii celulelor tumorale care plutesc in lichidul intravezical dupa rezectia transuretrala, in tesut urotelial sanatos [229].
Recidivele apar la 60 - 80% din pacientii operati pentru tumori vezicale superficiale. Global, pentru stadiile Ta si T1, rata supravietuirii la 5 ani este excelenta - 90% [244].
Cele mai multe dintre recidivele tumorale vezicale superficiale prezinta acelasi stadiu si grading si sunt rezolvate prin rezectii locale repetate.
Locatia unica in vezica urinara face ca mucoasa acesteia sa fie accesibila aplicatiilor locale de agenti atat chimiostatici cat si imunostimulatori. Datorita pozitiei superficiale a acestor tumori, toate celulele maligne si premaligne sunt expuse sistematic unei concentratii intraluminale de medicamente care nu ar putea ajunge aici (deloc sau in concentratii foarte mici) daca ar fi administrate prin curentul sanguin, intravenos.
Nu toti pacientii cu tumori vezicale superficiale au nevoie de tratament instilational intravezical. Indicatiile terapiei intravezicale includ [229] urmatoarele:
tumori primare multiple
recidive tumorale multiple
grading tumoral mare - G3
tumori in stadiul T1
citologie urinara pozitiva post-TUR-V
displazie sau Cis in biopsiile randomizate.
In acelasi timp, scopurile terapiei intravezicale urmaresc [229]:
preventia sau intarzierea aparitiei recidivei
eradicarea eventualei prezente de cancer rezidual microscopic sau Cis
prevenirea progresiei tumorale
reducerea indicatiilor de cistectomie radicala
mentinerea sau prelungirea calitatii vietii.
In timp ce prevenirea sau prelungirea timpului de aparitie a recidivelor tumorale este un scop atins, cel mai important tel a devenit preventia progresiei tumorale.
Studiile efectuate pana in prezent inca nu au stabilit daca chimioterapia intravezicala ar reduce rata progresiei tumorale.
Studii comparative prospective s-au facut cu mai multe tipuri de medicamente [103]:
agenti alchilanti - Thiotepa, Mitomycin C, Cis-platinum, Acid gama-linoleic, Suramin.
antibiotice antitumorale - Epirubicin, Doxorubicin, Valrubicin, Estramustin.
Alte medicamente ca 5-fluorouracil, Mitoxantrone sau Etoglucid nu au fost investigate niciodata pe studii mari, controlate ori s-au scos din uz.
Asa cum au aratat studiile EORTC Genito-Urinary Group si ale Medical Research Council, citostaticele pot fi instilate in vezica la cateva ore de la operatie fara a produce complicatii severe.
In aceste studii, administrarea intravezicala timpurie de Epirubicin (80 mg in 50 ml de ser fiziologic), in primele 6 ore dupa TUR-V, la pacientii cu tumori vezicale solitare stadiate Ta si T1 indiferent de G, a redus rata de aparitie a recidivei/an la 50% din cazuri pe o perioada de urmarire medie de 2 ani.
Instilatia intravezicala cu Thiotepa a fost introdusa in anul 1961 de Jones si Swinney [citat de 122]. Mitomycin C a fost studiata initial in Japonia. Evaluarea raspunsului terapeutic al utilizarii chimioterapicelor analizate separat sau prin comparatie, a dus la acumularea unui volum urias de studii efectuate in toata lumea 207.
Comparand Thiotepa (50 mg in 50 ml ser) cu Mitomycin C (20 mg in 20 ml ser), Soloway a obtinut cu Thiotepa un raspuns complet in 30% din cazuri, raspuns partial in 40% din cazuri, iar cu Mitomycin C - raspuns complet in 39% din cazuri si partial tot in 40% din cazuri [207].
Heney a obtinut rezultate asemanatoare si atrage atentia ca odata cu cresterea grading-ului tumoral, rata de raspuns complet scade proportional. El enumera ca efecte secundare, leucopenia si anemia, dupa tratamentul cu Thiotepa si rash cutanat dupa Mitomycin C [67,68].
Flanigan a observat ca Thiotepa nu da toxicitate care sa oblige la stoparea tratamentului, iar timpul mediu de aparitie a recidivelor este usor mai lung decat in cazul Mitomycin C, care in plus da toxicitate ce obliga la oprirea tratamentului in 28% din cazuri [38].
Comparatia intre Mitomycin C (20 mg in 20 ml ser) si Doxorubicin (50 mg in 50 ml ser) au aratat o rata a recidivei mai scazuta in primul caz (5,2 - 15%) decat in al doilea (27%) [206].
Epirubicina administrata intravezical (40 mg in 40 ml ser) in 6 cure saptamanale comparativ cu 6 cure saptamanale plus 11 cure lunare, a aratat o diferenta foarte mica privind rata recidivelor - 17% in primul caz si 16% in al doilea, dar a produs efecte secundare de tipul hematurie si iritabilitate vezicala in peste 50% din cazuri [167].
Estramustina este un citotoxic care pana in prezent nu a fost studiat decat in vitro si care pare sa devina alternativa terapeutica la tumorile vezicale rezistente la Epirubicina [92].
De asemenea, studiile preliminare de laborator efectuate cu Suramin (N-metil-N-nitrozuree) pe sobolan au aratat o rata de raspuns complet in 50 - 60% din tumorile vezicale superficiale.
Pentru a obiectiva rezultatele favorabile ale chimioterapiei intravezicale, mai multe studii au lasat pe loc, in vezica urinara, o tumora papilara apreciata la o greutate de pana la 1g, cu rol de tumora marker. Rezultatele publicate pana in prezent sunt incurajatoare, dar sunt necesare evaluari in continuare pe loturi mai mari de pacienti [10,11, 86, 167, 206, 273].
Desi efectul citotoxic asupra mai multor linii celulare neoplazice este cunoscut inca din anii '80, acidul gama-linoleic a fost folosit ca tratament intravezical in tumorile vezicale superficiale, foarte recent. Studiile preliminare, folosind doze cuprinse intre 50 si 125 mg de acid gama-linoleic in 50 ml de ser instilat intravezical a aratat o rata de raspuns de 43% cu disparitia tumorii marker [65].
Intr-un alt studiu al EORTC Genito-urinary Group, in care insa din start au fost exclusi pacientii cu tumori vezicale stadiate T1G3 si toti cu concomitenta Cis, tratamentul intravezical a fost efectuat cu Mitomycin C, Epirubicina sau BCG. La toate cele trei grupuri de tratament, dupa disparitia tumorii marker, biopsiile din locul unde au fost acestea au gasit tumora numai in 0,9% din cazuri. Autorii au conchis, tinand cont de acest rezultat, ca biopsiile din tesut urotelial macroscopic sanatos nu-si mai au rostul [170].
Tot intr-un studiu al EORTC Genito-urinary Group, faza a doua, s-a comparat capacitatea ablativa a Mitomycin C si Epirubicin la pacientii cu tumori multiple Ta si T1, G1 - G3, primitive sau recidivate.
Dupa cate 8 instilatii saptamanale, rezultatele cu cele doua tipuri de medicamente au fost: in grupul de pacienti tratati cu Mitomycin C - tumora a disparut in 57% din cazuri, a ramas la fel in 39% din cazuri si a progresat in 4% din cazuri, iar in grupul tratat cu Epirubicin - tumora a disparut in 56% din cazuri, a ramas la fel in 22% din cazuri si a progresat in 22% din cazuri [10].
Analizata global, chimioterapia intravezicala are cateva dezavantaje si anume, costul destul de mare al unei cure complete, rata de raspuns complet semnificativ mai mica decat in cazul imunoterapiei si efectele secundare (mielosupresie, fibroza vezicala) destul de frecvente [170].
Imunoterapia intravezicala
Cu toate ca din punct de vedere al tolerantei, efectele secundare ale chimioterapiei intravezicale sunt mult mai blande si mai rare, imunoterapia intravezicala a dovedit rezultate net superioare in tratamentul tumorilor vezicale superficiale, indiferent de stadiu. Cele mai pertinente studii fac referinta la BCG (bacilul Calmette-Gurin), Interferon si IL-2 (interleukina 2).
A. Imunoterapia intravezicala cu BCG
Bacilul Calmette-Gurin sau BCG, preparat din Mycobacterium bovis, este in mod curent cel mai activ agent imunoterapeutic pentru uz intravezical si este considerat ca tratament de prima linie la pacientii cu tumori vezicale superficiale agresive T1G3 si Cis [138].
Istoria imunoterapiei cu BCG in neoplasme incepe in jurul anului 1880, cand un chirurg american W.E. Coley a tratat un pacient cu limfosarcom recidivant dupa doua infectii erizipeloase, cu extracte bacteriene filtrate, in ideea terapiei adjuvante a carcinomului. Activitatea imunogenica pronuntata a preparatelor mycobacteriene a fost apoi aplicata ca terapie adjuvanta sistemica impotriva leucemiei limfoblastice, de catre Freund si apoi de Math. Insa rezultatele promitatoare de la inceput nu s-au repetat, asa ca aceasta abordare a fost abandonata [12].
Mai tarziu, in 1966, Coe si Feldman au aratat ca, precum pielea, vezica urinara poate sa atinga un raspuns de hipersensibilitate de tip intarziat la o provocare antigenica si deci, ar putea fi un organ ideal pentru imunoterapie locala. Aceste rezulate, formeaza bazele teoretice pentru imunoterapia topica intravezicala, raportata pentru prima data la oameni de A. Morales si colab. in anul 1976 [6].
De la introducerea BCG in practica urologica, impactul acestei terapii asupra managementului tumorilor vezicale superficiale a fost atat de puternic incat si acum, poate fi considerat cea mai de succes terapie din toate imunoterapiile aplicate la oameni si de asemenea, ca una din cele mai importante etape in controlul acestor neoplasme.
Dar in ciuda raspandirii largi a acestui tratament, modul prin care BCG isi exercita activitatea antitumorala nu este inca bine inteles si inca nu se cunoaste cine sau ce omoara celulele neoplazice.
Oricum exista doua premize de certitudine, si anume [138]:
este necesar contactul direct intre BCG si celulele tumorale, si
este necesara prezenta limfocitelor T (CD4 helper si CD8 citolitice) pentru activitatea antitumorala mediata de BCG.
Contactul direct intre BCG si celulele tumorale este necesar pentru a permite atasarea bacteriei la celulele tumorale si la mucoasa vezicala, prin intermediul fibronectinei. Dupa aceasta, bacilii sunt inclusi prin fagocitoza activa, atat in uroteliul normal cat si in celulele tumorale. In continuare, celulele prezinta antigenul de suprafata al limfocitelor T care initiaza o cascada de evenimente imunologice locale si sistemice [45]:
specifice - implicand anticorpi si componente imune celulare.
nespecifice - citokine asociate cu reactia de hipersensibilitate de tip intarziat, celule natural killer, celule killer activate de limfokine.
Analize sistematice ale raspunsului imun local in vezica urinara, au fost facute in mai multe studii. Tehnicile folosite au inclus analize imunochimice ale subpopulatiilor celulare, infiltrate de citokine detectabile local si analize ale urinii pacientului pentru a determina secretia de citokine. Aceste studii au caracterizat raspunsul imun local imediat si pe termen lung, la pacientii cu imunoterapie intravezicala cu BCG [144].
a). Imunohistologie
In unele studii imunohistologice, biopsiile recoltate "la rece" (cu pensa de biopsie) de la pacientii cu tumori vezicale superficiale, s-au facut atat inainte de operatie, cat si in timpul urmaririi postoperatorii. Analizele imunohistologice au relevat diferente interesante. Astfel, inainte de terapie biopsiile din zonele de uroteliu fara tumora au aratat o concentratie mica de celule mononucleare. Acestea au fost gasite suburotelial, iar uroteliul nu prezenta celule inflamatorii. La subpopulatiile de celule T s-a observat un numar mic de celule CD4 pozitive (T helper) in comparatie cu celulele CD8 pozitive (T supresoare). Inaintea terapiei cu BCG, raportul de celule locale T helper / T supresoare in vezica a fost de . Macrofagele au fost abia vizibile in stroma suburoteliala [12].
Dupa a sasea instilatie cu BCG, s-a observat o reactie inflamatorie pronuntata a intregului perete vezical.
Celulele mononucleare si granulocitele polimorfonucleare infiltrau submucoasa si erau vizibile chiar in uroteliu si in stratul muscular. In toate biopsiile s-au observat agregari de celule imunocompetente, asa-numitele granuloame induse de BCG. Aceste structuri folicul-like au fost detectate aproape exclusiv in submucoasa bogat vascularizata. Infiltratul de celule mononucleare din peretele vezical, dupa a sasea administrare de BCG, a fost alcatuit in cea mai mare parte din celule T, dar de data aceasta, cu predominenta celulelor CD4 pozitive fata de celulele CD8 pozitive. Raportul celulelor CD4 / CD8 a fost de 2/1, deci complet inversat fata de vezica netratata [12, 122].
La 3 luni dupa tratamentul cu BCG, infiltratul celular cu celule T si B se concentra in granuloamele persistente. Aceste caracteristici imuno-histologice au persistat si la analizele ulterioare, la 6, 9 si la 12 luni dupa inceperea terapiei [176].
Analizele cantitative ale multor populatii celulare, au aratat o evolutie caracteristica raspunsului imun. Celulele care exprima HLA-D activate au atins un maximum la 6 saptamani de la inceperea tratamentului cu BCG, apoi au scazut constant impreuna cu celulele receptoare de IL-2. Chiar si dupa 1 an de zile de la tratamentul initial cu BCG, raportul local al celulelor T helper / T supresoare a fost crescut in favoarea primelor [12, 122].
Pe baza rezultatelor acestor studii s-a concluzionat ca schema terapeutica initiala, in tratamentul intravezical cu BCG, pentru a obtine un maximum de raspuns imun trebuie sa se intinda pe parcursul a 6 saptamani.
Un timp mai scurt atrage dupa sine probabilitatea unui raspuns imun incomplet si implicit rezultate terapeutice mai slabe, iar un timp mai lung nu-si are rostul.
Examinarile imunohistologice dupa terapia cu BCG indica o stimulare a sistemului imun local al vezicii urinare. Aceasta stimulare difera complet de cistita nespecifica prin persistenta si calitate; in timp ce cistita specifica indusa de citostatice este caracterizata de predominenta infiltrarii de celule polimorfonucleare, BCG induce o crestere marcata a celulelor mononucleare, imunocompetente, cum ar fi limfocitele si macrofagele.
Acumularea in cantitati mari de celule imunocompetente poate fi recunoscuta drept centre de imunoactivitate locala pe termen lung [176].
b). Raspunsul imun umoral urinar
Mai multe studii au analizat secretia de citokine urinare dupa imunoterapia cu BCG. Astfel s-a observat ca, pe parcursul primelor 24 de ore dupa instilatia cu BCG, a crescut foarte mult secretia de IL-1, IL-2, factorul de necroza tumorala (TNF), gama-interferon si alte citokine, cu valori maxime la 8 ore si normalizare la 24 de ore [6], [86], [122].
Nici IL-2 si nici factorul de necroza tumorala nu au fost detectate in urina pacientilor sanatosi. Secretia acestor citokine arata clar caracterul imunologic al reactiei induse de BCG.
Interleukina 2 (IL-2) este produsa predominent prin activarea celulelor T helper. Aceasta induce proliferarea si diferentierea limfocitelor T. Efectul ei asupra celulelor tumorale este exercitat mai ales prin generarea celulelor killer activate de limfokine (LAK cells), care au fost folosite clinic ca imunoterapie in carcinoamele umane [12].
Factorul de necroza tumorala (TNF) este secretat de catre macrofagele activate si printre alte efecte are si o actiune citotoxica directa asupra celulelor tumorale. De asemenea, are actiune inhibitorie asupra vascularizatiei tumorii ducand la necroza. Concentratiile urinare ale TNF induse de BCG, teoretic ar trebui sa fie suficient de mari ca sa exercite un efect citotoxic asupra celulelor tumorale. Practic acest lucru ramane de dovedit.
Detectarea citokinelor in peretele vezical prin metode imuno-histochimice arata persistenta pe termen lung a acestor imuno-modulatori la locul unde ei sunt produsi, ca si actiunea lor asupra celulelor mononucleare.
Studiile raspunsului umoral la BCG au aratat nu numai un raspuns limfoproliferativ specific ci si o crestere a anticorpilor impotriva antigenelor mycobacteriene. Se pare ca exista o corelatie semnificativa intre nivelul IL-2 si rata recidivei precoce. Titrul mic de IL-2 arata un risc de recidiva tumorala in primele 6 luni de aproape 20% [50, 122, 123, 138, 144, ].
c). Valoarea prognostica a studiilor
Desi arata o corelatie intre titrul scazut de Il-2 si recidiva tumorala timpurie, relevanta prognostica a citokinelor urinare dupa imunoterapia intravezicala cu BCG este inca neclara.
Mai multe grupuri de lucru au analizat citotoxicitatea directa a BCG pe celulele neoplazice vezicale si au aratat ca acesta nu este un mecanism de importanta primordiala. Nici celulele mononucleare din sangele periferic, nestimulate, nu au efect citotoxic asupra celulelor neoplazice vezicale. Citotoxicitatea BCG este insa mediata de celulele LAK (celule killer activate de limfokine) si celulele BAK (celule killer activate direct de BCG) [144],.
Prin testarea celulelor LAK s-a dovedit ca acestea au efect citotoxic pronuntat asupra celulelor neoplazice vezicale si probelor proaspete de carcinom vezical, proaspat rezecat. Acest efect al celulelor BAK a fost evidentiat prin inocularea celulelor mononucleare cu BCG timp de mai multe zile [12, 176].
In concluzie, BCG induce un raspuns imun local complex, implicand mecanisme imune umorale si celulare.
Urmariri pe termen lung arata o predominenta a populatiei de celule T - helper / celule de inductie si persistenta citokinelor inflamatorii in peretele vezical. Aceste mecanisme inflamatorii locale subclinice persista pe termen lung in asa-numitele granuloame induse de BCG si ar putea avea un rol important in recidiva tumorala a pacientului.
In vitro s-au descoperit cel putin doua mecanisme efectoare citotoxice celulare. La citotoxicitatea directa a celulelor LAK impotriva cancerului vezical a fost adaugat inca un fenomen citotoxic denumit fenomenul celulelor killer activate de BCG (BAK). Ambele fenomene celulare efectoare nu sunt limitate de complexul major de histocompatibilitate (HLA) si de aceea isi omoara tinta mai mult sau mai putin specific [12, 122].
d). Tulpini de BCG
Cele mai multe tulpini de BCG utilizate in tratamentul instilational intravezical al tumorilor vezicale superficiale sunt derivate din tulpina Pasteur dezvoltata de Albert Calmette si Camille Gurin in ultima decada a secolului al XIX-lea. Cele mai cunoscute dintre acestea sunt prezentate in tabelul nr.24.
Desi toate tulpinile ar trebui sa actioneze similar, in realitate exista diferente intre proprietatile diverselor vaccinuri disponibile. Aceste proprietati, fie ca sunt de natura fizica, fie de natura biologica, pot diferi ca nivel de eficacitate [144].
Cele cateva studii comparative intre unele din tulpinile BCG, au aratat ca imunogenicitatea unui preparat este legata direct de viabilitatea vaccinului respectiv, de abilitatea bacililor de a se multiplica in vivo si de numarul de unitati formatoare de colonii (CFU) per flacon, respectiv per instilatie [144].
Tabelul nr.24. Tulpini de BCG in uz:
|
Tulpina BCG |
Doza recomandata |
Unitati formatoare de colonii / instilatie |
|
Pasteur (Franta) Arnaud Frappier (Canada) Connaught (Canada) Tice (USA) Glaxo (USA) Evans (UK) Moreau (Brazilia) RIVM (Olanda) Berna (Italia) Tokyo (Japonia |
150 / 75 mg 120 mg 81 mg 50 mg 75 mg 75 mg 100 mg 40 / 80 mg |
6x108 1 x107 8-32 x108 2-8 x108 5 x108 8-26 x106 2 x109 5 x108 5 x106 |
|
Institutul Cantacuzino (Romania) |
150 mg |
6 x107 |
e). Calea de administrare
In trecut au fost folosite patru cai diferite de administrare a BCG in tratamentul tumorilor vezicale superficiale [12,122,138]:
injectarea intravezicala, la baza tumorii - s-a raportat in 1975 si a fost propusa de Martinez Pineiro si Muntanola.
administrarea prin scarificare cutanata - a fost propusa fie singura, fie combinata cu injectii in leziune, de aceiasi autori.
instilatii intravezicale combinate cu administrare prin scarificare - propusa de A. Morales si colab. in 1976.
administrare orala - propusa de Netto si Lemos in 1983.
Injectiile intralezionale au fost rapid abandonate datorita efectelor adverse severe. Administrarea orala s-a dovedit a fi clar inferioara instilatiilor intravezicale si niciodata nu a castigat adepti.
BCG administrat numai prin scarificare a dovedit eficienta impotriva aparitiei metastazelor, desi a fost dificil de estimat valoarea reala, dar nu a avut eficacitate antitumorala ablativa. Din aceste cauze, calea de administrare a BCG in tumorile vezicale superficiale unanim acceptata, este calea intravezicala.
Tratamentul intravezical pentru imuno-profilaxia si ablatia cancerului restant vezical superficial, indeplineste cele patru cerinte de eficienta optima a BCG si anume [12,122,138]:
contactul direct intre BCG si celulele tumorale,
masa tumorala trebuie sa fie mica,
doza trebuie sa fie adecvata, si
tumorile raspund mai bine la tratament cand sunt limitate la organul din care s-au dezvoltat.
Pana in prezent insa, nu s-a stabilit doza optima de BCG in functie de tulpinile folosite; datele din tabelul de mai sus reprezinta dozele cele mai folosite.
f). Indicatii si contraindicatii
In cei aproape 30 de ani de folosire a terapiei intravezicale cu BCG, s-au remarcat trei aplicatii clinice distincte:
profilaxia impotriva recidivelor si progresiei dupa indepartarea tumorii,
tratamentul Cis, si
terapia ablativa a bolii reziduale sau multifocale.
1. Nu toti pacientii cu cancer vezical superficial au nevoie de terapie profilactica intravezicala, mai ales cu BCG ale carui efecte secundare sunt mai mari decat ale agentilor chimioterapeutici utilizati de rutina in acest scop (Thiotepa, Mitomycin C, Doxorubicin) [39]. In general indicatia terapiei profilactice se adreseaza pacientilor cu tumori cu prognostic slab cum ar fi tumorile TaG3, toate tumorile T1 indiferent de grading, tumorile primare multiple indiferent de T si G [12].
2. Cis este tinta optima pentru tratamentul intravezical cu BCG, avand o rata de raspuns de 70%, schimband radical indicatia anterioara de cistectomie la acesti pacienti [122].
3. Capacitatea ablativa a BCG a fost dovedita in ultimii ani prin studii ce folosesc tumori marker si la pacientii cu tumori vezicale superficiale reziduale sau multifocale, mici, cu aspect "de catifea" [4,6,28,39,75].
Este contraindicata la pacientii cu cancer vezical T2 sau mai mare (unde indicatia este de cistectomie), la subiectii imunocompromisi (HIV, sindrom de imunodeficienta congenitala sau pacienti in tratament imunosupresiv), pacienti cu alte carcinoame progresive (leucemie, boala Hodgkin), pacienti cu tuberculoza activa, gravide, femei care alapteaza [12,122].
g). Limitele terapiei intravezicale cu BCG
Limitele terapiei instilationale intravezicale cu BCG sunt date de pacientii cu tumori cu risc scazut sau intermediar la care chimioterapia intravezicala este prima alegere [122,206].
h). Eficacitate
Potrivit rezultatelor pe termen lung obtinute de Lamm pe un lot de 1278 de pacienti rata recidivelor in tumorile vezicale superficiale dupa TUR-V unic a fost de 75% comparativ cu TUR-V+BCG unde a scazut la 31%, iar rata progresiei tumorale a scazut dupa TUR-V de la 29% la 14% la pacientii cu TUR-V +BCG [39].
De asemenea studiile comparative ale BCG cu citostaticele intravezicale au aratat superioritatea neta a BCG in fata Thiotepa, Mitomycin C sau Doxorubicin .
O atentie deosebita se acorda in ultimii ani tumorilor vezicale superficiale stadiate T1G3, considerate tumori cu grad inalt de risc. Din acest motiv, unii autori sustin ideea cistectomiei radicale precoce [87]. Alti autori, prin experienta lor, sustin ca tratamentul conservator urmat de profilaxie intravezicala poate da rezultate foarte bune in majoritatea cazurilor, prelungind calitatea vietii acestor pacienti [123, 176, 245].
Patard si colab. au publicat rezultatele unui studiu la pacientii rezecati numai pentru tumori stadiate T1G3 cu urmatoarele rezultate [176]:
Tabelul nr.25. Rezultatele tratamentului tumorilor vezicale T1G3.
|
pT1G3 |
TUR-V |
TUR-V+BCG |
|
Rata recidivei Rata progresiei Rata supravietuirii globale Rata supravietuirii specifice |
Rata mortalitatii prin cancer a fost de 4%. Acesti autori au observat ca rata supravietuirii acestor pacienti comparata intre cei tratati cu TUR-V+BCG si cei cu cistectomie este asemanatoare.
Thierry si colab., pe un lot de pacienti stadiati tot T1G3, au avut o rata de raspuns favorabil de 71%, in timp ce, ceilalti 29% din pacienti au ajuns la cistectomie [245].
Lebret si colab. au obtinut rezultate asemanatoare (80% raspuns favorabil) [123].
i). Eficienta pe termen lung
Obiectivul pe termen lung al oricarui tratament adjuvant pentru tumori vezicale superficiale este sa previna progresia bolii si sa imbunatateasca supravietuirea. Desi chimioterapia intravezicala a redus rata de recidiva tumorala pe termen scurt, aceasta nu a atins acelasi obiectiv pe termen lung, de prevenire a progresiei bolii.
Studiind facorii de risc ce influenteaza progresia tumorala la pacientii cu tumori vezicale superficiale, Herr si colab. au observat ca la pacientii tratati cu BCG la care au avut un raspuns favorabil, rata mortalitatii a fost de 7% comparativ cu pacientii care au prezentat recidive timpurii, unde rata mortalitatii a fost de 31%. Tot ei au atras atentia ca exista tumori vezicale care nu raspund la tratamentul cu BCG, mai ales cele T1G3 mai mari de 5 cm [104].
Schellhammer si colab. au avut o rata de raspuns complet in 70% din cazuri, iar in 17% din cazuri nu au obtinut nici un fel de raspuns, pacientii ajungand la cistectomie [207].
Un studiu canadian a publicat o rata a recidivelor in tumorile vezicale superficiale de 12% dupa TUR-V si de 7,4% dupa TUR-V completat cu BCG [91].
De asemenea, Lamm a aratat ca 64% din pacientii cu raspuns la terapia intravezicala cu BCG, raman tumor-free pe o durata de peste 5 ani de la tumora primara [122].
j). Schemele terapeutice
Schemele terapeutice variaza foarte mult, de la cure scurte de 6 - 12 saptamani pana la cure de intretinere, pe o perioada de 2 - 3 ani.
In primul rand toti clinicienii sunt de acord ca instilatile vezicale cu BCG nu trebuie incepute mai devreme de 3 saptamani de la TUR-V, pe mucoasa inca necicatrizata, deoarece exista risc de diseminare sistemica bacilara [50,69,83,122,169,267]. De asemenea, majoritatea autorilor sunt de acord ca obtinerea inductiei unui raspuns imun bun calitativ si de durata se obtine, posibil dupa 4 saptamani, dar cu certitudine dupa 6 saptamani de la inceperea terapiei intravezicale cu BCG [83,138,267]. Numai unii insa accepta ideea curelor lunare de intretinere, pe o perioada de timp variabila (4 - 12 luni) [69,83,122,167,267].
Catalona si colab. au descoperit ca rata de remisiune completa dupa cura primelor 6 saptamani a fost de 51%, dar a crescut cu inca 38,7% dupa a doua cura [69].
Lamm analizand eficienta BCG in schema profilactica pe termen lung, intr-o perioada de urmarire de 5 ani, au raportat rata de succes terapeutic de 78% dupa prima cura si 98% dupa a doua cura [122].
Cea mai moderna schema terapeutica ramane urmatoarea: dupa TUR-V se aplica instilatii saptamanale timp de 6 saptamani (inductie), urmate de 6 instilatii lunare, apoi o instilatie din 3 in 3 luni timp de inca un an si jumatate [138].
Figura 76. Schema
Lamm pentru instilatiile cu BCG [244].
Zlotta si colab au fost cei care au observat ca raspunsul imun
limfoproliferativ atinge maximum la 4 saptamani de la inceperea
instilatiilor cu BCG in 80% din cazuri, ajunge la 100% dupa 5
saptamani de cura si revine la valorile preterapeutice
dupa 6 luni de la incheierea acesteia [267]. Intr-un studiu efectuat de Southwest Oncology Group (SWOG) in 1992
de Lamm [244] s-a demonstrat ca
pacientii care au primit 6 saptamani terapie de inducere cu BCG
si apoi 3 saptamani consecutiv la 3 luni, 6 luni si apoi la
fiecare 6 luni timp de 3 ani au avut o rata de recadere semnificativ
mai buna, recidivele la 7 ani scazand de la 52% la 25% decat
pacientii care au beneficiat doar de primele 6 saptamani de
inducere. Beneficiul substantial a fost in mod evident pentru
pacientii cu tumori superficiale care nu aveau si carcinom in
situ.
k). Efecte adverse
Efectele adverse ale tratamentului cu BCG constituie o preocupare a clinicienilor inca de la inceputul folosirii acestuia in terapia tumorilor vezicale superficiale.
Tabelul nr. 26. Clasificarea complicatiilor administrarii intravezicale a BCG-ului (dupa OMS-180).
|
CLASA I |
CLASA II |
CLASA III |
CLASA IV |
|
Clasa I A SEMNE GENERALE Sindrom gripal >2h si <48h, Febra T≥380C si <38,50C Dureri musculare Astenie Clasa I B Semne locale >I2h si <48h Cistita Polakiurie nocturna > 2 si < 5 mictiuni /noapte Polakirie diurna > 6 si < 20 mictiuni /zi lmperiozitate mictionala <G3 Grad 1= Minima sau moderata Grad 2= Severa fara de urina Grad 3= Severa cu pierdere necontrolata de urina Hematurie <G3 Grad 1= fara cheaguri Grad 2= cu cheaguri Grad 3= obstructie sau transfuzie Arsuri mictionale <G3 Pierdere necontrolata de urina la sfirsitul mictiunii <G3 Pierdere necontrolata de urina la efort <G3 Disurie <G3 Semne Regionale Dureri suprapubiene izolate <G3 Dureri renale izolate <G3 Dureri perianale <G3 Constipatie <G3 |
Clasa II A Semne generale Sindrom gripal G1 sau G2 ≥ de la 48 de ore si ≥7 zile Febra T≥de la 38,50C la≥48 ore ≥de la 39,50C la ≥12 ore Dureri musculare =G3 Astenie =G3 Artralgie Grad 1= Minima Grad 2= Moderata Grad 3= Severa Clasa II B Semne locale G1 sau G2 ~de la 48 ore < 7 zile cu semen clinice severe ~G3 Cistita Polakiurie nocturna ≥ 5 mictiuni /noapte Polakiurie diurna ≥ 20 mictiuni/zi Hematurie =G3 Usturimi mictionale =G3 Pierderi necontrolate de urina la sfirsitul mictiunii =G3 Pierderi necontrolate de urina la efort =G3 Disurie =G3 Semne Regionale Dureri suprapubiene izolate =G3 Dureri renale izolate =G3 Dureri perianale =G3 Constipatie =G3 |
Clasa III A Semne generale Sindrom gripal ≥7 zile Febra ≥39,50C si > la 12 ore ≥38,50C si > la 48 ore Reactie alergica Gradul 1= edeme Gradul 2= bronhospasm Gradul 3= bronhospsm regresiv sub tratament per os Gradul 4= soc anafilactic Rash cutanat Gradul 1= eritem Gradul 2= descuamare uscata, prurit sau vezicule Gradul 3= descuamare suivante sau ulceratie Gradul 4= dermatita exfoliativa cu necroza cutanata Artrita Uveita, iridociclita Clasa III B Semne locale Cistite ≥7 zile sau Semne Regionale Prostatite Epididimite Orhite Abces renal Stenoze uretrale |
Clasa IV Colaps cardio-vascular Detresa respiratorie CIVD Hepatita Gradul l - Transaminaze: 1,2-2,5 x N Gradul 2 - Transaminaze: 2,6-5 x N Gradul 3 - Transaminaze: 5,1-10 x N Gradul 4 - Transaminaze: 10 x N Septicemie: - miliara - infectie vasculara - infectare de proteza |
Tabelul nr.27. Tratamentul complicatiilor post-instilationale cu BCG.
|
Tratamentul efectelor secundare de CLASA I In marea majoritate FARA TRATAMENT RAR: Antalgice non-opiacee - paraceatamol Anticolinergice - oxzbutinine Antispastice FARA SPITALIZARE CLASA II OCAZIONAL Antalgice non-opiacee: paracetamol Anticolinergice: oxybutinine Antispastice Verificarea absentei infectiei urinare FARA SPITALIZARE CLASA III A Spitalizare I ECBU / ASAT si ALAT/ Rx toracic Antalgice non-opiacee: paracetamol / AINS Esec la 48h AINS + OFLOCET 200mg X 2/7zile In caz de ESEC Oprirea BCG Corticoizi IV 0,5 pana la 1mg/kg/zi + OFLOCET 200mg x 2/zi sau: HIN 300 mg/zi + RIPAMP 600mg/zi + Etambutol 1200 mg/zi pana la remisiunea semnelor si Corticoizi IV 0,5-1 mg/kg/zi |
Tratamentul efectelor secundare de CLASA III B (CISTITA PERSISTENTA) persistenta peste 8 zile dupa instilatii FARA SPITALIZARE I Ex.urina BCG se amana cu o saptamana AINS / + OFLOCET 200mgx2/zi - 7 zile Daca este INEFICACE Corticoizi oral 0.5 - 1mg/kg/zi + OFLOCET 200mgx2/zi sau *[HIN 300 mg/zi + RIFAMP 600mg/zi pana la remisiunea semnelor ) Corticoizi oral 0.5 a -1mg/kg/zi SE DISCUTA CU BOLNAVUL DUPA DISPARITIA SEMNELOR: Reducerea dozelor la urmatoarele instilatii (2/3,1/3,1/10)? Oprirea administrarii de BCG |
Tratamentul efectelor secundare de CLASA III B (REGIONALE) Infectii ale organelor genitale externe sau prostatite simptomatice SPITALIZARE I Ex.urina Oprirea definitiva a BCG-ului HIN - 300 mg/zi Rifampicin - 600 mg/zi, 3 luni Daca NU exista un raspuns clinic = Rezolvare chirurgicala INFECTII RENALE spitalizare I Ex.urina Oprirea definitiva a BCG-ului HIN - 300 mg/zi Rifampicin - 600 mg/zii 3 luni Ethambutol - 1200 mg/zi PENTRU REACTIILE ARTICULARE AINS 48 ore PENTRU REACTIILE ALERGICE <G3 Anti-histaminice 48 de ore Daca sunt ineficace: HIN 300 mg/zi+ RIFAMP 600mg/zi~ pana la disparitia simptomatologiei Oprirea definitiva a BCG-ului TRATAMENTUL EFECTELOR SECUNDARE DE CLASA IV Spitalizare Oprirea definitiva a BCG-ului HIN - 300 mg/zi Ethambutol - 1200 mg/zi Rifampicine - 600 mg/zi ) Corticoterapie IV 0.5 - 1 mg/kg/zi |

Figura 77. Cistita granulomatoasa tuberculoasa
post-instilatii cu BCG.
B. Imunoterapia cu interferoni
Interferonii sunt cunoscuti ca avand efect antiviral, activitate directa antiproliferativa, inhibitie a angiogenezei, intervenind in reglarea diferentierii celulare, in activarea celulelor efectoare imune, inductia productiei de citokine si in cresterea expresiei antigenului tumoral asociat [28].
Din cele 3 tipuri de interferon (alfa, beta, gamma), singurul care este exprimat in celulele neoplazice uroteliale este alfa-interferonul.
Alfa-interferonul recombinant, adica alfa-2b-interferonul (IFN-a2b), administrat intravezical, creste activitatea citotoxica a celulelor T si a celulelor natural killer [86].
Unele studii au utilizat alfa-2b-interferonul instilat intravezical, in doze variabile intre 10 si 100 milioane de unitati saptamanal, timp de 12 saptamani si apoi lunar timp de 1 an, obtinand o rata de raspuns favorabil intre 5 si 66%. Dar studii ulterioare au aratat rezultate atat de contradictorii incat alfa-2b-interferon ramane ca eventuala imunoterapie de linia a doua, adresata pacientilor refractari sau cu intoleranta la BCG, toxicitatea interferonului fiind minima (simptome de gripa) [267].
C. Imunoterapia intravezicala cu IL-2
Interleukina 2 este una din citokinele cheie in polarizarea raspunsului imun. Este cunoscuta corelatia semnificativa intre IL-2 si recidiva tumorala vezicala precoce la pacientii tratati cu BCG.
Recent a fost evaluat efectul IL-2 asupra tumorilor vezicale papilare stadiate T1. Studiile s-au facut pe tumori marker, abandonate intravezical dupa TUR-V. Interleukina 2 a fost administrata in doze de 3 x 106 unitati, timp de 5 zile consecutiv. Cistoscopiile efectuate si biopsiile vezicale la 2 luni dupa tratament au atatat o rata de raspuns complet de 80% cu disparitia tumorii marker, 40% din pacienti au ramas tumor-free la 4 ani de la tratament. Nu s-a inregistrat nici un fel de efect secundar. Studii noi sunt in curs [267].
D. Chimio - imunoterapia intravezicala
Teoretic, un efect antitumoral mai mare s-ar putea obtine combinand doua terapii efective, separate. Acest concept a fost testat de van der Meijden si colab. la un lot de pacienti la care au lasat pe loc o tumora marker [139].
Schema terapeutica a constat in Mitomycin C (40 mg in 50 ml ser) administrat intravezical, saptamanal, timp de 4 saptamani, urmat de BCG timp de 6 saptamani consecutive. Rata de raspuns complet a fost de 54% .
Bono si colab. au combinat Epirubicin (50 mg in 50 ml ser) saptamanal timp de 8 saptamani, cu BCG (120 mg) saptamanal timp de 6 saptamani. Urmarirea acestor pacienti pe o perioada de 4 ani a aratat o rata a recidivelor de 23,4% cu o rata a progresiei tumorale de 7,4% [10].
Nefiind inca suficiente studii cu date culese pe loturi mari de pacienti si urmarire indelungata, parerile privind chimio-imunoterapia intravezicala raman impartite, sau asa cum a spus Badalament: "mai mult nu inseamna neaparat mai bine" [citat de 103].
Acest protocol nu se aplica in caz de perforatie vezicala.
BCG-ul nu se foloseste in acest stadiu datorita posibilelor efecte secundare in contact cu zonele rezecate. La tumorile cu risc intermediar, care necesita tratament instilational, instilatiile precoce reduc necesitatea terapiei de intretinere.
Instilatiile cu BCG. 6 instilatii saptamanale sunt necesare pentru raspuns imunologic. Se incepe la 14 zile dupa TURV. Tratamentul se continua cu cate 3 rapeluri saptamanale la 3,6,12,18,24,30,36 de luni. Chimioterapia poate fi eficienta in cazurile de esec dupa BCG si invers.
Date generale asupra unui lot de pacienti studiat
(Angelescu E.: "Tratamentul tumorilor vezicale superficiale stadiate T1", Teza de doctorat, 2003)
Pe parcursul a 7 ani (1993 - 2000), in Centrul de Chirurgie Urologica, Dializa si Transplant Renal din cadrul Institutului Clinic "Fundeni", au fost rezecati pentru tumori vezicale clinic superficiale un numar de 1328 de pacienti, din care, un numar de 646 pacienti au fost stadiati prin examen histopatologic in stadiul Ta si respectiv 682 pacienti in stadiul T1. Studiul de fata se refera 171 pacienti cu tumori vezicale stadiate T1. Perioada de urmarire a pacientilor a fost intre 3 ani si 11 ani de la rezectie.
Protocolul de urmarire a pacientilor rezecati pentru tumori vezicale superficiale cuprinsi in acest studiu a fost urmatorul:
din 3 in 3 luni in primul an.
din 6 in 6 luni in al doilea si al treilea an.
anual din al patrulea an si in continuare sau oricand la nevoie, in caz de reaparitie a hematuriei.
La 135 pacienti la care s-a efectuat tratament complementar, in 22,2% din cazuri (38 pacienti) aceasta a constat din chimioterapie intra-vezicala, iar in 57,3%, din cazuri (97 de pacienti), imunoterapie intra-vezicala.
Protocoalele tratamentului adjuvant
Chimioterapia intravezicala
La cei 38 de pacienti complementati prin chimioterapie intravezicala s-a utilizat clorhidrat de Epirubicina liofilizat 50 de mg in 40 ml de ser fiziologic. Solutia a fost introdusa intravezical, prin injectare pe cateter 10 sau 12 Ch, dupa golirea prealabila a continutului vezical si a fost pastrata intravezical timp de minim 2 ore.
Protocolul terapeutic a inclus 8 instilatii saptamanale ca doza de atac si 3 instilatii lunare ca doza de intretinere [39]. In acest fel, durata tratamentului s-a intins pe o perioada de aproximativ 6 luni.
Imunoterapia intravezicala
La cei 97 pacienti cu tratament complementar prin imunoterapie intravezicala, am utilizat imunostimulent BCG lichid produs de Institutul "I. Cantacuzino" din Bucuresti, flacoane care contin cate 37,5 mg masa bacteriana in 0,5 ml imunostimulent lichid. La fiecare instilatie intravezicala am utilizat cate 4 flacoane de suspensie reconstituita proaspat, adica 150 mg masa bacteriana diluata in 40 ml ser fiziologic. Intrucat un flacon de imunostimulent BCG lichid contine aproximativ 15 x 106 germeni/ml, la fiecare instilatie intravezicala am introdus circa 6 x 107 germeni/ml, prin injectare pe cateter 10 sau 12 Ch, dupa golirea prealabila a continutului vezicii urinare. Solutia a fost pastrata intravezical timp de minim 3 ore.
Protocolul terapeutic a inclus 6 instilatii saptamanale ca doza de atac urmate de 6 instilatii lunare ca doza de intretinere [39]. In acest fel, durata tratamentului s-a intins pe o perioada de aproape 8 luni.Imunoterapia a fost inceputa la 4 saptamani dupa ablatia transuretrala a tumorii pentru a permite cicatrizarea epiteliului endovezical la locul rezectiei si a scadea rata efectelor secundare locale.
Analiza cazurilor
Studiul a cuprins un numar de 171 de pacienti cu tumori vezicale stadiate T1 prin examen histopatologic, impartiti in trei loturi, lotul martor format din pacienti tratati numai prin rezectie endoscopica, lotul de pacienti care au primit tratament complementar cu clorhidrat de epirubicin si respectiv lotul de pacienti care au primit tratament complementar cu BCG, in instilatii intravezicale.

Figura 78. Repartitia tumorilor vezicale in functie de grading.
Evolutia pacientilor cu tumori stadiate T1G1
Din 72 de pacienti cu tumori vezicale stadiate T1G1, la 18 pacienti (25%) tratamentul a constat numai din ablatia transuretrala a tumorii, la 16 pacienti (22,2%) s-a instituit tratament adjuvant cu Epirubicina, iar la 38 de pacienti (52,8%), tratamentul adjuvant cu BCG.
Tabel nr.28. Evolutia ratei recidivelor la pacientii tumori vezicale stadiate T1G1.
|
Perioada de urmarire |
Lot martor |
Epirubicin |
BCG |
|
2 ani 9 ani |
Tabelul nr.29. Parametrii evolutivi ai pacientilor cu tumori stadiate T1G1 si care au dezvoltat recidiva tumorala sunt prezentati in tabelul urmator.
|
Parametru |
Lot martor |
Epirubicin |
BCG |
|
Timpul mediu de aparitie a recidivei |
26,3 luni |
60,3 luni |
37,4 luni |
|
Rata progresiei locale | |||
|
Rata regresiei locale | |||
|
Rata metastazarii | |||
|
Rata mortalitatii generale | |||
|
Rata mortalitatii specifice | |||
|
Living with tumor |
Evolutia pacientilor cu tumori stadiate T1G2
Din cei 81 de pacienti cu tumori vezicale stadiate T1G2, 12 pacienti (14,8%) au fost tratati prin ablatie tumorala simpla fara tratament complementar, 17 pacienti (21%) cu tratament adjuvant chimioterapic si 52 pacienti (64,2%) cu imunoterapie intravezicala.
Tabelul nr.30. Evolutia ratei recidivelor la pacientii tumori vezicale stadiate T1G2.
|
Perioada de urmarire |
Lot martor |
Epirubicin |
BCG |
|
2 ani 9 ani |
Din datele de mai sus observam ca si in cazul tumorilor vezicale stadiate T1G2 se pastreaza aceeasi tendinta evolutiva ca si in cazul tumorilor stadiate T1G1.
Tabelul nr.31.
|
Parametru |
Lot martor |
Epirubicin |
BCG |
|
Timpul mediu de aparitie a recidivei |
27,1 luni |
53,3 luni |
34,7 luni |
|
Rata progresiei locale | |||
|
Rata regresiei locale | |||
|
Rata metastazarii | |||
|
Rata mortalitatii generale | |||
|
Rata mortalitatii specifice | |||
|
Living with tumor |
Evolutia pacientilor cu tumori vezicale stadiate T1G3
Din cei 18 pacienti cu tumori vezicale stadiate T1G3, la 6 pacienti (33,3%) tratamentul a constat din ablatia simpla transuretrala a tumorii, 5 pacienti (27,8%) au urmat terapie adjuvanta cu Epirubicina si 7 pacienti (38,9%) au urmat tratament adjuvant cu BCG. Evolutia ratei recidivelor comparativ la 2 si la 9 ani de urmarire postoperatorie la cele 3 loturi de pacienti este prezentata in tabelul urmator.
Tabelul nr.32. Evolutia ratei recidivelor la pacientii tumori vezicale stadiate T1G3.
|
Perioada de urmarire |
Lot martor |
Epirubicin |
BCG |
|
2 ani 9 ani |
Tabelul nr.33.
|
Parametru |
Lot martor |
Epirubicin |
BCG |
|
Timpul mediu de aparitie a recidivei |
21,4 luni |
47 luni |
33,3 luni |
|
Rata progresiei locale | |||
|
Rata regresiei locale | |||
|
Rata metastazarii | |||
|
Rata mortalitatii generale | |||
|
Rata mortalitatii specifice | |||
|
Living with tumor |
Media intervalului de timp de aparitie a recidivelor urmeaza aceeasi evolutie ca si in cazurile precedente, fiind usor mai redusa.
|
Lot |
Nr. pacienti |
Nr. recidive |
Procent |
|
Martor Epirubicin BCG |
Din totalul de 171 pacienti cuprinsi in acest studiu, 102 pacienti (59,6%) au avut evolutie favorabila si au ramas free of tumor, iar 69 de pacienti (40,4%) au dezvoltat recidive la 9 ani de urmarire postoperatorie. Dintre acestea, 43 de recidive (62,3%) au respectat stadiul tumorii initiale si 13 recidive (18,8%) au progresat.
Evolutia ratei recidivelor in functie de numarul de tumori rezecate
Tabelul nr.35. Evolutia recidivelor tumorale in functie de numarul de tumori rezecate la fiecare lot in parte.
|
Numar tumori |
Lot martor |
Epirubicin |
BCG |
|
peste 2 |
Tabelul nr.36. Evolutia recidivelor tumorale in functie de numarul de tumori rezecate pentru fiecare grading in parte.
|
Numar tumori |
G1 |
G2 |
G3 |
|
peste 2 |
|
|
Figura 79. Reactii secundare
la tratamentul intravezical
cu BCG.
In perioada 2002-2005 au fost tratati 109 pacienti cu tumori vezicale superficiale [61]. Dintre acestia am incadrat in grupa pacientilor cu risc major 37 de pacienti 10 pacienti cu pTa si 27 de pacienti in pT1. Criteriile de incadrare in aceasta grupa au fost urmatoarele: multiplicitatea tumorala la prima prezentare, tumorile voluminoase, grading-ul tumoral mare (G3), Tis asociat, recidiva la 3 luni de la TURV, frecventa mare a recidivelor si afectarea in timp a aparatului urinar superior asociata cu recidivele tumorale vezicale.
Dupa efectuarea rezectiei tumorii vezicale in primele 6 ore am administrat o instilatie de 50 mg de Farmarubicina, pe care am mentinut-o in vezica urinara cca 2 ore. Tratamentul cu BCG a debutat la cca 14 zile postoperator. Am utilizat instilarea a 150 mg de BCG in 50 ml de ser saptamanal, cca 8 instilatii. La 3 luni am reevaluat cistoscopic si citologic pacientul. In caz de recidiva am rezecat recidiva tumorala si am aplicat o noua cura de BCG. In cazurile in care pacientul avea un prognostic evolutiv rezervat, am introdus terapia de mentinere (3x1 instilatii saptamanale la 3,6,12,18,24,30,36 saptamani postoperator).
Rezultate
La cei 10 pacienti cu pTa media de urmarire a fost de 44 de luni.
1 pacienta nu a beneficiat de instilatiile cu BCG, continuand recidivele tumorale.
3 pacienti cu un ciclu de 8 instilatii cu BCG , pe o perioada medie de 29 de luni au avut la 1 singur pacient 2 recidive, ceea ce reprezinta 1 recidiva la 43 de luni (recurenta de 0,09/an).
Cei 3 pacienti cu terapie de intretinere au avut o rata de 2 recidive la 163 de luni (1 recidiva la 81,5 luni - recurenta de 0,05/an).
1 pacienta cu progresie tumorala a beneficiat de cistectomie si este in viata la 24 de luni post-operator.
2 pacienti au decedat la 41 respectiv 30 de luni prin progresie tumorala (nu au acceptat interventia chirurgicala).
In grupul celor 27 de pacienti cu T1: 7 au fost G1, 16 G2, 4 G3.
3 pacienti au iesit din studiu datorita unor complicatii secundare BCG-ului (vasculita sistemica, artrita, respectiv prostatita).
1 pacient a fost pierdut din evidenta.
12 pacienti cu o perioada medie de urmarire de 15,2 luni sunt fara recidiva. Din acest lot 2 pacienti au decedat din cauze non-oncologice.
11 pacienti dezvoltat 25 de recidive (1 recidiva la 24 de luni)
Tratamentul intravezical - Concluzii
Datorita faptului ca tumorile superficiale bine si moderat diferentiate au o recurenta de cca. 50% dupa rezectia endoscopica si ca in foarte putine cazuri evolueaza spre un stadiu mai agresiv, pare sa aiba sens terapia intravezicala care scade rata recurentelor, scutind bolnavul de riscurile unei noi interventii endoscopice. Alternativ, datorita riscului de evolutie spre tumori de grad inalt de malignitate in cazul tumorilor T1 sau Tis se indica, imediat dupa rezectia chirurgicala, terapia intravezicala. Cum BCG-ul a fost demonstrat ca intarzie progresiunea tumorala, este primul agent cu care se incepe.
O tumora Ta-1 G1 sub 3 cm papilara nu necesita tratament adjuvant.
Tumorile cu risc crescut: recidive multiple Ta-1,G1-2 vor fi tratate 4-8 saptamani cu instilatii vezicale saptaminale. Se vor intrerupe daca efectele secundare o impun.
Chimioterapia de mentinere: este indicata la tumorile cu rata mare de recidiva sau cu risc de progresie, sub forma de instilatii lunare, nu mai mult de 6 luni peste aceasta durata nu se constata o inbunatatire a rezultatelor.
Tratamentul recidivelor
Se incepe cu schema initiala. In cazurile cu recidive multiple sau risc mare se trece pe BCG. Chimioterapia instilationala intravezicala se face cu Mitomycin C, Epirubicin sau Adriamicin. Nu s-a constatat nici o diferenta intre ele. Se dizolva in 30-50 ml de ser fiziologic, care se mentin in vezica 1-2 ore. Dozele sunt urmatoarele: Mitomycin C 220-40mg, Epirubicin 50-80mg, Adriamicin 50 mg.
Tratamentul oral
Este aproape inexistent. S-au raportat unele rezultate pe cazuistici mici. In marea majoritate a cazurilor, rezultatele tratamentului oral nu au fost diferite semnificativ statistic fata de placebo.
S-a incercat terapia profilactica orala cu Metotrexat in doze de 50 mg/saptamana timp de 18 saptamani pentru tumorile vezicale superficiale multiple dar, desi rezultatele pe un numar mic de pacienti au fost incurajatoare, nu s-a continuat cercetarea [103].
Se cunoaste ca Vitamina A si derivatii sai, retinoizii, au efect antiproliferativ si pot induce diferentierea celulara. Etretinatul, un retinoid obtinut sintetic, are cel mai puternic efect.
Studer si colab. au oservat ca la pacientii tratati oral cu Etretinat retinoid, intervalul de timp al aparitiei recidivelor tumorale vezicale a fost semnificativ mai lung decat la cei tratati cu placebo (20 luni fata de 12 luni), sugerand ca uroteliul netransformat neoplazic poate fi protejat cu Etretinat de transformarea in tumori papilare. Efectele secundare ale Etretinatului (cheilita, uscaciunea mucoaselor si tegumentelor) au fost acceptate de toti pacientii. Dar datorita riscului crescut de hiperlipidemie si al aparitiei bolilor coronariene, trebuie sa se tina cont de posibilitatea producerii de infarct miocardic datorat in mod direct tratamentului cu Etretinat.
Vitamina B6 (Piridoxina) scade nivelul de ortoaminofenoli excretati in urina. Intr-un studiu al EORTC GU Group nu s-a observat o diferenta semnificativa intre pacientii tratati cu Piridoxina si placebo [103].
Lactobacillus casei a fost studiat mai intai pe animalele de laborator unde a aratat unele efecte antitumorale, ca de exemplu supresia cancerului urotelial indus chimic.
Aso si colab. [citat de 103] au raportat un studiu pe 58 de pacienti cu cancer urotelial superficial, tratati cu pudra de Lactobacillus casei administrata in doza de 1 g de 3 ori pe zi timp de 1 an de zile sau pana la aparitia recidivei. Rezultatele lor au aratat ca la 50% din pacienti, intervalul liber pana la aparitia recidivei dupa TUR-V a crescut de 1,8 ori.
Poly I:C este un stimulator al Interferonului endogen atat in vitro cat si in vivo. Administrarea lui se face intravenos. Poly I:C este un complex format din acid poliinozinic si acid policitidilic. Un studiu al lui Kemeny pe un lot mic de pacienti nu a aratat o diferenta semnificativa in rata aparitiei recidivelor tumorale la cei tratati cu Poly I:C fata de lotul martor, insa a crescut semnificativ rata supravietuirii la 4 ani [citat de 103].
Bropirimina (5-bromo-2,3-dihidro-2-imino-6-fenil-4-pirimidinona) este un stimulator al Interferonului endogen [1]. Bropirimina se administreaza pe cale orala si are efect antitumoral atat prin activarea celulelor natural killer si a macrofagelor, cat si prin inhibarea directa a cresterii tumorale.
Akaza si colab. au administrat comprimate de 750 mg de bropirimina, de 3 ori pe zi la 2 ore interval, 3 zile consecutiv pe saptamana, timp de 12 saptamani, la pacienti rezecati endoscopic, dar cu tumora marker lasata pe loc. Rata de raspuns pozitiv a fost de 31,3%, insemnand disparitia tumorii marker in totalitate sau reducerea ei cu peste 50%. Efecte secundare au aparut in 70,6% din cazuri (cefalee, febra, malaise, simptome digestive), insa bine tolerate [2].
Incercand sa repete acelasi studiu, Sarosdy si colab. nu au obtinut remisie completa a tumorii marker in nici unul din cazuri [citat de 103].
1.4. Supravegherea pacientilor dupa TUR pentru TVS
(dupa protocolul EAU)
Cistoscopia
Este investigatia de baza pentru urmarirea pacientilor dupa TUR, cistoscopul flexibil fiind mai usor de suportat.
Prima cistoscopie se face la 3 luni in toate cazurile.
In cazurile cu T1G2-3 s-a constatat ca in 35% din cazuri, biopsiile sunt pozitive la 4-6 saptamani dupa TURV. La aceasta categorie de bolnavi se recomanda o rezectie secundara in acest interval.
Cistoscopiile ulterioare sunt adaptate factorilor de prognostic enumerati. In toate studiile rata recidivelor este mai mare in primii 2 ani.
La pacientii cu tumori cu risc mic (tumora unica, primara, TaG1 sub 3 cm) fara recidiva la 3 luni o noua cistoscopie se face 9 luni mai tarziu, apoi anual pe o periada de 5 ani, datorita ratei reduse de recidiva. In cazul in care apar recidive, in 95% din cazuri, au aceiasi histologie cu tumora primara.
In grupul cu risc mare, se face o cistoscopie la fiecare 3 luni in primii 2 ani, apoi la 4 luni in al 3-lea an, la 6 luni pana la 5 ani, apoi anual.
Grupul cu risc intermediar se evalueaza cistoscopic in functie de factorii de prognostic.
Cat timp se vor efectua cistoscopiile?
Recidivele pot aparea la 10-12 ani de supraveghere. Pacientii cu recidive regulate vor fi supravegheati toata viata sau pana la cistectomie.
Pacientii cu recidive in primii 4 ani vor avea recidive toata viata.
Din datele cunoscute la o tumora pTa G1 se opreste supravegherea la 5 ani. In toate celelalte cazuri se supravegheaza anual 10 ani, iar la cei cu risc mare toata viata.
Ecografia
Desi poate detecta tumori de cativa milimetri, valoarea sa, comparativ cu cistoscopia nu este suficient stabilita.
Citologia
Omite depistarea celulelor cu G mic. Depisteaza celulele cu G mare, fiind utila in depistarea Cis-ului. Valoarea altor markeri in urmarirea TVS nu a fost stabilita.
Urografia
Se foloseste in cazurile cu Cis cu citologie pozitiva in perioada de urmarire.
Biopsiile randomizate ale mucoasei aparent normale in caz de recidive
Utilitatea lor este chestionabila,putand provoca locuri de implantare pentru celulele neoplazice.
Se vor recolta biopsii din uroteliul modificat.
Pacientii cu citologie pozitiva dar mucoasa normala necesita biopsii randomizate pentru depistarea Cis. In acest caz se va biopsia (TUR) uretra prostatica.
In Cis vezicii urinare biopsia prostatica ramane obligatorie.

Figura 80. Supravegherea tumorii vezicale superficiale cu risc scazut (dupa AFU

Figura 81. Tumori vezicale superficiale cu risc intermediar (dupa AFU)[48].
Figura 82. Tumori vezicale superficiale cu risc inalt
(dupa AFU)[48].

Figura 83. Afectarea asociata a prostatei.

Figura 84. Afectarea asociata a tractului urinar superior.
1.5. Forme particulare de cancere vezicale superficiale
I. Carcinomul in situ al vezicii urinare
Carcinomul in situ (Cis) este o entitate histopatologica, indicand o leziune plata, rosietica, a mucoasei vezicale. Initial a fost descrisa de Bowen in 1912, la nivelul glandului penian, apoi de Broders [20] in 1934 la nivelul colului uterin si vaginului. In 1952, Melicow [151] descrie Cis la nivelul mucoasei vezicale, sugerand caracterul preneoplazic si cauzal al recurentei cancerului vezical.
Poate fi multifocal, interesand:v ezica urinara, bazinetul si ureterul, respectiv uretra.
Studii efectuate pe muncitori din industria chimica cu expunere la para-amino-difenil au aratat ca Cis este un precursor al tumorilor solide sau papilareale carcinomului tranzitional. De multe ori, celulele maligne pot fi detectate in urina acestor bolnavi, inainte de vizualizarea cistoscopica a tumorii vezicale. Endoscopic poate fi focal sau difuz (multifocal), solitar (primitiv) sau asociat (secundar) cu displazie sau tumori vezicale.
Clinica
Circa 20% dintre pacientii cu carcinom tranzitional al vezicii urinare au tumori invazive la prima prezentare. Unii prezinta simptomatologie, altii sunt asimptomatici, indicand faptul ca Cis poate evolua rapid in cancer infiltrativ. De multe ori Cis este secundar, fiind diagnosticat in acelasi timp cu o tumora vezicala, in cursul unei rezectii transuretrale.
Farrow [39], investigand 35000 de pacienti, cu citologie urinara, in 65 de cazuri a gasit Cis documentat prin biopsie, toti acesti pacienti prezentand simptome de iritabilitate vezicala.
S-a sugerat urmatoarea clasificare pentru Cis:
Primare: pacienti fara tumora vezicala in antecedente
Secundare: ce se impart in concomitente (asociate unor tumor mari) sau subsecvente (cu tumori vezicale in antecedente).
Evolutia naturala a Cis-ului este greu predictibila. Weinstein [258] arata ca Cis este "pato-biologia paradoxului", deoarece suprafete mici pot fi sursa unui cancer vezical rapid invaziv, pe cand arii largi pot avea o evolutie indelungata, benigna.
Evolutia clinica
I. Expunerea la carcinogene. Pe un studiu efectuat pe o perioada semnificativa, 500 de muncitori ce lucreaza in industrie sunt prezentati in cadrul unui studiu (Koss) [109]. 20 au avut citologie pozitiva cu cistoscopie initial normala, dezvoltand in timp tumori vezicale. 7 cazuri au avut citologie normala care s-a pozitivat intre 6-96 de luni. Toti cei 20 de pacienti au dezvoltat leziuni vizibile cistoscopic, care la biopsie s-au dovedit Cis in 6-77 de luni.
II. Istoria naturala. Un studiu prospectiv pe 31 de pacienti (Jakse) [97] cu Cis (5 primar, 26 secundar) au fost urmariti 14 ani. Dupa o perioada medie de 64 de luni, 16 pacienti (51%) au evoluat spre T2 sau mai mult, 12 pacienti (39%) au avut tumori Ta, T1 recidivate si numai 3 pacienti (10%) nu au recidivat. Dupa o perioada de inca 24 de luni doar 4 pacienti erau fara progresie tumorala.
III. Urmarire post-TURV. La pacientii cu cancer vezical simptomatic, cu biopsie randomizata la TUR sau care au fost urmariti prin citologie s-a aratat ca procentul pacientilor cu Cis creste cu grading-ul tumoral (Vicente J) [252]. Este putin probabil ca Cis sa apara la pacientii cu G1, dar apare la un procent de 5% la cei cu G3. Procentul pacientilor cu tumora vezicala si Cis nu reiese clar din datele publicate. Tumorile T1G3 cu Cis asociat au evolutie net diferita de cei fara Cis (65% progresie spre tumora vezicala infiltrativa cei cu Cis,10% cei fara Cis) [23], ambele grupuri de pacienti fiind tratati cu chimio- sau /si imunoterapie locala.
Factorii de prognostic
Problema pacientului cu Cis este persistenta tumorala dupa tratamentul intravezical sau recurenta cu progresia tumorala. Problema clinicianului este sa decida asupra eficientei tratamentului intravezical sau cistectomiei.
In acest scop evaluarea initiala a vezicii urinare trebuie sa fie cat mai completa si corecta:
1. Evidentierea dimensiunilor, multiplicitatii si a tumorilor asociate Cis.
2. Citologia urinara exfoliativa este esentiala in diagnosticul initial si in urmarirea
pacientilor.
3. Controlarea repetata a uroteliului.
4. Tratament corect si supraveghere.
Tratamentul Cis
Tratamentul Cis localizat vezical este influentat de tumorile vezicale din antecedente sau concomitente. Trebuie luate in consideratie urmatoarele elemente:
1. Cis este o afectiune pan-uroteliala, evolutia sa naturala fiind imprevizibila.
2. Extensia leziunilor este foarte importanta si trebuie evaluata endoscopic si bioptic (biopsii multiple). Adeseori severitatea simptomelor reflecta extensia leziunilor.
3. Cis asociat tumorilor papilare sau solide au un prognostic foarte sever, coagularea-rezectia transuretrala nu este suficienta; evolutia naturala este semnificativ perturbata de tratamentul intravezical.
4. Pacientii vor fi informati de riscul progresiei tumorii, in situatia in care vor alege solutia de prezervare a vezicii urinare, se impune necesitatea supravegherii toata viata. De asemenea, pacientii vor fi avertizati asupra posibilitatii cistectomiei intr-un stadiu evolutiv urmator.
In trecut simpla fulguratie era recomandata pentru tratamentul Cis asimptomati. (Riddle) [192], (Herr) [78]. Wolf [264] arata ca cei mai multi dintre pacientii tratati astfel au evoluat spre tumori vezicale infiltrative. Introducerea tratamentului instilational adjuvant a dus la ameliorarea prognosticului.
Rezectia transuretrala
Examinarea pieselor de cistectomie la pacientii cu Cis simptomatic a aratat ca in 70 % din cazuri mai mult de 1/3 din mucoasa vezicala este invadata, iar in 43 % mai mult de din mucoasa vezicii urinare prezenta Cis. 57% dintre pacienti aveau invazie de ureter distal, 62% invazie de uretra.
24 din 70 de pacienti aveau invazie focala sau multifocala (Koss)[109], (Farrow)[39].
Cis trebuie detectat cand este mic si unifocal. Aceste leziuni pot fi controlate prin fulguratie sau TUR dar recurenta tumorala are un procentaj semnificativ si in cazul leziunilor cu grad mare este inevitabila. Presupunand ca citologia urinara este negativa dupa TUR, urmarirea adecvata si tratamentul instilational se impun.
Cistectomia
Circa 30% dintre pacienti ajung la cistectomie initiala sau tardiva, prin progresia bolii. Cistectomia include extirparea ureterelor distale si uretrei.
Ureterele se sectioneaza la incrucisarea cu vasele iliace, cu recupa pentru excluderea prin biopsie extemporanee a Cis la acest nivel.
Limfadenectomia extensiva este indicata doar in caz de tumora vezicala infiltrativa sau invazia prostatei; in caz de Cis se indeparteaza doar ganglionii din fosa obturatorie.
Uretra se indeparteaza in totalitate (in bloc cu intreaga piesa), 40% dintre pacienti dezvoltand cancer uretral in urmatorii 10 ani.
O uretrectomie secundara va fi dificila tehnic si posibil incompleta in indepartarea bontului proximal.
Tumora extravezicala
Intr-o proportie semnificativa, pacientii cu Cis al uroteliului vezicii urinare au invazie de uretra prostatica, ducte prostatice, sau chiar stroma prostatica.
Bretton [18] prezinta o statistica pe 23 de pacienti cu Cis in uretra prostatica, tratati prin TUR si BCG. Progresia tumorala s-a inregistrat la 44% dintre pacienti (Herr)[78]. Se sugereaza ca cistectomia radicala ar constitui tratamentul adecvat al acestor pacienti, mai ales ca dintre ei au ureterul distal invadat, acesta nefiind influentat de tratamentul cu TUR si BCG. Leziunile ureterului distal pot fi tratate prin rezectie, ureterocistoneostomie si BCG adminisrat anterograd (prin nefrostomie percutanata) sau retrograd.
Evaluarea raspunsului la tratament si supravegherea
Se face prin citologie exfoliativa (mictionala sau prin lavaj), cistoscopie si biopsii repetate.
Daca citologia este pozitiva si leziunile vezicale negative, se recolteaza pentru citologie urina din uretere. Urografia se face la 6 luni (30 % dintre pacienti dezvolta leziuni de ureter distal).
O atentie deosebita se acorda uretrei prostatice, 10-40% din pacienti avand leziuni la acest nivel.
Tratamentul intravezical
Tiotepa a fost utilizata pe 89 de pacienti cu raspuns complet de 20-55%. Prout [187] pe 40 de pacienti urmariti in medie 27 de luni (6-24), in 53% din cazuri s-a dezvoltat invazie musculara, metastaze, extensie la prostata. 15% dintre pacienti sunt bine la 5 ani.
Doxorubicina a fost studiata pe 212 pacienti cu remisiune completa intre 0-88% la 48%.
SWOG: remisiune completa 23/67-34%. Disease free 18%.
Mitomicina: 16 serii - 196 pacienti. Remisiune completa: 104 pacienti (53%).
Imunoterapia: 41 de serii - 1496 pacienti. Remisiune completa: 72%, cu o medie de urmarire de 39 luni. SWOG: 64 de pacienti cu Cis, 45% sunt disease free la 5 ani. 6 instilatii saptamanale cu 120 mg , 3saptamanale la 3 luni (14%) apoi la 6 luni 3 ani (27 de instilatii in total). La 5 ani: disease free 75%. 10% au N+ sau M+ la diagnostic.
II. Carcinomul prostatic cu celule tranzitionale (TCC-P)
Carcinomul tranzitional al prostatei TCC-P) poate fi o tumora primara a prostatei (2%) sau este asociat cu cancerul vezicii urinare (concomitent - 43%) sau in cursul supravegherii pacientulului.
Pacientii cu Cis vezical, cu interesare predominenta a colului vezical, ureterelor, esecuri de tratament intravezical au o incidenta crescuta a TCC-P.
Anatomo-patologic sunt tesuturi slab, mediu, sau bine diferentiate ce pot interesa mucoasa uretrei prostatice (Ta,Tis) sau se pot extinde de-a lungul ductelor prostatice sau acinilor, extensia fiind inca limitata de membrana bazala. Invazia stromala poate apare ca urmare a progresiei Cis sau prin extensia directa a unei tumori vezicale la prostata. Aceste caractere anatomo-patologice implica prognostic si tratamente diferite.
Caile de propagare spre prostata a unui carcinom tranzitional (dupa Donat M)[34](fig.85):
A. Invazia mucoasei uretrei prostatice, extensia tumorii prin ductele prostatice la stroma
B. Extensia tumorii extravezical (pT3b) si inapoi la stroma prostatica
C. Extensia unei tumori intravezicale (pT2 cel putin) direct in stroma prostatica prin
lamina proprie a colului vezical

a. b.

c.
Figura 85.a-c. Caile de propagare spre prostata a unui carcinom tranzitional (dupa Donat M)[34].
Supravietuirea la 5 ani va fi de 100% in cazul pacientilor cu invazia mucoasei, 40% la pacientii cu invazie ductala si acinara, 20% in caz de invadare stromala (Pagano)[173].
Diagnostic
Pacientii pot fi asimptomatici, pot prezenta hematurie, mai ales cei cu tumori papilare.
Tumorile avansate produc simptome obstructive si pot fi confundate, la tactul rectal, cu cancerul de prostata (rezectia transuretrala permitand punerea diagnosticului).
Biopsiile la rece, punctia bioptica a prostatei, ecografia transrectala sunt inferioare TUR-lui bioptic care se recomanda a fie efectuat la orele 5 si 7 paracolicular (Sakamoto)[199].
Indicatiile biopsierii transuretrale a uretrei prostatice (Mark Soloway):
1. mucoasa modificata la inspectia vizuala
2. prezenta unor tumori cu G mare
3. citologie pozitiva in absenta unei tumori vezicale vizibile.
Tratament
Invazia stromei prostatice de catre carcinomul tranzitional are indicatie de cistoprostatectomie; la fel se procedeaza in cazurile cand o tumora vezicala se extinde in prostata.
Prezenta sau absenta TCC-P in cancerele vezicale influenteaza tipul derivatiei urinare, impunandu-se uretrectomia. 30% dintre pacientii cu TCC-P vor dezvolta tumori uretrale dupa cistectomie. Acest lucru nu se va intampla in cazurile cu invazie localizata strict la mucoasa uretrei prostatice. Radioterapia nu este eficienta in TCC-P [184].
Bretton [18] a practicat transuretrorezectia uretrei prostatice urmata de BCG pentru 23 de cazuri cu Cis:
44% dintre pacienti au dezvoltat recidiva tumorala vezicala sau metastaze
nici unul dintre pacienti nu a avut recidiva in loja prostatica
rata cistectomiei a fost de 30%.
Scellhammer [207] prezinta un lot de 17 pacienti cu Cis prostatic carora li s-a practicat TUR-P + instilatii cu BCG. 11 dintre pacienti aveau si Cis vezical. Dupa o perioada de urmarire de 64 de luni 5 dintre pacienti (29%) au prezentat progresie tumorala si 7 pacienti au necesitat cistectomie. Rata raspunsului a fost de 70%.
Bassi si Pagano [173] prezinta un lot de 27 de pacienti cu TCC-P dintre care 20 au avut in antecedente tumori vezicale superficiale, iar 7 au avut tumori vezicale simultane. In momentul diagnosticarii TCC-P 17 (63%) aveau tumori papilare, 10 (37%) aveau Cis.12 pacienti aveau G2, iar 14 aveau G3. S-a practicat rezectia transuretrala a tumori lor +instilatii cu BCG 6 saptamani; in cazurile cu recidiva, dar fara progresie tumorala, s-a practicat o noua serie de instilatii de 6 saptamani.
Perioada de urmarire a fost in medie de 33 luni. Evaluarea cazurilor s-a facut din 6 in 6 luni cu citologie mictionala si de lavaj, cistoscopie, biopsii din mucoasa vezicala modificata sau normala precum si din uretra prostatica. 21 de pacienti (78%) au avut un raspuns local. Persistenta TCC s-a demonstrat la 11% pacienti, progresia locala in 3 cazuri (11%). 5 pacienti (19%) care initial au raspuns la tratament au dezvoltat in tmp recidive, dar fara progresie locala.
Concluzii:
instilatiile cu BCG sunt eficiente in tratamentul TCC-P.
in caz de invazie stromala a prostatei se practica cistectomie.
efectele secundare ale BCG-ului sunt cele cunoscute.
urmarirea pacientilor este foarte importanta.
III. Tumori situate la nivelul orificiului ureteral
Sunt tratate similar tumorilor situate in alte portiuni ale vezicii urinare. Rezectia orificiului ureteral nu duce la strictura, dar poate duce la reflux vezico-ureteral. Utilizarea coagularii trebuie sa fie minima si strict pe punctele de sangerare. Sunt autori care recomanda inserarea unui stent ureteral.
La o luna post-operator se va face o evaluare a aparatului urinar superior (ecografie, urografie, tomografie) pentru a detecta o posibila obstructie.
IV. Tumora in diverticul vezical
Peretele diverticulului vezical dobandit este foarte subtire, tumora ajungand foarte repede in T3. Pe de alta parte la rezectia endoscopica exista riscul perforatiei. Aceste tumori se trateaza prin cistectomie partiala sau totala.
Tumora uroteliala in diverticul vezical
Diverticulul vezical se dezvolta ca o "herniere" a mucoasei vezicale printre fibrele musculare netede ale peretelui vezical. Peretele diverticular nu contine muschi, mucoasa este in contact cu grasimea perivezicala, acesta particularitate anatomica explicand profilul evolutiv diferit al tumorilor intra-diverticulare; exista doar tumori pTa si infiltrative.
I. Epidemiologie
Incidenta tumorilor intra-diverticualare este cuprinsa intre 0,8 si 13,5%,cel mai frecvent la barbati intre 60-70 de ani. Marea majoritate a tumorilor se dezvolta in diverticuli dobanditi (secundare unui obstacol sub-vezical), fiind mult mai rare intr-un diverticul congenital. Pe un studiu efectuat in 1986 [246] pe un lot de 146 de pacienti cu diverticuli vezicali urmariti pe o perioada de 15 ani, s-au gasit 9 pacienti cu tumori vezicale asociate: 3 intra-diverticulare, 3 la nivelul coletului diverticular, 3 la distanta de diverticul. Dintre factorii etiologici, riscul major este constituit de staza urinara si de inflamatia cronica a mucoasei vezicale, ca sursa de displazie si de transformare maligna.
II. Anatomie patologica
Majoritatea tumorilor intra-diverticulare sunt tumori epiteliale: carcinoame cu celule tranzitionale, frecvent de gradul 2si 3. Mult mai rar pot fi carcinoame epidermoide, adenocarcinoame, carcinosarcoame sau tumori non-epiteliale.
III. Diagnostic
Simptomul revelator este sau hematuria (60-100% din cazuri) sau obstacolul subvezical.
Diagnosticul poate fi dificil si tardiv:
pe urografie se poate evidentia o lacuna in diverticul in 50% din cazuri; erorile de interpretare se pot datora:
a) leziunea tumorala poate obstrua coletul diverticular si produce lipsa de
opacifiere a diverticulului
b) un adenom de prostata voluminos poate masca un diverticul.
ecografia poate evidentia o tumora voluminoasa intr-un diverticul sau descrie o masa latero-vezicala.
cistoscopia reprezinta examenul de baza pentru diagnostic.
Alte examinari: citologia urinara - pozitiva la tumorile de grad inalt; tomografia computerizata si RMN-ul permit un bilant de extensie tumorala, in special asupra extensiei in grasimea perivezicala.
IV. TURV-ul initial
Prezinta probleme tehnice:
depasirea coletului necesita incizarea acestuia.
orientarea diverticulului poate sa nu permita vizualizarea corecta a implantarii tumorale.
absenta fibrelor musculare expun la riscul de perforatie vezicala.
Din aceste motive unii autori recomanda o simpla biopsiere, la rece, a tumorii.
V. Tratament
Cu exceptia tumorii pTa de grad jos, complet rezecabil, celelalte tumori intra-diverticulare sunt considerate infiltrative si tratate ca atare.
1. Cistectomia radicala este tratamentul de referinta
Prognosticul tumorilor este defavorabil prin extensia extravezicala: >/pT3. Supravietuirea este de 45% la un an, 20% la 3 ani, 15% la 4 ani. Riscul recidivei locale este crescut prin extensia loco-regionala. Se recomanda asocierea la cistectomie a radio-terapiei pre-operatorii si chimioterapiei adjuvante.
2. Alternative terapeutice
a) TURV + chimioterapie intravezicala: aceasta asociere este suficienta in cazul tumorilor pTa cu grading mic.
b) Cistectomia partiala: aceasta atitudine este contraindicata in cazurile de tumori multifocale, sau cu Cis asociat, care pot duce la persistenta tumorala in cazurile cu margini pozitive.
c) Asocierea radio-chimioterapie are rezultate incerte.
Protocolul de tratament al TVS
al Asociatiei Romane de Urologie (publicat in Revista Romana de Urologie nr. 3-4,1999):
1. TURV
2. Cistectomie partiala
3. Cistectomie radicala + derivatie urinara
4. Pelvectomie anterioara
6. Electrorezectie transvezicala
7. Cistectomie paleativa.
2. Cancerul vezical invadant in musculara si/sau cu extensie regionala T2-4 No-2
2.1. Tratamentul
Cistectomia radicala este tratamentul de electie, 'standardul de aur' in tratamentul cancerului vezical invaziv. In SUAm radioterapia este de asemenea folosita. Cistectomia radicala consta in indepartarea in bloc a vezicii, prostatei, veziculelor seminale si ganglionilor limfatici pelvini la barbat. La femeie, indepartarea vezicii, uretrei, uterului, cervixului, trompelor, ovarelor, peretelui anterior al vaginului superior si ganglionilor limfatici pelvini (exenteratia pelvina anterioara, pelvectomia anterioara).
Ratele de supravietuire la 5 si la 10 ani scad cu cresterea stadiului T, cu o rata de vindecare generala de 50% pentru tumora adanc invaziva. Supravietuirea la 5 ani pentru bolnavii cu cancer vezical pT2a, pT3a poate fi de pana la 80%, scazand la 30-50% la bolnavii cu pT3b-pT4.
Un procent de 10-35% din bolnavii cu cancer limitat la ganglionii regionali pot supravietui 5 ani dupa cistectomie radicala si limfadenectomie. La bolnavii cu ganglioni pozitivi, supravietuirea este semnificativ mai mare la 5 ani daca tumora primara este limitata la vezica (50% pentru pT1, pT2, pT3aN+, in comparatie cu 18% pentru bolnavii cu pT3b, pT4N+).
Au avut loc imbunatatiri substantiale in tehnicile chirurgicale, cu o scadere a mortalitatii si posibilitati crescute de substitutie a vezicii dupa cistectomia radicala. Substitutiile vezicale ortotopice au crescut in popularitate si multi urologi prefera sa realizeze cistectomia si o derivatie urinara continenta.
Aceasta se traduce intr-o mai buna calitate a vietii. Desi substitutia vezicala ortotopica a fost initial proiectata pentru barbati, ea a fost extinsa si la femei.
Cistectomia partiala, ca tratament initial pentru cancerul vezical invaziv nu este de obicei recomandata. In unele studii supravietuirea se apropie de cea obtinuta prin tratament chirurgical radical. Rezultatele sunt dependente in mare masura de selectia bolnavilor. Totusi, in alte studii (Resnick si O'Connor, 1973, Brosman 1978), rate de recidiva de peste 70% sunt raportate, in special pentru tumorile de grad inalt. Avantajul major este ca vezica urinara este pastrata. Cistectomia partiala poate fi folosita dupa chimioterapie neoadjuvanta.
Candidatii la cistectomie partiala dupa chimioterapie neoadjuvanta sunt reprezentati de:
a). pacientii care au obtinut un raspuns clinic complet sau un raspuns clinic partial
semnificativ la chimioterapia neoadjuvanta.
b). pacioientii cu leziuni solitare in regiuni anatomice favorabile.
c). pacientii care nu au un istoric de cancer vezical infiltrativ anterior sau recidivat.
d). pacientii care nu au CIS.
e). pacientii care au o buna capacitate vezicala.
Cativa cercetatori au aratat ca cistectomia partiala poate fi realizata la bolnavii cu leziuni initiale monofocale care raspund la chimioterapie neoadjuvanta la restadierea prin TURV. Bolnavi potriviti sunt si cei cu tumori T3 mici. O astfel de abordare pare a oferi un control local echivalent cu cel obtinut prin cistectomie radicala. Chimioterapia neoadjuvanta si cistectomia partiala necesita o urmarire mai indelungata inainte de a trage o concluzie sigura cu privire la eficacitatea acesteia. Pentru bolnav, prezervarea vezicii inseamna o interventie mai mica, lipsa unei derivatii urinare si o viata sexuala normala.
TURV unica. Cateva studii pilot (Herr, 1987; Solsona, 1992) arata ca bolnavi selectionati cu cancer vezical invadat in musculara (T2 mici, bine diferentiate) pot fi vindecati prin combinarea unei rezectii endoscopice si chimioterapiei sistemice, fara cistectomie sau radioterapie. In aceste serii, bolnavii sunt selectati pentru prezervarea vezicii daca demonstreaza un raspuns complet sau scaderea stadiului pana la tumora superficia dupa M-VAC neoadjuvanta. Dintre 41 de bolnavi care au primit chimioterapie si TURV, rata de supravietuire la 5 ani a fost de 71%. Prezervarea vezicii ramane un aspect controversat, in timp ce cistectomia radicala ramane "standardul de aur" in tratamentul cancerului vezical infiltrant in musculara. Pastrarea vezicii la bolnavii selectati pe baza raspunsului la chimioterapie este o abordare posibila care trebuie confirmata prin studii prospective randomizate.
Radioterapia (dupa Ghidul EAU, 2002)
Radioterapia definitiva, cu intentie curativa, cu prezervarea vezicii urinare se efectueaza in carcinoamele vezicale cu celule tranzitionale T1-4N0M0. Nu exista studii randomizate cu semnificatie statistica intre radioterapia externa beam si cistectomie. Decizia in favoarea sau impotriva radioterapiei se bazeaza pe factorii de prognostic, solicitarea pacientului si preferinta medicului. Pacientii trebuie sa aiba capacitate vezicala buna, functie vezicala normala, fara infectie urinara, fara fenomene inflamatorii sau interventii chirurgicale cu aderente la nivelul pelvisului.
Radioterapia externa beam
Se efectueaza 30-40 de sedinte a 68 de Gy [4,5]. Multiple fractiuni/zi par sa dea rezultate favorabile. Asocierea cu cisplatinol duce la o rata de control de 80% in tumorile T2-3.
Brahiterapia
La pacienti selectionati, cu tumori unice sub 5 cm dupa administrare de iridium tantal sau caesium prin expunerea vezicii prin cistostomie se obtin rezultate in 80% din tumorile T2-3, rata recidivelor fiind de 30%.
Complicatii. Majoritatea pacientilor iradiati dezvolta enterite, proctite, cistite radice. Tulburarile de dinamica sexuala apar la 2/3 dintre pacienti. La femei, functia sexuala nu este compromisa.
Supravietuirea la 5 ani dupa beam iradiere externa este de 60-80% in T1, 26-59% in TT2, 20-38% in T3; pacientii in T4 fixat la pelvis rareori ajung la 5 ani.
Factori de prognostic favorabil sunt: T scazut, tumora unica, absenta dilatatiei tractului urinar superior si rezectia completa a umorii vizibile. Alti factori ce pot influenta rezultatul ar fi hemoglobina normala, volum redus de sub 5 cm a tumorii extravezicale, lipsa Cis.
Desi supravietuirea la 5 ani este acceptabila, recidiva locala poate apare la 50% dintre pacienti. O mica proportie dintre acestia pot beneficia de cistectomie de salvare, cu rezultate pe termen lung de 12-40%.
Desi tumorile T1 pot fi tratate prin radioterapie, ele sunt tratate cu rezultate foarte bune cu TURV asociat cu imunoterapie intravezicala, sau cistectomie.
Recomandari
Radioterapia externa beam se poate utiliza cu intentie curativa in tumorile tranzitionale vezicale T2-3NoMo. Pacientii vor fi informati de absenta studiilor comparative a cistectomiei radicale cu iradierea. Totusi rezultatele sunt bune in T2, tumora unica, complet rezecata si tract urinar superior normal. Brahiterapia se poate aplica pacientilor cu tumori unice sub 5 cm. Toata viata pacientul va fi supravegheat oncologic (cistoscopie, citologie urinara si alte investigatii cu scopul depistarii diseminarii).
2.3. Chimioterapia neoadjuvanta (ESU-Geneva)
Dupa cistectomie pentru tumori vezicale invazive, pana la 50% dintre pacienti pot dezvolta metastaze in primii 2 ani [238].
Chimioterapia pe baza de cisplatinol sau derivatii acestuia, cu o rata de raspuns de 40-70% a impus utilizarea in asociere cu cistectomia sau radioterapia sub forma de tratament neoadjuvant.
Chimioterapia neoadjuvanta se administreaza inainte de cistectomie sau radioterapie. Pacientii cu tumori vezicale solide T2-T4a pot fi candidati la chimioterapia neoadjuvanta. Indicatiile ar fi cazurile cu risc crescut de recidiva, unde reduce riscul micrometastazelor prezente la diagnostic. Tumora vezicala serveste ca un marker in vivo pentru evaluarea raspunsului la chimioterapie. Permite continuarea tratamentului in caz de raspuns maximal sau intreruperea acestuia in caz de ineficienta. Dupa Sternberg C. [235], amelioreaza stadiul tumorii vezicale, rezecabilitatea tumorii, scade amploarea terapiei definitive si face posibila prezervarea organului.
Dintre dezavantaje citam: dificila evaluarea raspunsului, mai mult pe criterii clinice decat anatomo-patologice. Se poate irosi un timp pretios la cazurile care nu raspund la tratament. In acest timp se pot forma noi tumori.
Produce un downstaging tumoral, cazurile care sunt inoperabile devin operabile.
Grupul Nordic de cistectomii, pe 311 pacienti carora le administreaza cate 2 cicluri de Adriamicin si Cisplatinol + 4000 R urmate de cistectomie comparativ cu cistectomie singura, constata, o supravietuire in plus de 20% la 5 ani la grupul cu T3aT4. Nu se constata diferente in grupul T1-2.
Grupul EORTC/MRC face un studiu pe 976 de cazuri de cistectomie. 491 de pacientii au beneficiat de chimioterapie cu Cisplatinol, Metothrexat si Vinblastin, urmata de cistectomie.La 486 de pacienti s-a practicat cistectomie, fara chimioterapie. Supravietuirea in grupul cu chimioterapie a fost in medie de 44 de luni si de 37,5 luni la cei fara chimioterapie. Diferenta de 6,5 luni nu are semnificatie statistica.
2.4. Tratamentul neoadjuvant si conservarea vezicii urinare
La 93 de pacienti [238] cu tumori vezicale infiltrative dupa TURV sau administrat 3 cicluri M-VAC. 43 de pacienti au fost T0, 20 Ta+1, 8 Tis, 17 T2-3, iar 8 refuza restadierea. La 43 s-a practicat TURV, la 13 cistectomie partiala, 35 cistectomie radicala. In grupul cu cistectomie partiala respectiv cistectomie radicala au fost 13/47 de pacienti cu T0 cu o supraveghere medie de 52 de luni (intre 7-146 de luni). La 5 ani sunt in viata 50/93-54% de pacienti dintre care 30 cu conservarea vezicii. La 5 ani supravietuirea este de 22% la cei cu T2 dupa MVAC si 69 % dintre cei cu T0 sau TVS. Supravietuirea la 5 ani a fost de 66% pentru TURV, 69% pentru cei cu cistectomie partiala, 54% pentru cei cu cistectomie radicala. P53 poate fi extrem de util la identificarea pacientilor candidati la prezervarea vezicii urinare. Toti pacientii cu tumori ce au ajuns de la T2 la T0 la cel de-al doilea TURV si p53 a fost negativ au supravietuit 5 ani, pe cand cei cu p53 pozitiv au avut o supravietuire de 47% la 5 ani.
Chimioterapia intra-arteriala
Chimioterapia neoadjuvanta intra-arteriala are avantajul cresterii concentratiei locale a medicamentelor administrate si poate duce la prezervarea vezicii. Aceasta tehnica a fost frecvent folosita in Japonia. Cea mai buna tehnica de administrare a chimioterapiei intra-arteriale ramane inca de stabilit. Exista variabilitate in ceea ce priveste doza, programul de administrare, administrarea continua sau pulsatila, folosirea angiotensinei pentru a realiza vasoconstrictia vaselor normale fata de cele tumorale, chimio-embolizarea, folosirea hipertermiei sau radioterapiei, localizarea si pozitia cateterului, fluxul sanguin regional fata de cel local si vascularizatia tumorii. Nu este clar daca un nivel constant al medicamentului fata de mai multe niveluri de varf este important pentru un efect antitumoral optim. Toxicitatea este importanta si cuprinde necroza tisulara si neuropatia severa. Rolul chimioterapiei intra-arteriale urmata de tratament conservativ sau cistectomie ramane inca nedefinit.
Chimioterapia neoadjuvanta si radioterapia
Radioterapia a fost folosita ca o metoda de prezervare a vezicii, si este standard in unele parti ale Europei si Canadei. Desi nivelul optim tumoricid este necunoscut, cele mai recente studii au recomandat o doza de 6500 cGy in doze zilnice de 180-200 cGy in regiunea tumorii, cu o doza restransa la 4750-5500 Gy pentru intreaga vezica si regiune perivezicala. Daca tratamentul este realizat cu doze mai mici de 200 cGy, toxicitatea este redusa. Radioterapia poate fi asociata si cu hipertermia, cu sau fara chimioterapie pentru a obtine raspuns tumoral crescut la pacientii cu cancer vezical avansat.
Numai cu radioterapie, pana la 40-50% din bolnavi obtin raspuns clinic complet, dar numai aproximativ 30% sunt vindecati cu functie vezicala normala pe termen lung. Intr-un raport de la Massachusetts General Hospital din Boston, 106 bolnavi cu tumori vezicale T2-T4a au fost tratati cu chimioterapie MCV urmata de iradiere pelvina de 39,6 Gy concomitent cu Cisplatin. Bolnavii care au raspuns au primit apoi radioterapie de 64,8 Gy. Cistectomia a fost realizata la cei care nu au obtinut un raspuns. Supravietuirea la 5 ani a fost de 52%. 43% au pastrat o vezica intacta functional. Tabelul 36 prezinta rezultatele unor studii recente multimodale asupra chimio-radioterapiei. Ratele de supravietuire la 5 ani variaza intre 42-63% cu prezervarea organului la aproximativ 40% dintre bolnavi. Toxicitatea care poate fi asociata cu radioterapia cuprinde: scaderea functiei vezicii, cistita, hematurie si aderente. Factorii de prognostic pentru vindecarea locala sunt absenta obstructiei ureterale, histologie papilara si rezectia tumorii vizibila, completa prin TURV inaintea radioterapiei.
Tabelul nr.36. Studii nerandomizate de chimioterapie combinata cu radioterapie.
|
Seria |
An |
Nr. |
Chimioterapie |
Supravietuire la 5 ani |
Suprav. la 5 ani cu VU intacta |
|
Radiation Therapy |
1993 |
42 |
DDP |
52% |
42% |
|
Oncology Group-1 | |||||
|
|
1994 |
DDP sau Carbo |
41% |
||
|
Genova |
1995 |
76 |
DDP/5FU |
42% | |
|
Radiation Therapy |
1996 |
91 |
MCV |
62% * |
44% |
|
Oncology Group-2 | |||||
|
Massachusetts General |
1997 |
106 |
MCV |
52% |
43% |
|
|
1997 |
120 |
DDP/5FU |
Supravietuire la 4 ani.
Prezervarea vezicii este posibila printr-o abordare combinata multimodala folosind chimioterapia si radioterapia. Incercarile de prezervare a vezicii trebuie sa tina cont de toxicitatea acestor modalitati combinate. Succesul real al tratamentului de prezervare a vezicii prin chimioterapie si radioterapie necesita o verificare prin studii prospective randomizate.
2.5. Chimioterapia adjuvanta
Chimioterapia adjuvanta urmeaza cistectomiei la bolnavii cu risc crescut de recadere (T3b,T4,N1-N3). Aceasta abordare a dus la cresteri in ratele de supravietuire la bolnavii cu unele tumori solide. Principalul avantaj este acela ca piesa de cistectomie este disponibila pentru examinarea histopatologica. Factorii de prognostic pentru recidiva si/sau metastaze pot fi determinati. Bolnavii pot fi apoi selectati pentru chimioterapie. Daca cistectomia este facuta imediat, nu exista intarziere in tratamentul definitiv. De asemenea, se evita refuzul bolnavului, care poate surveni daca s-a realizat un raspuns clinic complet prin chimioterapie neoadjuvanta. Dezavantajul major al chimioterapiei adjuvante este intarzierea in administrarea chimioterapiei sistemice pentru metastaze oculte in timp ce tratamentul pentru tumora primara este amplificat. Un alt dezavantaj este acela ca este foarte dificila administrarea chimioterapiei dupa cistectomie la bolnavi debilitati, frecvent varstnici.
Intr-un studiu nerandomizat, Logothetis [128,129,130] a selectat bolnavii cu risc crescut de recidiva pe baza invaziei limfatice sau vasculare, metastazelor ganglionare, tumorii extravezicale sau extensiei rezecabile in organele pelvine. Chimioterapia adjuvanta a avut beneficiu la bolnavii cu metastaze ganglionare rezecate si tumori extravezicale. Nu a fost observat nici un avantaj la bolnavii care au avut numai invazie vasculara.
Intr-un studiu randomizat, Skinner [226] a gasit o crestere in durata pana la progresie si in supravietuire la bolnavii tratati cu CISCA adjuvanta. A administrat Cisplatin 100mg/mp, Doxorubicin 60mg/mp, Ciclofosfamida 600mg/mp la intervale de 28 de zile, 4 cicluri. Cel mai important factor de prognostic a fost extinderea atingerii ganglionare la momentul cistectomiei. Concluzia este prelungirea timpului de progresie la 4,3 ani fata de 2,4 ani la cei care nu au efectuat decat cistectomie.
Un studiu german[239] cu MVAC sau MVEC pare a confirma aceste rezultate. Studiul a fost inchis, dupa ce o analiza intermediara a aratat un beneficiu pentru cei randomizati in lotul cu chimioterapie cu 27% progresie fata de 82% progresie in lotul control netratat. Bolnavilor din lotul martor nu li s-a aplicat chimioterapie la recadere. Intr-un update, supravietuirea la 5 ani fara progresie a fost de 58% in lotul cu chimioterapie fata de 13% la cei doar cistectomizati. La pacientii cu N1 evolutia la 3 ani fara recidiva a fost de 75% la cei cu tratament fata de 25% la cei fara tratament.
Studer in 1994 [241] prezinta rezultatele unui studiu cu 3 cure de Cisplatinol 90 mg/mp. Evaluarea la 5 ani a evidentiat supravietuire de 54% la grupul pacientilor cu cistectomie radicala, respectiv 57% la cei cu cistectomie radicala+chimioterapie adjuvanta.
Chimioterapia sistemica ofera speranta unei supravietuiri pe termen lung la unii bolnavi cu cancer al vezicii urinare metastazat. Activitatea antitumorala a fost demonstrata cu cativa agenti unici cu rare imbunatatiri in supravietuire.
M-VAC (metotrexat, vinblastina, adriamicina, cisplatin), CMV (cisplatin, metotrexat, vinblastina), CM (cisplatin, metotrexat) si CISCA/CAP (ciclofosfamida, adriamicina, cisplatin) sunt considerate printre cele mai eficiente regimuri pentru TCC avansat, cu beneficiu in supravietuire la bolnavii care obtin raspuns complet. M-VAC este superior terapiei numai cu cisplatina si CISCA.
2.6. Boala metastatica (stadiul N3M1)
In boala metastatica, chimioterapia s-a dovedit mai eficienta impotriva metastazelor ganglionare fata de cele viscerale. Bolnavii cu metastaze ganglionare avansate, in comparatie cu cei cu metastaze viscerale, au o rata de raspuns mai mare (71% fata de 40%) si supravietuirea mai mare (33 luni fata de 12 luni).-Sternberg (236).In studiile ce au urmat aceste date nu s-au confirmat.
In afara de leziunile pulmonare, care raspund la tratament, leziunile viscerale, in special cele hepatice, raspund slab la chimioterapie. Sistemul nervos central este un loc neatins Bolnavi selectionati cu tumori uroteliale si metastaze locoregionale pot beneficia de terapia de consolidare cu chirurgie sau radioterapie dupa raspunsul maxim la chimioterapie.
Raspunsul la terapia bazata pe cisplatin se produce de obicei rapid. Chimioterapia poate fi oprita daca nu este observat vreun raspuns, in special daca exista o toxicitate excesiva. Bolnavii peste 70 ani, in special cei cu status alterat, pot fi tratati prin reducerea tuturor dozelor de chimioterapie cu 20-30%. Studii randomizate arata ca regimuri cu 3 sau 4 medicamente pot fi considerate ca tratamente standard. Ele ar trebui sa cuprinda fie M-VAC fie CMV, care nu au fost comparate pana acum.
2.7. Noi strategii, agenti si combinatii in boala avansata
Chimioterapia combinata se reflecta in supravietuirea pe termen lung la aproximativ 15-20% din bolnavi. Totusi, majoritatea bolnavilor decedeaza datorita acestei boli. Astfel, sunt necesare noi strategii.
Factori de crestere hematopoietici si intensitatea dozei. Strategiile de crestere a ratelor raspunsului complet cuprind intensificarea dozei de chimioterapie cu ajutorul unui factor de crestere hematopoietic. Cand M-VAC a fost administrat impreuna cu Granulocite Colony Stimuling Factor (G-CSF) mucozitatea si mielosupresia au fost ameliorate. Dupa raspunsuri initiale favorabile la bolnavii tratati cu M-VAC amplificat si factori de crestere, cateva grupuri au inceput faza a II-a a testelor, dar mai tarziu s-a abandonat aceasta abordare datorita toxicitatii excesive. Singurul studiu randomizat care compara M-VAC cu M-VAC cu doze mari a fost realizat de EORTC. Odata cu adaugarea G-CSF a fost posibila administrarea unei doze duble de cisplatina si doxorubicina in jumatate din timp. Daca aceasta abordare poate sau nu sa duca la o imbunatatire in supravietuire ramane de determinat. M-VAC amplificat nu este recomandat ca tratament de linia a II-a la bolnavii la care nu a reusit tratamentul initial M-VAC, deoarece acesti bolnavi sunt probabil rezistenti la acest tratament.
Gemcitabina este un nou antimetabolit, un analog de citozin arabinozid, care inhiba sinteza de ADN. Gemcitabina se administreaza de obicei saptamanal timp de 3 saptamani, la fiecare 4 saptamani. Ca agent singular s-au obtinut rate de raspuns de 25-29% in cateva studii. Gemcitabina a fost combinata cu cisplatina. S-a obtinut o rata de raspuns de 40%, cu o supravietuire medie de 12,1 luni. A rezultat o mielosupresie semnificativa, in special trombocitopenie, cel mai probabil datorita programului de dozaj neobisnuit al chimioterapiei cu cisplatina. Dozajul si orarul de administrare au fost modificate intr-un studiu randomizat in desfasurare in comparatie cu M-VAC.
Taxoizi reprezinta o clasa noua de medicamente antineoplazice. Paclitaxel (Taxol) si Docetaxel (Taxotere) au un mecanism similar de actiune: promotia asamblarii microtubulilor si inhibarea dezasamblarii lor. O rata de raspuns de 42% (respectiv 27% raspuns complet) a fost obtinuta la bolnavi netratati cu Taxol in doza mare (250 mg/m2) plus G-CSF (McGuire, 1989 [148], Holmes, 1991 [88]). Ulterior s-a combinat Taxol cu metotrexat si cisplatina si s-a raportat o rata de raspuns de 40% la bolnavii care au primit anterior M-VAC. Alti cercetatori au combinat Taxol fie cu cisplatina fie cu carboplatina, plus factori de crestere la bolnavii netratati, si au obtinut rate de raspuns inalte de 50-80%. Studii asupra regimurilor continand Taxol sau Taxotere la cancerul de vezica urinara in stadiu avansat sunt in curs.
Modularea cu fluoropirimidina Modularea 5-fluorouracil cu interferon-alfa a fost evaluata la 30 de bolnavi netratati anterior, cu o rata de raspuns de 30%. Cand a fost adaugat cisplatin, 17 din 28 bolnavi intens tratati anterior cu M-VAC au raspuns. Rata de raspuns de 61% a fost impresionanta.
Terapia genica Unul dintre cele mai interesante moduri de a trata celulele tumorale este terapia genica. Aceasta este o terminologie vasta care se refera la tratarea bolnavilor prin introducerea unor gene straine. Insertia genelor se poate produce in vitro in culturi de celule si injectare ulterioara la bolnav sau direct in vivo. Una dintre cele mai eficiente tehnici de terapie genica este folosirea virusurilor atenuate care pot juca rol de transportori ai genelor spre celulele normale. Sunt folosite de asemenea si sisteme care nu se bazeaza pe virusuri. Acestea cuprind livrarea de ADN, lipozomi, livrarea fie de ADN simplu fie ADN in plasmide de replicatie. Un numar de cercetatori au luat in vedere cancerul vezical pentru studii terapeutice, si au cautat sa insere genele IL-2, RB, p53. Vezica urinara este un model potrivit pentru testele clinice in terapia genica. Este usor accesibila pentru instilarea vectorilor de transfer ai genelor si pentru evaluare sau biopsie cistoscopica pre/posttratament cu morbiditate minima.
2.8. Tratamentul paleativ al cancerului vezical avansat
Radioterapia paleativa Radioterapia cu doze de 30-35 Gy in 10 fractiuni este deseori utila in reducerea durerii din metastazele osoase. Iradierea cu doze de 40-45 Gy poate fi eficienta in controlul simptomelor locale ale tumorii primare, dar si poate agrava simptomele deja prezente ca polakiuria sau disuria.
Instilarea intravezicala de aluminiu sau formalina O solutie de aluminiu de 1% (Ostroff si Chevault)[172] sau formalina 1-10% pot fi eficiente in tratarea hemoragiilor datorate cistitei radice. Solutia de formalina este iritanta pentru vezica si, de aceea, necesita anestezie generala sau regionala pentru instilarea intravezicala; absenta refluxului vezico-ureteral este o conditie obligatorie pentru a se putea efectua administrarea intravezicala a acestor substante.
De asemenea se mai poate incerca tratamentul cu oxigen hiperbar, embolizarea paleativa a arterei hipogastrice sau cistectomia paleativa.
3. Cistectomia radicala
3.1. Indicatii de cistectomie radicala
Rezumand experienta Centrului de Chirurgie Urologica, Dializa si Transplant Renal din cadrul Institutului Clinic "Fundeni" pe circa 4000 de cazuri de cistectomii si a datelor din literatura a rezultat ca cistectomia este indicata in urmatoarele situatii clinice:
Indicatia de electie a cistectomiei radicale o constituie cazurile T1G3 recidivate sau cu esec de tratament adjuvant, T2a, T2b, T3a, T3b/N0M0U- la un bolnav echilibrat metabolic, cu functie renala normala, care accepta operatia, uneori cu pretul potentei.
Tumori vezicale in stadiul T4 (a, b).
Toate tumorile, indiferent de forma clinica si stadiu, in care procedeele chirurgicale conservatoare, endoscopice si radioterapice nu reusesc sa distruga tot tesutul canceros (asa numita sterilizare neoplazica).
In localizarile cervicale ale tumorii si invazie in uretra prostatica, cistectomia radicala va fi completata cu uretrectomie efectuata pe cale perineala.
 Anatomo-patologul trebuie sa examineze
atent si bonturile ureterale rezecate. Daca exista atipie
agravata la acest nivel, se rerezeca ureterul, pana in
tesut confirmat prin biopsie extemporanee ca fiind sanatos. Postoperator
se va urmari citologia aparatului urinar si se vor efectua urografii
repetate pentru supravegherea tractului urinar superior, care poate dezvolta
alta tumora uroteliala
Anatomo-patologul trebuie sa examineze
atent si bonturile ureterale rezecate. Daca exista atipie
agravata la acest nivel, se rerezeca ureterul, pana in
tesut confirmat prin biopsie extemporanee ca fiind sanatos. Postoperator
se va urmari citologia aparatului urinar si se vor efectua urografii
repetate pentru supravegherea tractului urinar superior, care poate dezvolta
alta tumora uroteliala
Tabelul nr.37. Indicatiile cistectomiei radicale.
Cistectomia
radicala reprezinta singura solutie terapeutica in cazul
tumorilor sangerande, obstructive, rapid recidivante si difuze, iar indicatiile cistectomiei radicale sunt cuprinse in
tabelul 37.
Tipurile de cistectomie efectuate (cu menajarea nervilor erectori/deci prezervarea potentei sau exereza acestora):
Cistectomia simpla - exereza vezicala, fara prostata si vezicule seminale.
Cistectomia totala -extirparea vezicala, a prostatei, veziculelor seminale, fara limfodisectie.
Cistectomie radicala - este interventia care adauga limfodisectia la cistectomia totala.
Dupa modul de efectuare cistectomiile pot fi:
Cistectomia planificata, apreciata ca modalitatea terapeutica cea mai buna pentru rezolvarea cazului respectiv.
Cistectomia de urgenta, in care exereza vezicala se impune ca singura metoda terapeutica de rezolvare a hemoragiilor vezicale intratabile altfel.
Cistectomia de salvare, necesara in cazurile in care tumora nu poate fi eradicata prin alte procedee. Aici sunt incluse nu numai cazurile cu tesut neoplazic restant altor proceduri terapeutice, dar si vezica mica radica, defunctionalizata, cu sindrom vezical de nesuportat.
Derivatiile urinare folosite au fost:
Ureterostomia cutanata
Ureterosigmoidostomia
Derivatia Bricker
Cistoplastia de substitutie.
Daca se are in vedere efectuarea unei cistoplastii de substitutie, tumora vezicala trebuie sa se afle in afara trigonului, colului vezical, prostata sa nu fie invadata de tumora vezicala, iar uretra prostatica trebuie sa fie libera (cu confirmare histopatologica).
Pe un lot de 100 de pacienti [219] cu cistectomie radicala si cistoplastie de substitutie efectuate intre 1992-2001 de catre autori, indicatiile au fost urmatoarele: 94 de cazuri pentru cancere vezicale, 6 pentru vezici mici defunctionalizate. In cazul tumorilor vezicale indicatiile au fost urmatoarele: 27 pT1, 20 pT2, 20 pT3a, 23 pT3b, 4 T4a. Histopatologic: 84 au fost carcinoame tranzitionale, 8 carcinoame scuamoase, 1 fibrosarcom, 1 carcinosarcom. 9 cazuri au fost N+ (2N1,7N2). Mortalitatea postoperatorie a fost de 3%. Supravegherea cazurilor s-a efectuat intre 7-128 de luni.
Multifocalitatea tumorala si prezenta carcinomului in situ sunt criteriile de excludere a efectuarii unei cistoplastii de substitutie.
Este de preferat ca varsta bolnavului sa fie sub 70 ani, sa nu aiba alte afectiuni asociate, ganglionii locoregionali trebuie sa fie negativi, sa nu aiba metastaze, si, in general, speranta de viata a bolnavului sa fie de cel putin 2 ani.
3.2. Tehnica operatorie
A. Cistectomia radicala pentru tumora vezicala infiltrativa la barbat
Cistectomia radicala la barbat se defineste prin extirparea vezicii urinare cu uraca si peritoneul adiacent, a prostatei, veziculelor seminale si a tesutului celulograsos ilio-pelvin.
Protocolul preoperator de investigatii consta din:
anamneza si examen clinic
probele bioumorale uzuale de sange si urina
ecografie reno-vezicala, hepatica
urografie
radiografie pulmonara
cistoscopie si palpare bimanuala sub rahianestezie
biopsierea tumorii vezicale si examenul histopatologic.
Pregatirea preoperatorie (Tabelul nr.38) consta din:
|
Ziua intai ora 9 |
Sistarea administrarii alimentelor solide Administrarea a circa 1500 ml lichide per os Metronidazol 7 g (1 g la 2 ore) Eritromicina 4 g (1 g la 2 ore) |
|
ora 14 |
Manitol 250-500 ml solutie 20% intr-un litru de apa (sau Fortrans, 4 plicuri), pana la "scaun ca apa" |
|
ora 20 |
Clisma |
|
ora 22 |
Perfuzie cu circa 1500 ml ser fiziologic, 1000 ml glucoza 10% Cefalosporina 1 g |
|
Ziua a doua ora 7 |
Clisma |
|
ora 8 |
Cefalosporina 1 g |
|
ora 8:30 |
Operatia |
 Tehnica operatorie
Tehnica operatorie
b.
Pozitionarea pacientului pe masa de operatie se face cu
elevatorul pozitionat sub ombilic (Fig.86.a,b).
Se monteaza sonda uretro-vezicala, tub rectal, o cale venoasa centrala si una periferica, iar chirurgul sta pe partea stanga a pacientului.
Figura 86.a,b. Pozitionarea bolnavului
pe masa de operatie [164].
Abordul se face prin laparotomie mediana pubo-supraombilicala (Fig.87.a,b) care se prelungeste, dupa cerinte, spre apendicele xifoid.


a. b.
Figura 87.a,b. Incizia peretelui abdominal.
Se izoleaza un lambou peritoneal in forma de "V" inversat, incluzand uraca, cu varful la ombilic si bratele la nivelul orificiilor inghinale (Fig.88.a,b), medial de funiculul spermatic corespunzator. Se inspecteaza si se palpeaza leziunile vezicale, se constata operabilitatea cazului, se palpeaza ficatul pentru decelarea posibilelor metastaze; se examineaza palpator vasele pelvisului si aorta abdominala pentru adenopatii.
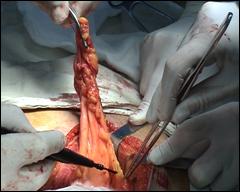

a. b.
Figura 88. a.b. Disectia peritoneului cu uraca [164].
Urmeaza izolarea si sectionarea ureterelor (Fig.89). Se incepe cu partea dreapta, unde se incizeaza peritoneul de-a lungul ureterului la incrucisarea cu vasele iliace, se izoleaza ureterul pelvin, se pune pe lasou, se diseca pana la nivel juxta-vezical avand grija sa-i prezervam tesut grasos si adventicea (Fig.90).


Figura 89. Izolarea ureterelor [84] Figura 90. Izolarea si sectionarea ureterului
drept.
 Se va pune clip pe ureter si se
sectioneaza juxta-vezical, avand grija sa luam
recupa din ureter pentru excluderea histopatologica a unei posibile
leziuni a mucoasei (displazie sau carcinom in
situ).
Se va pune clip pe ureter si se
sectioneaza juxta-vezical, avand grija sa luam
recupa din ureter pentru excluderea histopatologica a unei posibile
leziuni a mucoasei (displazie sau carcinom in
situ).
Se procedeaza identic pe partea stanga (Fig.91).
Figura 91.
Izolarea si sectionarea ureterului stang
Se mobilizeaza cecul, colonul ascendent, ileonul pe partea dreapta si colonul sigmoid pe partea stanga. Izolarea anselor intestinale in abdomenul superior si o buna expunere a pelvisului pare sa constituie unul dintre principalele elemente care sa asigure buna desfasurare a operatiei.
In acest scop se folosesc izolari din tifon (Mikulicz) imbibate in ser fiziologic cald. O izolare se introduce in spatiul parieto-colic drept, alta izolare in spatiul parieto-colic stang, iar una se pune pe masa intestinala ce se impinge in sus, spre etajul abdominal superior.
Se insera in plaga un departator autostatic, cel mai utilizat tip fiind departatorul Bookwalter.
Limfodisectia ilio-pelvina
Dupa aria de tesut limfograsos indepartat chirurgical sunt cunoscute urmatoarele tipuri de limfodisectie:
I. Extensiva - de la 2 cm deasupra bifurcatiei aortei pana la arcada inghinala (Skinner), sau de la artera mezenterica inferioara in jos (Hohenfelner), incluzand ganglionii preaortici, precavi, interaortico-cavi, latero-aortici si latero-cavi de la acest nivel, de pe vasele iliace comune, externe si pana la arcada inghinala, hipogastrice, pana jos in fosa obturatorie.
II. Standard - de la jumatatea arterei iliace comune in jos (Whitmore)[228].
III. Selectiva - indeparteaza tesutul limfograsos din triunghiul format de vasele iliace externe, interne pana in fosa obturatorie.
IV. Limfodisectie de biopsie-diagnostic - consta in prelevarea ganglionilor suspectati de a fi invadati.
Tehnica limfodisectiei ileo-pelvine standard
Obiectivul este indepartarea tesutului limfo-grasos de pe 4 cm din artera iliaca comuna, vasele iliace externe, artera iliaca interna si fosa obturatorie.
Limfodisectia incepe pe partea dreapta, unde se mobilizeaza peritoneul de-a lungul vaselor iliace si se sectioneaza ductul deferent intre ligaturi. Se indeparteaza tesutul limfo-grasos de pe vasele iliace comune (pe o lungime de 3-4 cm), vasele iliace externe, incepand cu artera, trecand apoi la vena, cu menajarea nervului genito-crural, al carui traiect se situeaza paralel cu artera iliaca externa, la circa 0,5 cm in afara acesteia. In portiunea distala a arterei iliace externe, in imediata proximitate a arterei inghinale, aceasta este incrucisata de vena circumflexa ce isi are originea in vena iliaca externa. Medial de vena iliaca externa, intre aceasta si arcada inghinala se afla ganglionul Cloquet-Rosenmller, care se indeparteaza.
Se diseca artera iliaca interna si se izoleaza cu relativa usurinta ramura ombilico-vezicala a acesteia, sectionandu-se intre ligaturi.
Se trece la disectia fosei obturatorii. Se repereaza nervul obturator care traverseaza fosa obturatorie de-a lungul muschiului obturator intern, paralel si dedesubtul venei iliace externe, putand fi reperat cu usurinta datorita aspectului caracteristic (sidefiu) si a consistentei sale. Se incarca nervul obturator cu un departator vascular sau Gil Vernet si se ridica spre vena iliaca externa. In tesutul restant se afla artera si vena obturatorie, care se pot rezeca. Pentru ridicarea tesutului limfo-grasos din fosa obturatorie se poate utiliza o compresa cu care se disociaza tesutul limfo-grasos de pe muschiul obturator, si, cu miscari blande, se impinge in jos, spre planseul pelvin si vasele iliace interne.
Depistarea ganglionilor palpabili necesita verificarea lor prin examen bioptic extemporaneu, gest de mare importanta pentru stadierea corecta a extensiei tumorii vezicale, implicit pentru prognosticul bolnavului.
 La terminarea limfodisectiei ilio-pelvine,
vasele iliace disecate sunt complet denudate de invelisul lor
limfo-grasos; pe fundul fosei obturatorii se vede muschiul obturator
intern si nervul obturator. Se procedeaza identic pe partea stanga.
La terminarea limfodisectiei ilio-pelvine,
vasele iliace disecate sunt complet denudate de invelisul lor
limfo-grasos; pe fundul fosei obturatorii se vede muschiul obturator
intern si nervul obturator. Se procedeaza identic pe partea stanga.
b.
 Figura
93. a,b. Distributia ariilor limfoganglionare
regionale in tumorile vezicale.
Figura
93. a,b. Distributia ariilor limfoganglionare
regionale in tumorile vezicale.
Legenda: 1) Ganglioni limfatici latero-cavi;
2) Ganglioni limfatici interaortico-cavi;
3) Ganglioni limfatici latero-aortici;
4) Ganglioni limfatici iliaci comuni dreapta;
5) Ganglioni limfatici iliaci externi dreapta;
6) Ganglioni limfatici ilici comuni stanga;
7) Ganglioni limfatici externi stanga;
8) Ganglioni limfatici de la bifurcatia aortei;
9) Ganglioni limfatici ai fosei obturatorii drepte;
10) Ganglioni limfatici iliaci interni dreapta;
11) Ganglioni limfatici paravezicali dreapta;
12) Ganglioni limfatici ai fosei obturatorii stangi;
13) Ganglioni limfatici iliaci interni stanga;
14) Ganglioni limfatici paravezicali stanga.
 Se incepe pe partea dreapta (Fig.94), unde se mobilizeaza
peritoneul de-a lungul vaselor iliace (Fig.95) si se sectioneaza ductul deferent
intre ligaturi.
Se incepe pe partea dreapta (Fig.94), unde se mobilizeaza
peritoneul de-a lungul vaselor iliace (Fig.95) si se sectioneaza ductul deferent
intre ligaturi.
Figura 94. Limfodisectia
pe partea dreapta


a. b.
Figura 95.a,b. Mobilizarea peritoneului de pe vasele iliace si sectionarea canalului deferent [164].
 Se indeparteaza tesutul
limfo-grasos de vasele iliace comune (3-4 cm), vasele iliace externe,
incepand cu artera (Fig.96), trecand apoi la
vena, avand grija cu menajarea nervului genito-crural, al carui
traiect se situeaza paralel cu artera iliaca externa, la circa
0,5 cm in afara acesteia.
Se indeparteaza tesutul
limfo-grasos de vasele iliace comune (3-4 cm), vasele iliace externe,
incepand cu artera (Fig.96), trecand apoi la
vena, avand grija cu menajarea nervului genito-crural, al carui
traiect se situeaza paralel cu artera iliaca externa, la circa
0,5 cm in afara acesteia.
Figura 96. Disectia tesutului celulo-grasos
de pe vasele iliace [164].
In portiunea distala a arterei iliace externe, in imediata proximitate a arcadei inghinale aceasta este incrucisata de o vena circumflexa ce isi are originea din vena iliaca externa.
Medial de vena iliaca externa, intre aceasta si arcada inghinala, se afla ganglionul Cloquet-Rosenmller, care se indeparteaza.
Se diseca artera iliaca interna si se izoleaza cu relativa usurinta ramura ombilico-vezicala a acesteia (Fig.97.a), sectionandu-se intre ligaturi. Se trece la disectia fosei obturatorii (Fig.97.b,c,d).




b. d.
Figura 97.a) Sectionare pedicul lateral - artera vezicala superioara; b-d) Disectie fosa obturatorie.
 Se repereaza nervul obturator, care
traverseaza fosa obturatorie de-a lungul muschiului obturator intern,
paralel si dedesubtul venei iliace externe, putand fi reperat cu
usurinta datorita aspectului caracteristic (sidefiu)
si a consistentei sale. Se incarca nervul obturator cu un
departator vascular sau Gil Vernet si se ridica spre vena
iliaca externa. In tesutul restant se afla artera si
vena obturatorie, care se pot lega si sectiona la iesirea din
fosa obturatorie.
Se repereaza nervul obturator, care
traverseaza fosa obturatorie de-a lungul muschiului obturator intern,
paralel si dedesubtul venei iliace externe, putand fi reperat cu
usurinta datorita aspectului caracteristic (sidefiu)
si a consistentei sale. Se incarca nervul obturator cu un
departator vascular sau Gil Vernet si se ridica spre vena
iliaca externa. In tesutul restant se afla artera si
vena obturatorie, care se pot lega si sectiona la iesirea din
fosa obturatorie.
a.
 Pentru ridicarea tesutului
limfo-grasos din fosa obturatorie se utilizeza o compresa cu
care se desprinde tesutul limfo-grasos de pe muschiul obturator
intern, si cu miscari blande se impinge in jos, spre
planseul pelvin si vasele iliace interne.
Pentru ridicarea tesutului
limfo-grasos din fosa obturatorie se utilizeza o compresa cu
care se desprinde tesutul limfo-grasos de pe muschiul obturator
intern, si cu miscari blande se impinge in jos, spre
planseul pelvin si vasele iliace interne.
Depistarea ganglionilor palpabili necesita verificarea lor prin examen bioptic extemporaneu, gest de mare importanta pentru stadierea corecta a extensiei tumorii vezicale, implicit pentru prognosticul bolnavului.
b.
La terminarea
limfodisectiei ilio-pelvine vasele iliace disecate sunt complet dezgolite
de invelisul lor limfo-grasos, iar pe fundul fosei obturatorii se
vede muschiul obturator intern si nervul obturator. Se
procedeaza identic pe partea stanga
(Fig.98,99).


Figura 98.a-d Limfodisectia pe partea stanga.

Figura 99. Aspect final de limfodisectie.


|
|
b.


Figura 101.a,b) Decolarea vezicii urinare, veziculelor seminale de pe rect,
posterior de fascia Denonvillier.
Ligatura / sectionarea etajata a pediculilor vasculari posteriori (Fig.102.a,b)
Dupa decolarea vezicii urinare, veziculelor seminale si prostatei de pe rect, pediculii vasculari posteriori devin usor de identificat. Se separa medial de peretele lateral al rectului prin disectie digitala, in ideea evitarii leziunilor rectale in timpul clamparii lor, si sectionarii lor cat mai departe de vezica urinara pentru evitarea marginilor pozitive. Se ridica de vezica urinara, punand in tensiune pediculul posterior de partea respectiva si se separa in fascicule, prin palpare digitala cu punerea penselor splenice la vedere, dupa care se sectioneaza si ligatureaza etajat. Se ajunge astfel la nivelul marginilor laterale ale prostatei, initial pe partea dreapta si apoi pe partea stanga.
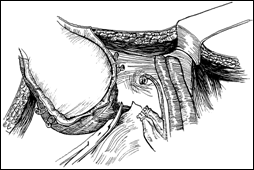

Figura 102.a,b)
Sectionarea
pediculului
posterior.
a. b.
Incizarea fasciei endopelvice si sectionarea ligamentelor pubo-prostatice si a venei dorsale a penisului. Incizia fasciei endopelvice (Fig.103.a,b), cu cauterul pe partile laterale ale prostatei, de la ligamentele pubo-prostatice posterior de-a lungul jonctiunii dintre foita parietala, ce acopera muschiul ridicator anal si foita viscerala ce acopera prostata.

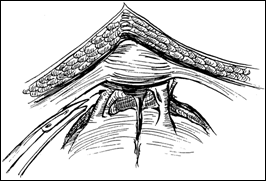
a. b.
Figura 103.a,b) Incizia fasciei endopelvine si a ligamentelor pubo-prostatice.
Sunt identificate ligamentele pubo-prostatice (Fig.103.b) si se sectioneaza; se identifica complexul venos dorsal al penisului si se trece o pensa intre uretra si vena dorsala a penisului (Fig.104.a,b) care se sectioneaza intre ligaturi.


a. b.
Figura 104.a,b) Sectionarea intre ligaturi a complexului venos dorsal
Alte metode de hemostaza la nivelul complexului venos dorsal

Figura 105.
Schema anatomica a regiunii.


Figura 106. Incizia fasciei endopelvine Figura 107. Izolarea
complexului venos dorsal si a ligamentelor pubo-prostatice.


Se trece o pensa intre complexul venos dorsal si uretra.
|
Figura 108. Schema sugerand modul de separare a complexului venos dorsal de uretra. |


a. b.
Figura 110.a,b) Ligatura-sectionarea complexului venos dorsal si a ligamentelor pubo-prostatice.
Exista trei modalitati de a termina o cistectomie radicala la barbat:
lasarea unui bont uretral lung pentru cistoplastie de substitutie
excizia bontului uretral si derivatie urinara cutanata
excizia uretrei.
Disectia uretrei membranoase. Sectionarea uretrei membranoase (Fig.111.a,b), permite vizualizarea jonctiunii dintre uretra membranoasa si apexul prostatei.


a. b.
 Se sectioneaza anterioara
a uretrei membranoase si se insera 3 fire de Vicryl 3-0 la orele
12,2,10, fire ce vor fi utilizate pentru anastomozarea rezervorului la
uretra. Se tractioneaza sonda Foley cu o pensa Kocher (Fig.112.a,b) si se sectioneaza sonda
sub pensa, utilizand portiunea proximala pentru tractiune.
Se sectioneaza posterioara a uretrei si se trec 2 sau 3
fire de Vicryl 3-0 la orele 5 si 7 sau 4, 6, 8 (Fig.113).
Se sectioneaza anterioara
a uretrei membranoase si se insera 3 fire de Vicryl 3-0 la orele
12,2,10, fire ce vor fi utilizate pentru anastomozarea rezervorului la
uretra. Se tractioneaza sonda Foley cu o pensa Kocher (Fig.112.a,b) si se sectioneaza sonda
sub pensa, utilizand portiunea proximala pentru tractiune.
Se sectioneaza posterioara a uretrei si se trec 2 sau 3
fire de Vicryl 3-0 la orele 5 si 7 sau 4, 6, 8 (Fig.113).
Sectionarea uretrei la ciocul prostatei.


a. b.
Figura 112.a,b. Sonda Foley se sectioneaza si se utilizeaza capatul proximal pentru tractiune.


Inserarea a 6 fire de Vicryl 3-0 la bontul uretral.

b.
Se ridica
piesa operatorie (Fig.114.a,b,c), se
controleaza hemostaza si se trece la efectuarea cistoplastiei de
substitutie sau a unei alte derivatii urinare.
Figura 114.a,b,c) Piesa operatorie: a) fata
posterioara; b) fata
anterioara; c) piesa de
cistectomie la un alt pacient.

c.
4. Uretrectomia la barbat
Indicatii: - tumori vezicale multiple, asocierea cu Cis
- invazia colului vezical
- invazia uretrei posterioare.
Contraindicatii: pacienti varstnici, cu risc mare
Se poate efectua in aceiasi sedinta cu cistectomia, sau in alta sedinta operatorie.



Figura 115. Ligatura/sectionarea complexului venos
dorsal Figura 116. Expunerea chirurgicala a uretrei
membranoase Figura 117. Ligatura/sectionarea uretrei
membranoase

Figura 118. Piesa de cistectomie.

 1.
In pozitie de litotomie se practica o incizie perineala
mediana, de la baza scrotului la 3 cm de anus. (Fig.119.a,b). Incizia
tesutului subcutan cu expunerea muschiului bulbocavernos si
superficial transvers al perineului. Retractia lor permite expunerea corpului spongios. Identificarea/ligatura
arterelor bulbare.
1.
In pozitie de litotomie se practica o incizie perineala
mediana, de la baza scrotului la 3 cm de anus. (Fig.119.a,b). Incizia
tesutului subcutan cu expunerea muschiului bulbocavernos si
superficial transvers al perineului. Retractia lor permite expunerea corpului spongios. Identificarea/ligatura
arterelor bulbare.
Figura 119.a,b.

 2. Separarea progresiva a
corpului spongios si uretrei de corpii cavernosi, invaginarea
progresiva a penisului in tegumentele peniene spre baza glandului (Fig.120.a,b).
2. Separarea progresiva a
corpului spongios si uretrei de corpii cavernosi, invaginarea
progresiva a penisului in tegumentele peniene spre baza glandului (Fig.120.a,b).
Figura 120.a,b.


Figura 121.a,b) Invaginarea progresiva a penisului in tegumentele peniene spre baza glandului.
3. Se diseca apoi uretra spre diafragma urogenitala. Se ligatureaza si sectioneaza ramurile uretrale din a. iliaca interna. Se largeste hiatusul din diafragm pentru retragerea specimenului din abdomen (Fig.122.a,b,c).


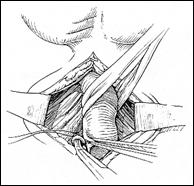
a. b. c.
Figura 122. a,b,c.
4. Incizia uretrei distal (fosa naviculara) dupa o incizie ventrala a glandului (unii fac o incizie in 'T').



a. b. c.
Figura 123.a,b,c) Incizia in "T" a glandului.



a. b. c.
Figura 124.a,b,c) Excizia uretrei.



Aspect de ansamblu la finalul interventiei.
|
Figura 126. Piesa operatorie. |
|
Figura 127. Pacientul la 3 saptamani postoperator. |
5. Cistectomia radicala la femeie
(sinonime: pelvectomia anterioara, exenteratia pelvina anterioara)
Cistectomia radicala la femeie implica exereza in bloc a vezicii urinare cu peritoneul adiacent si uraca pana la ombilic, uterul, trompele si ovarele, a peretelui vaginal anterior si a tesutului limfo-grasos ilio-pelvin.
Indicatia de cistoplastie de substitutie va fi rezervata cazurilor de tumora vezicala infiltrativa ce nu intereseaza uretra, colul vezical, peretele vaginal anterior (T2-T3a-T3b); vezica urinara defunctionalizata (post-iradiere, cistita interstitiala, tuberculoza).
 Tehnica chirurgicala
Tehnica chirurgicala
Pregatirea pentru operatie si pozitionarea pacientei pe masa de operatie se face in aceeasi maniera ca la barbat. Se introduce o mesa imbibata cu povidone-iodine (Betadine) in vagin. Abordul se face prin laparotomie pubo-supra-ombilicala. Se procedeaza la inspectia si palparea leziunii vezicale, depozitelor secundare-hepatice etc, adenopatiei ilio-pelvine si lombo-aortice pentru aprecierea operabilitatii cazului.
Sectionarea ligamentelor
Figura 128. Sectionarea
ligamentului rotund si a
vaselor ovariene pe partea dreapta.
- ligamentul rotund si lombo-ovarian
(Fig.128).


a. b.
Figura 129.a,b) Sectionarea ligamentului rotund si a vaselor ovariene pe partea dreapta.
Se incepe disectia pe partea dreapta, unde se sectioneaza si ligatureaza elementele anatomice enumerate mai sus.
Izolarea si sectionarea ureterului, arterei uterine si arterei vezicale inferioare (Fig.130)


a. b.
Figura 130.a,b,c)
Sectionarea
ureterului drept juxtavezical, arterei uterine si arterei vezicale
inferioare.
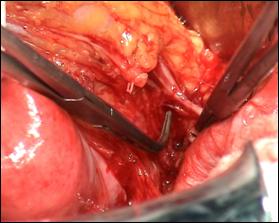
c.
Se izoleaza ureterul pe lasou si se diseca descendent pana la cornul vezicii urinare. Anterior de ureter se intalneste artera uterina si artera vezicala inferioara de partea respectiva, care se vor sectiona intre ligaturi. Juxta-vezical, pe ureter, se pun doua clipuri si se sectioneaza ureterul intre acestea. Se efectueaza aceleasi manevre pe partea stanga. Limfodisectia ilio-pelvina se face in aceeasi maniera, cum a fost descrisa la barbat. Se efectueaza aceiasi timpi operatori (Fig.131.a,b).


a. b.
Figura 131.a,b) Limfodisectia ilio-pelvina.
Se identifica, diseca, ligatureaza si sectioneaza intre ligaturi artera ombilico-vezicala, pe partea dreapta, apoi pe partea stanga.
Incizia peritoneului fundului de sac Douglas (Fig.132.a,b), ligamentelor utero-sacrate, largi (Fig.132.c,d,e) si a peretelui vaginal posterior (Fig.133.a,b, Fig.134.a,b).

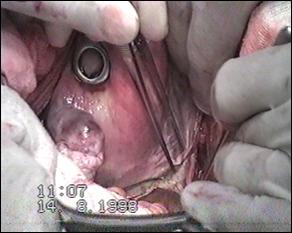
a. b.


c. d.
a. b.
Figura 132.a,b,c,d. Incizia peritoneului in fundul de sac Douglas si
sectionarea ligamentelor utero-sacrate.
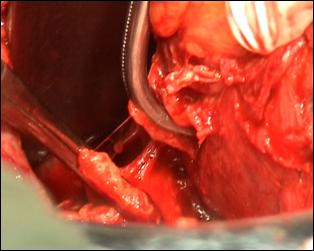
Figura 132.e) Ligatura - sectionarea ligamentului larg pe partea stanga.


a. b.
Figura 133.a,b) Incizia peretelui posterior al vaginului.


a. b.
Figura 134.a,b) Incizia fundului de sac vaginal posterior.
Ridicarea si tractionarea vezicii urinare si a uterului de catre ajutor faciliteaza aceasta manevra. Dupa incizia transversala a peritoneului din fundul de sac Douglas se repereaza ligamentele utero-sacrate si se sectioneaza intre ligaturi. Se decoleaza peretele vaginal posterior de pe rect si se incizeaza transversal. Se retrage mesa din vagin si se continua disectia peretilor vaginali laterali, apoi anterior, circumscriind vaginul. Peretele vaginal anterior este disecat de peretele posterior al vezicii urinare pana la uretra. Aceasta manevra delimiteaza doi pediculi posteriori ce se extind de la vezica urinara la peretii laterali ai vaginului. Se sectioneaza intre ligaturi, eliberand vezica de atasarile posterioare, exceptand uretra.
Cistectomia radicala la femeie se poate termina in doua moduri:
Lasarea uretrei pe loc, in vederea cistoplastiei de substitutie. In aceasta situatie fascia endopelvica nu se deschide, ligamentele rotunde sunt lasate lungi si suturate de bontul vaginal (Ghoneim M) [52,53].
Excizia uretrei, tehnica ce va fi exemplificata in cele ce urmeaza:
Disectia spatiului pubo-vezical. Se incizeaza fascia endopelvina (Fig.135) la nivelul reflexiei pe peretele pelvisului. Se ligatureaza ligamentele pubo-uretrale si vena dorsala a clitorisului (Fig.136).

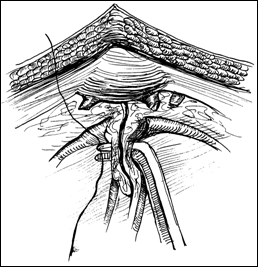
a. b.
Figura 135.a,b) Fascia endopelvina stanga - reflexia pe peretele pelvisului.

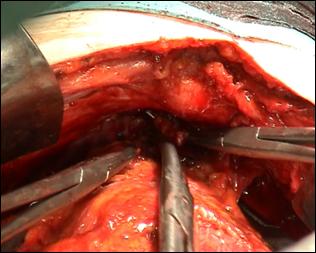
c. d.
Figura 135.c,d) Sectionarea intre ligaturi a grasimii si venelor din Retzius.


a. b.
Figura 136.a,b) Ligatura - sectionarea venei dorsale a clitorisului.
a) Trecerea unui fir de nylon 5 intre complexul venos dorsal si uretra;
b) Sutura proximala cu Vicryl 1-0 pentru prevenirea sangerarii retrograde.
 Expunerea peretelui anterior al
jonctiunii vezico-uretrale este urmata de incizarea transversala
a hemicircumferintei anterioare (Fig.137),
inserarea firelor de Vicryl 3-0, sectionarea hemicircumferintei
posterioare si ridicarea piesei - in caz de efectuare a cistoplastiei de
substitutie sau se practica excizia uretrei in situatia in care
se prevede efectuarea altui tip de derivatie urinara.
Expunerea peretelui anterior al
jonctiunii vezico-uretrale este urmata de incizarea transversala
a hemicircumferintei anterioare (Fig.137),
inserarea firelor de Vicryl 3-0, sectionarea hemicircumferintei
posterioare si ridicarea piesei - in caz de efectuare a cistoplastiei de
substitutie sau se practica excizia uretrei in situatia in care
se prevede efectuarea altui tip de derivatie urinara.
Figura 137. Bont uretral pregatit pentru cistoplastie de substitutie.
Disectia uretrei
 Daca tumora vezicala nu
intereseaza trigonul sau colul vezical si totusi se opteaza
pentru alta derivatie decat cistoplastia de substitutie, se
excizeaza uretra disecand-o pe o sonda uretro-vezicala
inserata preoperator pana la nivelul meatului uretral extern
(Fig.138.a,b).
Daca tumora vezicala nu
intereseaza trigonul sau colul vezical si totusi se opteaza
pentru alta derivatie decat cistoplastia de substitutie, se
excizeaza uretra disecand-o pe o sonda uretro-vezicala
inserata preoperator pana la nivelul meatului uretral extern
(Fig.138.a,b).
La pacientele cu tumora ce penetreaza peretele vaginal se indeparteaza peretele vaginal anterior complet, incizand peretii laterali ai vaginului pana jos la meatul uretral extern (Fig.141).
a.


b. c.
Figura 138 a,b,c. Disectia uretrei.
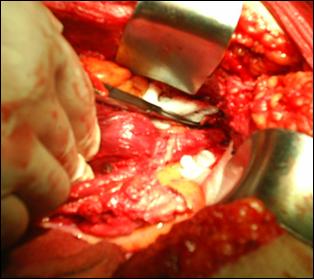

d. e.
Figura 139.d,e) Uretra disecata - vedere anterioara si posterioara.


Fanta uretrala si bontul vaginal suturate cu fire separate de Vicryl 1-0,
la o alta pacienta la care s-a extirpat uretra.
|
Figura 141. Excizia uretrei pe cale vaginala. |
Morbiditate si mortalitate in cistectomia radicala
Mortalitatea post-operatorie este de 3,7% la European Organization for Research on Treatment of Cancer (EORTC); 2,3% la Medical Research Council (MRC) [12] si 1,2% in tarile scandinave.
Morbiditatea postoperatorie este de 30%. Morbiditatea tardiva se datoreaza de obicei derivatiei urinare. Riscul impotentei este mare si dependent de varsta.
Statistica Centrului de Chirurgie Urologica, Dializa si Transplant Renal din cadrul Institutului Clinic "Fundeni" arata o mortalitate de 3% cu o rata a complicatiilor postoperatorii de 13,2% pe 100 de cazuri de cistoplastii de substitutie.
Supravietuirea
Rata supravietuirii la 5 ani este in pT1 este 75%, in pT2 63%, in pT3 31%, in pT4 21% [170].
Elementele T si N sunt singurii factori independenti de prognostic [55].
Pe un lot de 122 [62] de pacienti cu cistectomie radicala pentru tumori vezicale cu urmatoarea stadiere: pT1-10, pT2a-13, pT2b-24, pT3a-19, pT3b-31, pT4a-18, pT4b-7, 79 depacienti au avut ganglionii limfatici ilio-pelvini negativi, iar 43 au avut ganglionii limfatici regionali invadati.
Rezultate
Dintre cei 79 de pacienti cu N0, 1 a decedat post-operator, 4 au fost pierduti din evidenta, 35 (38%) au decedat cu o medie de supravietuire de 13,5 luni, 39 (49,3%) sunt in viata avand o perioada de urmarire de 29,3 luni.
In grupul pacientilor cu N+, 1 pacient a fost pierdut din evidenta, 30 (69,7%) au decedat cu o medie de supravietuire de 11,2 luni, 12 sunt in viata (27,9%) cu o perioada de urmarire de 22,6 luni.
Sunt analizate supravietuirile pacientilor raportate la elementul T, in functie de absenta invaziei ganglionilor limfatici ilio-pelvini (N0) comparativ cu cei cu N+, stratificind pacientii din acest ultim grup in N1, N2 si N3.
Se constata o diferenta semnificativa in T2b si T3a cu 12,6 si respectiv 4,2 luni de supravietuire la grupulcu N0 fata de cel cu N+.
Referindu-ne la pacientii care sunt in viata, diferenta apare in T3a si T3b fiind de 23,8 respectiv de 36,3 luni.
6. Recomandarile din Ghidul EAU
Cistectomia radicala se practica in T2-4a, NxMo si in caz de T1G3 sau Cis recidivat.
Nu se indica radio- sau chimioterapie preoperatorie.
Limfodisectie limitata.
Prezervarea uretrei daca marginile sunt negative.
Supravegherea pacientilor cu cistectomie radicala.
Riscul progresiunii tumorale dupa cistecomie radicala creste cu stadiul tumorii de la 5% in pT1G3 la 100% in N2.
Rata progresiei este mare in primele 24 de luni dupa cistectomie, scade intre 24-36 de luni apoi devine relativ redus. Progresia tumorii poate interesa pelvisul, ganglionii regionali sau juxtaregionali sau pot apare metastaze. Recurentele intraluminale (uretra sau tract urinar superior) sunt intre 5-15%, dintre care circa 50% apar in primele 12 luni.
Recidiva in pelvis reprezinta 15-20%; in ganglionii pelvini sau retroperitoneali 10-15%. Tomografia computerizata abdominala si pelvina le detecteaza in proportie de 35%.
Metastazele la distanta apar in plamani si oase; riscul este mare in primii 2 ani, scade in al 3-lea apoi este relativ redus. Peste 50% din pacientii cu progresie tumorala au metastaze. Se practica radiografie toraco-pulmonara, scintigrafie osoasa, ecografie abdominala (ficat, rinichi).
Recurentele intracavitare - in uretra reprezinta 5-13%. Controlul se face prin citologie cu lavaj si uretroscopie.
Tractul urinar superior se urmareste prin ecografie si prin citologie UIV.
Recomandari
Stadiul tumorii defineste pacientii cu risc de progresie.
Pacientii care traiesc peste 36 de luni de la operatie au un risc net redus.
Urmarirea pacientilor trebuie sa fie foarte corecta pe primele 24 de luni.
Chimioterapia sistemica are un beneficiu net.
7. DERIVATIILE URINARE

246 pacienti cu indicatie de derivatie urinara

19 pacienti (7,7%) s-au prezentat cu anurie.
Figura 142. Derivatiile urinare efectuate pe un lot de 246 de pacienti [58].

Figura 143. Derivatiile urinare pentru tumori vezicale primitive (albastru), respectiv secundare (rosu) [58]. (Legenda : USS - uretrosigmoidostomie ; UCS - ureterostomie cutanata ; CS - cistoplastie de substitutie ; B - derivatia Bricker ; I - derivatia Indiana ; VR - vezica rectala ; NST - nefrostomie).
|
Indicatia de derivatie |
USS |
UCS |
CS |
B |
I |
VR |
NST |
Total |
|
TV primara | ||||||||
|
TV secundara | ||||||||
|
Col uterin | ||||||||
|
Sigmoid si rect | ||||||||
|
Prostata | ||||||||
|
Fistule | ||||||||
|
Vezica neurogena Tuberculoza | ||||||||
|
Total (* 9 inoperabili) |
Figura 144. Derivatiile urinare utilizate la cei 246 de pacienti [58].
|
Derivatia / Complicatia |
USS 50 |
UCS 87 |
CS 34 |
B 41 |
I 10 |
RH 6 |
Total |
|
Precoce | |||||||
|
Decese | |||||||
|
Tardive | |||||||
|
Decese |
Figura 145. Complicatii ale derivatiilor urinare [58](Glck G, Munteanu M, Costache B, Sinescu I - Review of the results and prognosis of different types of urinary diversions. Central European Meeting, 6-7 nov. 2003, Cracovia).
Protocolul Asociatiei Romane de Urologie (ARU) de urmarire a unui bolnav operat, cu tumora vezicala infiltrativa precizeaza urmatoarele: pacientul va fi revazut la 3 luni 2 ani, la 6 luni in al 3-lea an, apoi anual toata viata.
Examinarea consta din:
1. Anamneza si examen clinic
2. Ecografie abdominala
3. Citologie urinara la 3 luni
4. UIV+TC la 6 luni apoi anual
5. Cistoscopie la 6 luni.
Pentru cazurile cu conservarea vezicii urinare cistoscopia se va efectua la 3 luni 2 ani, la 6 luni 2 ani apoi anual.
Cistoscopiile se efectueaza sub rahianestezieie si cu palpare bimanuala.
Fisa de evaluare pentru citologie urinara


Fisa pentru pacientii cu tumora vezicala
 |  |
||

|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 9298
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2025 . All rights reserved