| CATEGORII DOCUMENTE |
| Astronomie | Biofizica | Biologie | Botanica | Carti | Chimie | Copii |
| Educatie civica | Fabule ghicitori | Fizica | Gramatica | Joc | Literatura romana | Logica |
| Matematica | Poezii | Psihologie psihiatrie | Sociologie |
Teoria hibridizarii: Hibridizarea sp si sp2. L. Pauling si J.C. Slater, au elaborat teoria hibridizarii (1931). Conform acestei teorii, în conditii de reactie, orbitalii ocupati cu electroni necuplati care participa la formarea de legaturi covalente, îsi rearanjeaza sarcinile electrice, astfel încât din doi sau mai multi orbitali diferiti ca forma si energie rezulta doi sau mai multi orbitali identici ca forma si energie si perfect simetric orientati în spatiu. Hibridizarea are loc dupa o prealabila modificare a structurii electronice a stratului de valenta, prin saltul unor electroni pe orbitalii cu energie superioara.
Orbitalii hibridizati prezinta proprietati de suprapunere diferite fata de orbitalii puri. De aceea, legaturile chimice realizate de asemenea orbitali sunt mult mai puternice decât cele realizate de orbitalii atomici nehibridizati. Din punct de vedere al mecanicii cuantice, orbitalii hibridizati respecta ecuatia lui Schrödinger deoarece acesti orbitali rezulta prin combinarea liniara a orbitalilor puri încât, asa cum se arata în mecanica cuantica, daca ecuatia este satisfacuta de anumite functii, atunci si combinatiile lor liniare vor fi solutii ale ecuatiei.
Luând ca exemplu carbonul, acesta poate suferi trei tipuri de hibridizare dupa cum urmeaza:
Hibridizarea sp (digonala).
Are loc ori de câte ori carbonul se leaga de alti doi atomi asa cum este cazul acetilenei
H![]() C
C![]() C
C![]() H în care
fiecare atom de carbon se leaga de un atom de hidrogen si unul de
carbon.
H în care
fiecare atom de carbon se leaga de un atom de hidrogen si unul de
carbon.
Atomul de carbon, în stare excitata, având configuratia electronica He, 2s1, 2p3 sufera hibridizare digonala la care participa orbitalul sferic s si un orbital p, doi orbitali p ramânând nehibridizati.
Din aceasta
figura se observa ca cei doi orbitali hibrizi sp sunt coliniari si identici, formând între ei un unghi de 180o.
Acesti orbitali au un caracter mixt,
adica prezinta 1/2 caracter de orbital s si 1/2 caracter de orbital p, încât functia care îi caracterizeaza are forma:![]() în care s-a notat cu s si px
functiile de unda ale electronilor s si p.
în care s-a notat cu s si px
functiile de unda ale electronilor s si p.
Directiile celor patru orbitali ai carbonului vor fi acum conform figurii 2, iar formarea moleculei de acetilena se face cu aparitia legaturii triple, una si doua asemanator formarii moleculei de N2.
Hibridizarea sp este întâlnita si la Be în BeCl2.
Hibridizarea sp2 (trigonala). Are loc ori de câte ori carbonul se leaga de alti trei atomi (de exemplu în etena H2C = CH2). Orbitalii hibrizi se afla într-un plan si sunt orientati perfect simetric în spatiu la 120o.
Legatura dubla care apare este formata dintr-o legatura si una rezultata prin contopirea celor doi orbitali p puri.
Aceasta hibridizare o prezinta
si atomul de bor în BF3. Orbitalii hibridizati sp2 au 1/3 caracter de
orbital s si 2/3 caracter de
orbital p; de aceea functia
care îi caracterizeaza pe fiecare are forma: 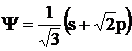
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 452
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2025 . All rights reserved