| CATEGORII DOCUMENTE |
| Astronomie | Biofizica | Biologie | Botanica | Carti | Chimie | Copii |
| Educatie civica | Fabule ghicitori | Fizica | Gramatica | Joc | Literatura romana | Logica |
| Matematica | Poezii | Psihologie psihiatrie | Sociologie |
SARURI IN SOLUTIE
1. Hidroliza sarurilor
La dizolvarea unor saruri in apa, se produce o reactie reversibila intre apa si ionii sarii cu refacerea acidului si bazei din care a provenit sarea, fenomen numit hidroliza (gr. hydar, hydastos, apa + gr. lysis, desfacere, descompunere). In urma reactiei solutia devine acida sau bazica dupa cum acidul rezultat este mai tare decat baza (Ka > Kb) sau invers (Ka < Kb). Pot hidroliza urmatoarele categorii de saruri:
Saruri provenite din acizi tari cu baze slabe ca: NH4NO3, Al2(SO4)3, (NH4)2SO4 etc cand solutia devine acida:
![]() NH4+
+ NO3- + H2O NH4OH + (H+ +
NO3-) (6.37)
NH4+
+ NO3- + H2O NH4OH + (H+ +
NO3-) (6.37)
sau
![]() NH4+ + H2O NH4OH + H+ (6.38)
NH4+ + H2O NH4OH + H+ (6.38)
sau pe caz general
![]() M+ + H2O MOH + H+ (6.39)
M+ + H2O MOH + H+ (6.39)
Saruri provenite din acizi slabi cu baze tari ca: Na2CO3, CH3COONa, KH2PO4, sarurile acizilor organici cu metalele alcaline etc., cand solutia devine bazica:
![]() CH3COO-
+Na+ +H2O CH3COOH+ (Na++
CH3COO-
+Na+ +H2O CH3COOH+ (Na++
sau
![]() CH3COO- + H2O CH3COOH + OH- (6.41)
CH3COO- + H2O CH3COOH + OH- (6.41)
sau pe caz general
![]() X- + H2O HX + OH- (6.42)
X- + H2O HX + OH- (6.42)
Saruri provenite din acizi slabi cu baze slabe ca: (NH4)2CO3, (NH4)2S, CH3COONH4, etc., solutia devenind slab acida sau slab bazica dupa cum Ka > Kb sau Ka < Kb:
![]() CH3COO-
+ NH4+ + H2O CH3COOH + NH4OH (6.43)
CH3COO-
+ NH4+ + H2O CH3COOH + NH4OH (6.43)
Nu hidrolizeaza
sarurile provenite din acizi tari si baze tari ca NaCl sau KCl,
a caror solutie prezinta caracter neutru. Caracteristic pentru
solutiile de saruri hidrolizabile este
Calculul constantei de hidroliza
Pentru prima categorie de saruri reactia generala este:
![]() M+ + H2O MOH + H+ (6.44)
M+ + H2O MOH + H+ (6.44)
la care
 (6.45)
(6.45)
La o hidroliza slaba se consuma putina
apa incat, se aproximeaza concentratia apei dupa
hidroliza ca fiind neschimbata, deci [H2O] = const. De
aceea, se trece in membrul stang [H2O] incluzandu-se in valoarea
constantei de echilibru sub denumirea de
 (6.46)
(6.46)
Inlociund valoarea [H+] din produsul ionic al apei [H+]=Kw/[
 (6.47)
(6.47)
unde [MOH]/[M+][
 (6.48)
(6.48)
Pentru sarurile provenite din acizi slabi si baze tari reactia generala este:
![]() X- + H2O HX + OH- (6.49)
X- + H2O HX + OH- (6.49)
iar Kh calculata dupa procedeul de mai sus devine :
 (6.50)
(6.50)
Pentru a treia categorie de saruri se poate scrie reactia:
![]() M+ + X-
+ H2O MOH + HX (6.51)
M+ + X-
+ H2O MOH + HX (6.51)
si
 (6.52)
(6.52)
Formulele constantei de hidroliza prezinta in toate cazurile
la numarator
Calculul gradului de hidroliza.
Gradul de hidroliza h reprezinta raportul dintre cantitatea de sare care hidrolizeaza si cantitatea totala de sare care se dizolva.
![]() (6.53)
(6.53)
Atunci cand se prepara o solutie 1 molara de sare, numitorul=1, iar relatia (6.53) devine:
h = numarul de molecule de sare hidrolizata.
In acest caz, din reactiile generale ale hidrolizei pentru primele doua categorii de saruri, rezulta:
h = [MOH] = [H+] (6.54)
si
h
= [HX] = [
Daca insa concentratia in sare dizolvata are o valoare c, concentratia in sare hirolizata este ch:
ch = [MOH] = [H+] (6.56)
ch
= [HX] = [
Concentratia in sare ramasa nehidrolizata dupa stabilirea echilibrului, in ambele cazuri, este egala cu diferenta dintre concentratia initiala c si cea hidrolizata ch:
[M+] = c - ch = c(1 - h) (6.58)
[X-] = c - ch = c(1 - h) (6.59)
Efectuand inlocuirea in relatia (6.46) rezulta:
 (6.60)
(6.60)
iar pentru o hidroliza foarte slaba (h 0,01) se aproximeaza ca 1-h 1 si deci relatia (6.60) devine:
Kh=ch2
sau ![]() (6.61)
(6.61)
Deci, gradul de hidroliza creste cu dilutia (definitie asemanatoare cu gradul de ionizare la acizi si baze).
Sarurile provenite din acizi slabi si baze slabe hidrolizeaza dupa reactia (6.51). La echilibru, cantitatea de sare hidrolizata devine conform relatiilor (6.56) si (6.57):
ch = [MOH] = [HX] (6.62)
iar cea a sarii nehidrolizata:
[M+] = [X-] = c(1-h) (6.63)
Inlocuind in relatia constantei de hidroliza, rezulta:
 (6.64)
(6.64)
Daca hidroliza este slaba (h 0,01); 1-h 1, iar relatia (6.64) devine:
![]() (6.65)
(6.65)
Rezulta ca la sarurile provenite din baze slabe cu acizi slabi, gradul de hidroliza nu depinde de concentratia sarii (sau de dilutie).
Calcularea pH-ului solutiilor de saruri.
In cazul unei solutii de sare provenita din acid tare cu baza slaba (relatia 6.44), se observa ca [MOH] = [H+]. La un grad de hidroliza mic, cand h 0,01, se poate aproxima concentratia de sare dupa hidroliza ca fiind egala cu concentratia initiala: [M+] = c. Deci, relatia (6.46) devine:
 (6.66)
(6.66)
Inlocuind valoarea constantei Kh (din relatia 6.48) rezulta:
 (6.67)
(6.67)
iar prin logaritmare:
lg[H+] = 1/2lgKw - 1/2lgKb + 1/2lgc (6.68)
sau pH = 7 + 1/2lgKb - 1/2lgc (6.69)
Rationamente asemanatoare duc la urmatoarea relatie a pH-ului unei solutii de sare provenita din acid slab si baza tare:
pH = 7 - 1/2lgKa + 1/2lgc (6.70)
iar pentru sarurile provenite din acizi slabi si baze slabe:
pH = 7 - 1/2lgKa + 1/2lgKb (6.71)
Rezulta din ultima relatie ca sarurile provenite din acizi slabi si baze slabe au in solutie pH-ul independent de concentratie, spre deosebire de celelalte tipuri de saruri.
Cunoasterea fenomenului de hidroliza este deosebit de importanta pentru aprecierea ingrasamintelor chimice in sol, in solutii nutritive etc. Hidroliza are insa foarte multe aplicatii in chimia organica si biochimie. Numeroase substante sunt obtinute pe cale industriala prin reactii de hidroliza. Astfel, pentru exemplificare, se da reactia generala de hidroliza a derivatilor halogenati la alcooli in prezenta NaOH:
![]() R-X + H2O R-OH + HX
R-X + H2O R-OH + HX
Asemenea reactii mai pot fi date in general de derivatii functionali ai acizilor (esteri, nitrili, amide, halogenuri de acizi), derivatii substituiti ai acizilor (acizi halogenati, hidroxiacizi) ca si de numeroase alte substante. In domeniul biochimiei, numeroase reactii care se petrec in organismele vegetale si animale decurg cu ajutorul enzimelor, in special cu ajutorul hidrolazelor capabile sa hidrolizeze foarte multe substante. In numeroase cazuri, lupta impotriva poluarii apelor si solului se face pe cale hidrolitica, utilizandu-se enzimele.
2. Solutii tampon
Solutiile de acizi si baze isi modifica foarte mult pH-ul la diluare sau la adaugare de acid sau baza. Exista insa solutii care isi mentin practic pH-ul la diluare sau la adaugare de acid sau baza, datorita proprietatii de a opune un fel de rezistenta elastica oricarei incercari de a le mari sau micsora concentratia in ioni de hidrogen. Aceste solutii poarta numele de solutii tampon.
Solutiile tampon sunt formate din amestecuri de acid slab si o sare a sa cu o baza tare, precum si dintr-o baza slaba si o sare a sa cu un acid tare, de exemplu:
Acid acetic + acetat de sodiu;
Acid carbonic + carbonat de sodiu;
Acid fosforic + fosfat de sodiu;
Hidroxid de amoniu + clorura de amoniu etc.
Mecanismul de functionare a solutiilor tampon. La incercarea de marire a aciditatii unei solutii tampon prin adaos de acid, anionul sarii din amestecul tampon formeaza cu ionul H+ adaugat un acid slab ionizat opunandu-se cresterii aciditatii, iar la adaugare de baza, ionul de hidrogen al acidului din amestecul tampon formeaza apa cu ionul OH- opunandu-se astfel cresterii bazicitatii. Pentru exemplificare, se ia un amestec tampon format din acid acetic + acetat de sodiu. In solutie acidul acetic ionizeaza foarte putin fiind un acid slab. Solutia va contine in totalitatea ei deci un numar mare de molecule de acid acetic, dar si un numar mare de ioni acetat proveniti prin disocierea acetatului de sodiu care, disociaza total fiind un electrolit tare.
La adaos de HCl se produce reactia:
CH3COOH + (CH3COO- + Na+) + (H+ + Cl-) 2CH3COOH + (Na+ + Cl-) (6.72)
cand se consuma ionii H+ adaugati de catre CH3COO- din sare, cu formare de molecule de acid.
La adaos de NaOH se produce reactia:
CH3COOH +
(CH3COO- + Na+) + (Na+ +
2(CH3COO- + Na+) + H2O (6.73)
cand se consuma ionii
![]() (CH3COO-
+ Na+) + H2O CH3COOH + (Na+ +
(CH3COO-
+ Na+) + H2O CH3COOH + (Na+ +
dar gradul de hidroliza fiind slab, va rezulta o cantitate de ioni
Calculul variatiei de pH a solutiilor tampon. Se considera amestecul tampon HX + MX, in care acidul slab va ioniza dupa ecuatia:
![]() HX + H2O H3O+ + X- (6.75)
HX + H2O H3O+ + X- (6.75)
Cum [H3O+] = [X-],
 (6.76)
(6.76)
Facand abstractie de faptul ca protonul este hidratat, in loc de H3O+ se va folosi in continuare H+, deci:
![]() (6.77)
(6.77)
in care [HX], concentratia acidului ramas neionizat, se aproximeaza ca fiind egala cu concentratia initiala a acidului Ca. Conform relatiei (6.77), pH-ul dat numai de acid va fi:
![]() (6.78)
(6.78)
In solutia tampon existand si sarea MX, pH-ul este influentat de prezenta acesteia, iar valoarea sa se calculeaza din relatia (6.76), unde:
 (6.79)
(6.79)
La echilibru, concentratia ionilor X- poate fi considerata egala cu concentratia sarii Cs, deci [X-] = Cs, incat, inlocuind in relatia (6.79) pe [HX] cu Ca, relatia devine:
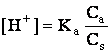 (6.80)
(6.80)
deci:
pH = -lgKa - lgCa + lgCs (6.81)
Relatia (6.80) arata ca in solutiile tampon, concentratia ionilor H+ depinde de constanta de aciditate a acidului slab si de raportul concentratiilor componentilor (acid si sare) si nu depinde de dilutie. De aceea, o solutie tampon acid acetic-acetat de sodiu diluata de 10 ori, isi modifica pH-ul numai cu 0,02 unitati de pH, iar diluata de 100 ori, cu 0,1 unitati de pH.
Aplicatie. Pentru exemplificarea numerica a calculelor teoretice de mai sus, se ia un amestec tampon acid acetic-acetat de sodiu pentru o concentratie a ambelor componente egala cu 0,1m.
![]()
de unde, conform relatiei (6.77):
![]() ,
,
iar pH-ul solutiei de acid este:
pH = 3-lg1,4 = 3-0,1 = 2,9.
In prezenta acetatului, disociatia acidului este usor micsorata incat, inlocuind in (6.80), se obtine:
![]()
Deci, pH-ul solutiei tampon este:
PH = 5-lg2 = 5-0,3 = 4,7
(este de observat ca prin adaugarea acetatului de sodiu, solutia de acid acetic si-a modificat pH-ul de la 2,9 la 4,7).
Daca in aceasta solutie tampon (la care Ca = Cs) se adauga HCl in proportie de 10% creste concentratia acidului (HX = 100 + 10 = 110) si scade concentratia sarii (MX = 100-10 = 90). Inlocuind in relatia (6.80) se obtine:
![]()
iar
pH = 5-lg2-lg1,22 = 5-0,3-0,09 = 4,61.
Deci, adaugand 10% HCl, pH-ul s-a modificat de la 4,7 la 4,61.
La adaugare de NaOH in proportie de 10% fata de HCl, relatia (6.80) devine:
![]()
pH = 5 - lg2 - lg0,81 = 5 - 0,3 - 0,09 = 4,79
Nu orice amestec tampon are aceeasi putere de tamponare,intelegand prin aceasta, puterea de a mentine pH-ul constant. Puterea de tamponare acido-bazica P se poate exprima prin indicele de tamponare, care consta in raportul dintre adaosul de acid tare sau de baza tare dL, exprimat in echivalenti la litru si variatia pH-ului:
P = dL / dpH (6.82)
Odata depasita aceasta capacitate de tamponare a amestecului tampon, pH-ul solutiei va fi dat de excesul de acid tare sau de baza tare adaugat. Deci, actiunea de tamponare este limitata de capacitatea de tamponare.
La un amestec tampon ce contine un acid slab si sarea sa cu o baza tare, pH-ul nu depinde practic de temperatura, in timp ce la solutiile tampon formate din baze slabe si sarurile lor cu un acid tare, pH-ul depinde sensibil de temperatura. Alegerea amestecului tampon se face in functie de valoarea pH-ului ce trebuie mentinut constant precum si de sistemul ce trebuie tamponat deoarece, componentii solutiei tampon pot interveni in reactii perturband procesele studiate. Exista tabele cu diferite sisteme tampon.
Solutiile tampon indeplinesc un rol deosebit in fenomenele biochimice care se produc in organismul animal si vegetal, sub actiunea catalitica a unor enzime. In cazul cand se produce o modificare a pH-ului, mediul lupta de la sine printr-un sistem de tamponare de care dispune, pentru mentinerea echilibrului. In sange, pH-ul este mentinut constant prin actiunea a doua sisteme tampon: fosfat monosodic-fosfat disodic si acid carbonic-bicarbonat de sodiu. Sistemele tampon au o mare importanta in agricultura. Solul arabil manifesta o actiune de tamponare pronuntata cu ajutorul fosfatilor, carbonatilor si al complexului adsorbtiv din sol. Solurile bine tamponate sunt cele mai favorabile unei bune dezvoltari a culturilor, ele fiind cele mai putin predispuse la modificarea pH-ului sub influenta diferitilor factori fizici si in special chimici, cum sunt ingrasamintele chimice.
In analiza chimica, mentinerea
3. Electroliti greu solubili. Produs de solubilitate.
Cand se dizolva in apa un electrolit solid MX greu solubil, ionii de pe suprafata cristalului trec in apa si se hidrateaza. In acelasi timp se petrece si procesul invers, cristalizarea, cand ionii din solutie se depun pe suprafata cristalului. Vitezele de dizolvare si cristalizare sunt egale cand solutia devine saturata si se stabileste un echilibru intre substanta solida si cea din solutie:
![]() MX(s) M+(aq) + X-(aq) (6.83)
MX(s) M+(aq) + X-(aq) (6.83)
In mod cu totul asemanator, la precipitarea unui electrolit binar greu solubil MX ca AgCl, foarte putine molecule se dizolva dar toate moleculele dizolvate se disociaza in ioni, sarea fiind un electrolit tare.
 (6.84)
(6.84)
In procesul de dizolvare sau de cristalizare a substantelor ca
si in procesul precipitarii, la echilibru, deoarece cantitatea fazei
solide variaza foarte putin, activitatea ei ramane
![]() (6.85)
(6.85)
Intr-o solutie
saturata de electrolit care se gaseste in contact cu faza
solida, produsul activitatilor ionilor lui este o marime
Inlocuind concentratiile active a cu cele reale (efective) c si tinand seama ca a=fc, ecuatia (6.85) devine:
![]() (6.86)
(6.86)
In cazul frecvent intalnit la electrolitii greu solubili cand
coeficientul de activitate f=1,produsul concentratiilor molare ale ionilor
este o marime
[M+][X-] = KPS (6.87)
In exemplul amintit al precipitarii AgCl din AgNO3 si HCl, precipitatul se afla in echilibru cu ionii din solutie:
![]() AgCl(s) Ag+(aq) + Cl-(aq) (6.88)
AgCl(s) Ag+(aq) + Cl-(aq) (6.88)
Produsul de solubilitate este:
KPS = [Ag+][Cl-] (6.89)
Considerand c concentratia fiecarui ion din solutie, iar concentratia oricarei solutii saturate egala cu solubilitatea S0 a substantei dizolvate, relatia (6.89) devine pentru toti compusii formati din doi ioni:
KPS = c2 = S02 (6.90)
Pentru cazul general al electrolitilor greu solubili MnXm in contact cu solutia, exista echilibrul:
![]() MnXm nMm+ + mXn- (6.91)
MnXm nMm+ + mXn- (6.91)
iar produsul de solubilitate:
KPS = [Mm+]n [Xn-]m (6.92)
Relatia de definitie a produsului de solubilitate arata ca prin modificarea concentratiei unui singur ion, de exemplu adaugand solutiei un ion comun, echilibrul se deplaseaza precipitand o parte din electrolit, sau, daca produsul concentratiilor exprimate in ioni gram depaseste valoarea produsului de solubilitate, are loc precipitarea electrolitilor chiar fara adaos de ioni comuni. Precipitarile si solubilizarile substantelor existente in sol se conduc dupa acest principiu. Adaugarea de ioni comuni (reactiv) in apa de spalare a precipitatelor la analiza chimica gravimetrica, are drept scop depasirea produsului de solubilitate si deci precipitarea cat mai completa a ionului analizat.
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 4340
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2025 . All rights reserved