| CATEGORII DOCUMENTE |
| Demografie | Ecologie mediu | Geologie | Hidrologie | Meteorologie |
Controlul emisiilor de SOx
Aceasta lucrare se concentreaza pe studiul emisiilor de dioxid de sulf deoarece acestea sunt principalele surse de emisii de sulf si principala cauza a apariției ploii acide. Vor fi analizate si alte surse de emisii cum ar fi H2S, SO3 si vaporii de acid sulfuric. Datorita faptului ca unele tehnologii de control a SO2 sunt aplicate direct pentru controlul HCl, se va face si o analiza succinta a emisiilor de acid clorhidric.
Cea mai mare parte din emisiile de sulf sunt generate de arderea carbunelui pentru a produce electricitate. O distribuție aproximativa a surselor ce genereaza SO2 este prezentata in Figura 1. Tendința descendenta a emisiilor de SO2, care este rezultatul incercarilor de a controla emisiile de SO2, este schițata in Figura 2. Declinul liniei de tendința inregistrat in 1995 a fost rezultatul implementarii Fazei I pentru controlul ploii acide care corespunde prevederilor Documentului IV din Prevederile Legii Aerului Curat.
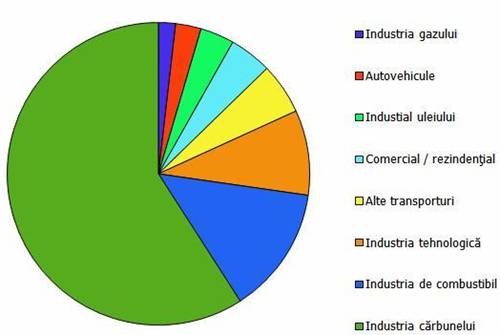
Figura 1. Sursele emisiilor de SO2
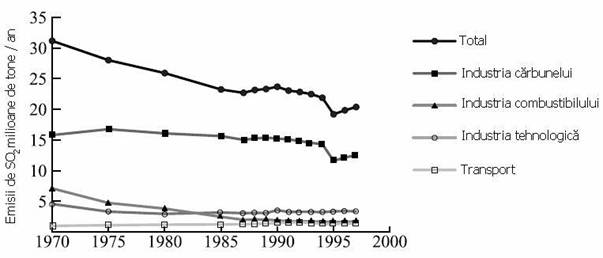
Figura 2. Tendința emisiilor de SO2
Suflul exista in mod natural in combustibili. In carbune, se gaseste sub forma de pirita, FeS2, sulfați minerali, sulfura elementara, si compusi organic si mercaptanți. Carbunii cu un procentaj mare de sulf au o concentrație de 2-5%. Cei cu un procentaj mic au mai puțin de 1%. In afara de carbunii de ardere, sursele care genereaza emisii de sulf mai sunt si rafinarii petroliere, instalații de producere a uleiului si gazului, sulf si acid sulfuric industrial, topirea minereului, instalații de incinerare a deseurilor, instalații de ardere a cocsului petrolier.
Emisiile de sulf ca si sursa de poluare a aerului, pot fi evitate prin intermediului unor procese care elimina sulfulul din carbune inainte ca acesta sa fie ars. Prin procesul de curațare a carbunelui se poate elimina un procentaj de 30-50% din sulful mineral. Spalarea este insa un proces costisitor si necesita anumite cercetari stiințifice referitoare la flotația spumei, spalarea magnetica, eliminarea fonica, oxidarea chimica si aglomerari selective.
1 Controlul H2S
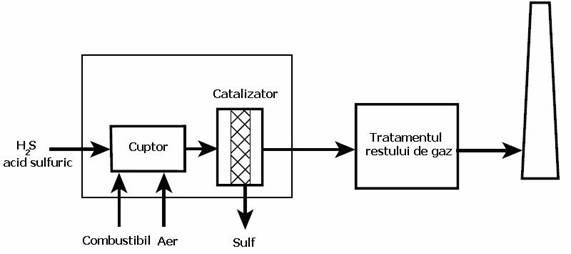
H2S este un poluant des intalnit in instalațiile de prelucrare a petrolului si a gazelor natural. Multe instalții au in componența unitați de recuperare a sulfului care transforma H2S in sulf elementar folosind metoda Claus (Desulfurare). O diagrama simplificata a acestui proces este prezentata in Figura 3. In acest proces in doua etape o parte din H2S este transformat in SO2. Procesul de combustie trebuie controlat cu multa atenție pentru a se putea obține concentrația molara de 2 moli de H2S pentru fiecare mol de SO2. Pasul urmator consta in trecerea amestecului de H2S si SO2 deasupra catalizatorului, unde H2S este oxidat si SO2 este redus pentru a putea produce sulf elementar prin intermediul reacției:
![]() 2H2S + SO2 2H2O + 3S (1)
2H2S + SO2 2H2O + 3S (1)
Prin intermediul procesului Claus se poate obține o concentrație de 93-97% de sulf recuperat. Cu toate acestea gazele de esapament, numite coada de gaz, pot conține mici cantitați de substanțe chimice netratate cum ar fi H2S, SO2, sulfura de carbon (CS2), sulfat de carbonil (COS) si sulful octoatomic (S8).
 Unele
metode incineaza coada de gaz pentru a transforma diferite feluri de sulf in SO2
inainte de a fi evacuate in atmosfera. Exista insa o varietate de
posibilitați pentru a elimina emisiile de SO2. Tipurile de sulf
pot fi hydrogenate in H2S urmand ca
apoi un proces de eliminare a H2S
sa trateze coada de gaz. Alternativ atat H2S cat si SO2,
pot fi absorbite si este utilizat in faza de reacție, pentru producerea
sulfului, un lichid. O alta metoda ar fi folosirea unui sistem de eliminarea a
SO2 pentru coada de gaz.
Unele
metode incineaza coada de gaz pentru a transforma diferite feluri de sulf in SO2
inainte de a fi evacuate in atmosfera. Exista insa o varietate de
posibilitați pentru a elimina emisiile de SO2. Tipurile de sulf
pot fi hydrogenate in H2S urmand ca
apoi un proces de eliminare a H2S
sa trateze coada de gaz. Alternativ atat H2S cat si SO2,
pot fi absorbite si este utilizat in faza de reacție, pentru producerea
sulfului, un lichid. O alta metoda ar fi folosirea unui sistem de eliminarea a
SO2 pentru coada de gaz.
Figura 3 Unitați de recuperare a petrolului si uleiul prelucrat
2 eliminarea so2 (si a hcl)
o varietate de procese sunt disponibile pentru a controla sistemele de tratare a emisiilor de SO2 si HCl. Selectarea celei mai bune metode pentru fiecare facilitate, trebuie sa includa comparații intre capitalul disponibil si costurile operațiilor. Considerații suplimentare cuprind masuri de operabilitate, mentabilitate, preferințe specifice pentru tratarea namolurilor, soluțiilor apoase si a pudrei uscate.
Procesele de control a SO2 sunt folosite pentru boilerele industriale pe carbuni, calcinatoarele de cocs si regeneratoarele catalizante. Controalele emisiilor de SO2 si HCl sunt necesare pentru deseurile combustibililor solizi municipali. Controlul HCl este folosit pentru cuptoarele de aluminiui care folosesc pentru topire clor si pentru clorinare regeneratoare. Desulfurarea gazului de combustibil este necesara in industria producerii de electricitate folosind carbuni. Multe metode din aceasta industrie folosesc calcar umed care au un cost de capital relativ mare, in ordine pentru a utilize reactivi de calcar mai ieftini, cu toate ca uneori sunt folosite alte sisteme .
2.1. REACTIVI
Selectarea reactivilor potriviți reprezinta o decizie cheie care afecteaza atat procesele de creare cat si costul de operare. Reactivii comuni si costurile aproximative ale acestora sunt listate in Tabelul 1
2.1.1. Reacțiile de baza ale calciului
Calcarul este o piatra ieftina care este extrasa si sfarmata. Poate fi folosita direct fie ca reactiv, fie in namolul apos, sau prin injectare in namol unde caldura carbonizeaza calcarul. Varul caustic este produs prin calcinarea calcarului datorita unei cereri mari de energie.
![]() CaCO3
+ caldura CaO + CO2 (2)
CaCO3
+ caldura CaO + CO2 (2)
Tabel 1
|
Reactivi chimici |
|||
|
Denumire uzuala |
Denumire chimica |
Formula |
Cost ($/tona) |
|
Calcar |
Carbonat de calciu |
CaCO3 |
25$a |
|
Var caustic |
Oxid de calciu |
CaO |
57$b |
|
Var stins |
Hidroxid de calciu |
Ca(OH)2 |
70$b |
|
Soda calcinata |
Carbonat de sodiu |
Na2CO3 |
105$c |
|
Soda caustica |
Hidroxid de sodiu |
NaOH |
200$d |
|
Nacolitae |
Bicarbonat de sodiu |
NaHCO3 |
260$c |
|
Tronaf |
Hidrogenbicarbonat de sodiu |
|
65$c |
|
a - costul va fi mai mic pentru cantitați mai mari b - transportul asigurat c - transportul asigurat d - transportul asigurat e - nacolita este un tip de bicarbonate de sodiu care conține impuritați. Poate fi rafinat pentru a elimina toate impuritațile f - trona este un tip de sexacarbonat de sodiu care conține impuritați. Poate fi rafinat pentru a elimina toate impuritațile |
|||
Stingerea sau hidratarea varului caustic produce var stins sau hidratat care este mult mai scump:
![]() CaO + H2O Ca(OH)2 (3)
CaO + H2O Ca(OH)2 (3)
Calcarul umed proaspat spalat produce compusi de reacție numiți trisulfat de calciu si sulfat de calciu. Oxidarea de la trisulfat la sulfat poate fi oprita prin adaugarea unei substanțe emulsionate de sulf, care duce la formarea ionilor de trioxidsulfat. Alternativ, oxidarea poate fi imbunatațita prin introducerea unei mase de aer in namolul conținut de rezervorul reactorului.
![]() CaCO3 + SO2 + 1/2H2O CaSO3 /2H2O + CO2 (4)
CaCO3 + SO2 + 1/2H2O CaSO3 /2H2O + CO2 (4)
![]() 2CaSO3
/2H2O +3H2O + O2 2CaSO4 2H2O (5)
2CaSO3
/2H2O +3H2O + O2 2CaSO4 2H2O (5)
Calcarul umed proaspat spalat, pulberi de var uscat si produsii varului hidratat poate de asemenea forma un amestec de trisulfat de calciu si sulfat de calciu:
![]() Ca(OH)2 + SO2 CaSO3 /2H2O + 1/2H2O (6)
Ca(OH)2 + SO2 CaSO3 /2H2O + 1/2H2O (6)
![]() Ca(OH)2
+ SO2 + 1/2O + H2O CaSO4 2H2O (7)
Ca(OH)2
+ SO2 + 1/2O + H2O CaSO4 2H2O (7)
2.1.2 Produsii reacția calciului
Trisulfatul de calciu este un produs de reacție format in timpul procesului de spalare a calcarului. Are forma de cristala ascuțite care sunt greu de prespalat datorita suprafeței mari. Nu are nici o valoare pe piața si necesita o oxidare chimica. Se poate depozita, dar trebuie sa fie stabilizata pentru a imbunatați proprietațile de incarcare.
Pe de alta parte, trisulfatul de calciu produs in timpul procesului de oxidare are anumite caracteristici dorite. In primul rand formeaza blocuri de cristale care sunt usor de prespalat. De asemenea, trisulfatul de calciu pur este ipsos, care poate fi folosit pentru a fabricarea placilor de fibre. Deseurile solide uscate formate in sistemele tipice de uscare a calciului conțin aproximativ 75% trisulfat de calciu si 25% sulfat de calciu. Poate fi depozitat, dar orice reactive netratat din deseuri va produce o levigare cu un pH ridicat.
2.1.3 Reacțiile sodiului
Spalarea sodiului - Drept reactivi pot fi folosiți atat cenusa cat si soda caustic. Se produce astfel o soluție curata cu un pH ridicat. Cei doi reactivi au adesea costuri comparative, cu toate ca cenusa tinde sa fie puțin mai ieftina. Soda caustica si soluția de cenusa poate fi folosita la mai multe spalari. Soda caustica se vinde de regula cu o concentrație de 50% de compusi de NaOH. Resturile solide stocate, acizi solizi si soluții dizolvate sunt necesare pentru a prepara soluția de cenusa. Prețul de piața pentru soda caustic tinde sa varieze mai mult decat la alți reactivi, in timpul cererii de piața. Pentru a putea fi competitivi furnizorii de soda caustic ofera adeseori posibilitatea includerii in cost si a transportului. Cenusa de soda este dizolvata in apa pentru a face o soluție lichida de spalare.
![]() (8)
(8)
![]() (9)
(9)
Soda caustica este de obicei vanduta avand o concentrație de 50%, care elimina necesitatea unui echipament de tratare a solizilor.
![]() (10)
(10)
Primul pas in spalarea alcalina este absorbția lui SO2 intr-o soluție apoasa. Procesul de alcalinizare patreaza un echilibru al reacțiilor, care previne producerea acidului sulfuric prin limitarea solubilitații substanței gazoase SO2:
![]() (11)
(11)
Acidul sulfuric separa compusii de sulfat sau bisulfate, depinzand de pH:
![]() (12)
(12)
Prin urmare, majoritatea reacțiilor cu SO2 produc un amestec de sulfura de sodium, sulfat de sodiu si bisulfate de sodiu. Cantitațile exacte de tipuri de sulfura depend de pH si gradul de oxidare. Reacțiile simplificate sunt:
![]() (13)
(13)
![]() (14)
(14)
![]() (15)
(15)
pH-ul este o variabila important care afecteaza solubilitatea gazului de SO2 la fel de bine ca si reactivii de consum. Este necesara existența a doi moli de sodiu pentru a elimina un mol de SO2 ca sulfat, insa numai un mol sodiu pentru a elimina un mol de SO2 ca bisulfate. Cu toate acestea este necesara existența unui lichid de spalare pentru a masca usorul dezechilibru a concentrațiilor tuturor tipurilor de sulf dizolvat la valori mici ale pH-ului. De asemenea, daca este necesara prezența in apa uzata a procesului de aerare pentru a se reusi eliminarea cererii de oxidare chimica a sulfatului si bisulfatului, produsul final eliminat este sulfatul de sodiu, care are nevoie de doi moli indiferent de valoarea pH-ului.
Sisteme bazate pe sodiu uscat - In momentul in care este expus la caldura, bicarbonatul de sodiu uscat se descompune pentru a produce o mare cantitate de soda calcinata uscata. Aceasta reacționeaza cu SO2 la temperaturi de 300-600 F, care este temperatura optima de evacuare a gazelor.
![]() (16)
(16)
![]() (17)
(17)
Bicarbontul de sodiu poate fi procurat ca un mineral rafinat, sau ca nahcolita, un mineral natural izotop. Trona care este un izotop natural de sestacarbonat, poate fi folosit drept un reactiv uscat. Compoziția sa, aratata in tabelul 1, este formata jumatate din bicarbonat de sodiu si jumatate din carbonat de sodiu.
2.1.4. Produsi reactanți de sodiu
Procesele bazate pe sodiu genereaza sulfat acid de sodiu (NaHSO3), suflat de sodiu (NaSO3) si sulfura de sodiu (NaSO4). Aceste saruri de sodiu sunt solubile in apa, care poate crea o problema de eliminare in anumite regiuni. Lichidul uzat rezultat din aceste sisteme spalate nu poate fi descarcat in ape curate. Cu toate acestea, in unele zone din preajma oceanului, eliminarile sunt mult mai usor de realizat deoarece pot fi descarcate dupa stabilirea pH-ului si dupa realizarea aerației.
2.2. Veniturile versus Cheltuielile de exploatare
Comparația dintre venituri si cheltuielile de exploatare necesita o buna estimare a costurilor instalației pentru intregul sistem. Aceste comparații au fost realizate pentru un numar mare de central electrice pe carbuni. Cu toate acestea, comparațiile nu sunt perfecte pentru sisteme industriale mici. Pentru a realiza un proces cat mai bun de selecție a sistemelor industrial trebuiesc facute comparațiile intre venituri si cheltuieli.
2.2.1. Cheltuieli de exploatare
Cele mai mari cheltuieli de exploatare se inregistreaza cu reactivii, care pot fi estimate pentru un numar mare de sisteme. Costurile electrice si cu eliminarea produsilor uzați sunt semnificative pentru cheltuielile de exploatare. Calcarul ud, reactivii si costurile cu electricitate si cu produsii uzați contribuie in masura de 33% la totalul costurilor. Uscarea prafului de var sau circularea sistemelor de var nestins, au contribuit in proporție de 60%, 15% si respective 25%. De asemenea, la valoarea totala trebuiesc incluse si costurile de tratare si de intreținere.
Cantitatea de reactive adaugata procesului este cuantificata in funcție de rația reactivului. Aceasta este definita ca fiind raportul dintre masa reacitivului adaugat la cantitatea stoichiometrica a reactivului necesar pentru a reacționa cu poluanții din fluxul gazului.
Rata reactivului de calciu = (19)
|
moli de calciu adaugați in plus |
|
moli de Ca++ necesari de catre stoichiometrie pentru a elimina in proporție de 100% SO2 si HCl din fluxul de gaz |
A se ține cont de faptul ca aceasta formula a ratei reactivului este folosita in industria de eliminare a acidului gazos uscat sau semi-uscat. Este diferita fața de definiția obisnuita a ratei reactivului folosit pentru eliminarea carbonatului de calciu umed. Pentru a fi cat mai consecvent, rata reactivului detaliat in aceast capitol este bazata pe molii poluanților din fluxului de gaz.
Rata reactivului de sodiu = (19)
|
moli de Na+ adaugați in plus |
|
moli de Na+ necesari de catre stoichiometrie pentru a elimina in proporție de 100% SO2 si HCl din fluxul de gaz |
Costul reactivilor pe tona de poluanți eliminați este:
sssssssssssss$ssssssssssssss = rata reactivului x moli de Ca++ sau Na+ x mmmoli de reactivi
Tonele de poluanți eliminați moli de poluanți moli de Ca++ sau Na+
x MW reactivnn x % puritatea reactivului
MW poluanți 100%
x 100 x $ reactivi + transport
% poluanții eliminați tona de reactivi
2.3. Procesul de eliminare a SO2
Cateva procese comerciale pentru eliminarile de SO2 sunt expuse in tabelul 2 si sunt detaliate in cele ce urmeaza.
|
Proces |
Eficiența |
Cheltuieli de investiție |
Cheltuieli cu reactivul |
Complexitate |
Observații |
|
Calcar umed |
Ridicata |
Mari |
Mici |
Ridicata |
Costurile mici ale reactivului compenseaza costul mare al operației si al mentenanței in sisteme complexe. |
|
Soda caustica |
Ridicata |
Moderate |
Mari |
Moderata |
Nu este necesara tratarea namolului sau a substanțelor solide. Proces eficient pentru sisteme simple. |
|
Praf de var |
Moderat |
Moderat |
Moderat |
Moderat |
O tehnologie clasica folosita pentru aplicații industriale. |
|
Reactor de circulare a varului |
Moderat spre ridicat |
Moderat |
Moderat |
Moderat |
Rata de circulație a solidelor grele previne depozitele de acumulari. |
|
Bicarbonatul de sodiu/injecție cu trona |
Moderat |
Mici |
Mari |
Joasa |
Costurile joase ale tronei au un avantaj mare in procesele cu HCl. |
2.3.1. Calcarul umed
Procesul de eliminare a pietrei de var este aratat in figura 4.
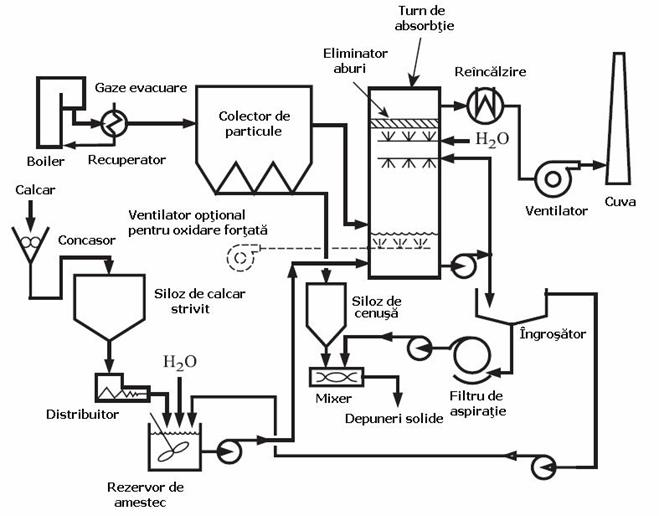
Figura 4. Procesul de
eliminare a calcarului (Desenat de American
Instalația cuprinde de regula concasor de calcar, siloz de reținere, filtru turn rezistent la coroziune cu eliminator de aburi, rezervor de amestec, pompe de namol, separator, filtru de aspirație, ventilator de aspirație si cuva rezistenta la coroziune sau reincalzire. Ventilatoare suplimentare sunt necesare pentru a forța procesul de oxidare. Eliminarea suplimentara este efectuata deobicei in amonte, de catre precipitatorul electrostatic, dar se poate realiza si i naval sau ca o parte integranta a absorbitor. De exemplu, un epurator Venturi realizat pentru controlul particulelor poate fi utilizat ca dublura a absorbitorului in momentul in care namolul calcarului este utilizat ca lichid de lucru.
Spalarea calcarului umed este procesul cel mai greu de realizat pentru centralele electrice pe carbuni. Cheltuielile mari de investiție precum si cele legate de operarea si mentenanța sistemelor complexe sunt compensate de costul mic al calcarului folosit pentru a elimina o mare cantitate de SO2.
In mod natural, calcarului umed tratat este dificil de prelucrat deoarece apare problema oixidarii. Oxidarea parțiala a sulfitei de calciu in sulfat de calciu produce cristale de sufl pe vase, pereții țevilor, si aparatura. Aceasta problema a fost rezolvata in mare masura prin folosirea unei oxidari forțate. In ziua de azi, tratarile calcarului sunt mult mai mult fiabile. Absorbitoarele simple sunt considerate pentru cazane importante economii de costuri. Oxidarea forțata foloseste sufl emulsionat drept aditiv pentru a putea produce ioni de trisulfat, care opresc oxidarea sulfitei in sulfura.
![]() (21)
(21)
Namolul de var nestins poate fi folosit pentru a umidifica
si a injecta varul o singura data, dar necesita un dispozitiv de stingere a
varului, o pompa de namol si o duza de namol rezistenta la abraziune. De
asemenea, necesita aer comprimat pentru a atomiza namolul.
Racirea cu un schimbator de caldura aer-gaz evita utilizarea de apa, dar adauga
costul schimbatorului. Aceasta este o abordare atractiva in aplicatii in care
apa este
insuficienta sau unde se foloseste recuperarea de caldura latenta.Pentru ca
procesul de recirculare a varului nestins poate functiona la o temperatura mai
mica de abordare decat uscarea varului nestins, procesul de recirculare are o
utilizare mai buna ca reactiv. Acest lucru ofera procesului de recirculare a
varului nestins un avantaj de pret.
2.3.5 Bicarbonat de sodiu / Injectarea cu sescvicarbonat de sodiu
Fluxul
tehnologic al procesului bicarbonatului de sodiu este prezentat in Figura 9. Procesul
de baza al injectiei de sescvicarbonat de sodiu este acelasi, cu
toate ca reactivul si costurile sunt diferite.
Echipamentul include rezervorul de stocare al reactivilor,canalul de alimentare,
turbosuflanta pentru injectare pneumatica,
colectorul de particule, conducta de lucru din otel carbon, ventilator si stiva. Acesta este un sistem foarte simplu ce are
cerinte minime de operare si intretinere.
Bicarbonatul de sodiu se decarbureaza in
intervalul de temperaturi de 300 - 500 F. Acesta este intervalul tipic pentru
gazele de ardere din sistemele de combustie incalzitoare de aer sau recuperare
de caldura. Procesul de decarbonare transforma
particulele in "popcorn", creind o suprafata
mare de reactive si expunand reactivul proaspat, care a fost acoperit de
produsele din reactie. In timp ce reactivul este Na2CO3, injectarea mai putin
costisitoare de Na2CO3 nu functioneaza bine deoarece efectul de "popcorn" este
important pentru reactie. Procentul de 90% al eliminarii
de SO2 poate fi atins cu bicarbonat de
sodiu la o proportie de aproximativ 1.2
moli Na / mol SO2. Trona este un reactiv alternativ. Folosirea sa poate reduce
costul reactivului, in special in aplicatiile de HCl. In aplicatiile cu
SO2,trona are performanta mai mica decat bicarbonatul de sodiu, ceea ce reduce
avantajului costului.
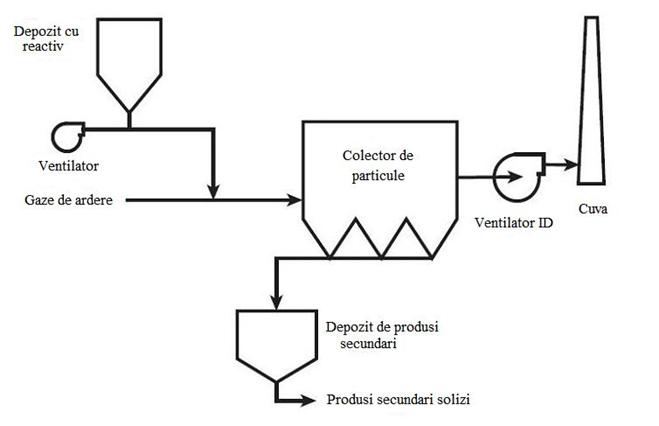 Figura 9 Diagrama de flux a bicarbonatului de sodiu
Figura 9 Diagrama de flux a bicarbonatului de sodiu
Pentru a atinge performanta de inlaturare a 90% de SO2 cu trona, este nevoie de un nivel ridicat al proportiei de reactiv de aproximativ 1,5 la 1,9 moli Na / mol SO2. In aplicatiile cu HCl, performanta trona este aproape egala cu cea a bicarbonatului de sodiu la aceeasi ratie de reactiv.Raportul estimativ de reactiv necesar pentru a atinge un procent de inlaturare a HCl de 90% folosind trona este de aproximativ 1.2 moli Na / mol HCl.
Un dezavantaj al injectarii cu bicarbonat de sodiu in aplicatiile cu SO2 este acela de a se forma un fum brun de NO2. Fumul de NO2 se poate forma in cadrul anumitor combinatii de SO2, NO, umiditate si temperatura. Combinatia necesara este aceea a gazelor de ardere de la carbunii centralelor termice. Indepartarea a 20% NOx poate fi obtinuta cu acest proces, dar o parte din NO este oxidat la NO2,ducand la cresterea concentratiilor de NO2 in ciuda eliminarii NOx. Emisiile de NO2 pot fi controlate cu aditivi, cum ar fi de amoniac, bicarbonat de amoniu, sau uree. Problema fumului nu apare la temperaturi ridicate (> 400 F), la concentratii mari de umiditate, sau in cazul aplicatiilor de eliminare a HCl in care SO2 nu este prezent.
Sistemul de
bicarbonat de sodiu vine cu un cost ridicat al reactivului 260$/tona plus cheltuielile de transport din
Trona,
la 65$/tona plus cheltuieli de transport
din
2.3.6. Alte procese de eliminare a SO2
O serie de alte procese, cum ar fi injectia pe conducte, uscarea prin pulverizare a conductelor, cuptoare de injectare, injectare economica, silicare avansata, E-Sox, au fost dezvoltate dar nu sunt folosite pe scara larga pentru sistemele industriale. Cu toate acestea,o intelegere de baza a reactivilor si reactiilor mecanismelor si avantajele si dezavantajele proceselor descrise mai sus permit atat evaluarea modificarilor acestor procese, precum si a altor noi procese care pot fi oferite.
2.4 Exemplu de evaluare
O platforma industriala are fluxul de gaze de esapament la 400 F de 100000
acfm, care contine 1000 ppm SO2 si 200 ppm HCl. Fiecare poluant necesita o
eficienta de indepartare de 90%.
Aceasta platforma doreste o rambursare pe 5 ani a oricearei investitii de
capital care reduce costurile de exploatare, folosind o rata a dobanzii de 10%.
Platforma este situata langa ocean, astfel incat sarurile de sodiu ar putea fi
evacuate dupa aerare. Operatorii au exprimat
repulsie pentru sistemele de manipulare a solutiilor reziduale. Ce sistem este
recomandat?
O evaluare a costurilor de functionare si de capital, rezumate in tabelul 3,
arata reactivii pe baza de sodiu au costuri foarte ridicate pentru aceasta
aplicatie.
Economiile pentru sistemele pe baza de reactivi de calciu sunt semnificativ mai
mari decat costul de depozitare a deseurilor de produse. De asemenea, costul de
capital ridicat al unui epurator de gaze de calcar face ca recuperarea
economiilor mici din costul reactivului sa nu fie rentabila. Avand in vedere
alegerea intre un uscator de vapori de var si un reactor de var in acelasi
capital, o mica economie se face la alegrea reactorului de var si preferinta
operatorilor pentru evitarea manipularii malului, duc la concluzia ca un sistem
de recirculare a varului care foloseste apa in loc de mal pentru umidificare
este recomandat pentru acest caz ipotetic.
3. SO3 si acidul sulfuric
3.1.Formarea SO3 si H2SO4
Un aspect interesant al emisiilor de oxid de sulf este oxidarea unei
mici parti de SO2 in SO3. Oxidarea este favorizata de prezenta metalelor aflate
in contact cu
conductele de gaz care catalizeaza reactia. Unele efecte de catalizare pot sa
apara prin prezenta fierului pe tuburile din cazan. Cenusa rezultata din
combustia carbunelui,poate contine metale ce catalizeaza oxidarea SO2. De
obicei cocsul de petrol are un nivel relativ ridicat de continut de vanadium,
care provine de la titei, deci cocsul de petrol ars si calcifiat are o rata de
oxidare mare.
SO3 se combina usor cu vapori de apa in interval de temperatura de 400 - 900
F, producand vapori de acid sulfuric. Echilibrul relatiei dintre SO3, H2O, si
SO H este dat de relatia Gmitro si Vermeulen:
![]()
unde

Folosind aceasta relatie de echilibru, fractiunea de SO3 convertita in
H2SO4 ca o functie de temperatura si de continut de vapori de apa in gazele
arse este reprezentata in Figura 10.
Acidul sulfuric comprimat este extrem de coroziv, si, asa cum se mentioneaza in
examinarea calcarului umed, necesita utilizarea de materiale rezistente la
coroziune in cazul in care temperatura gazelor de ardere este mai mica decat
punctul de roua al acidului. In cazul in care temperatura este mai mica decat
punctul de roua al acidului, vaporii de acid sulfuric condenseaza in picaturi
de aerosoli de apa. Haase siBorgmann au propus o simpla corespondenta pentru
punctul de roua al acidului, pe baza datelor experimentale:
Tabel 3
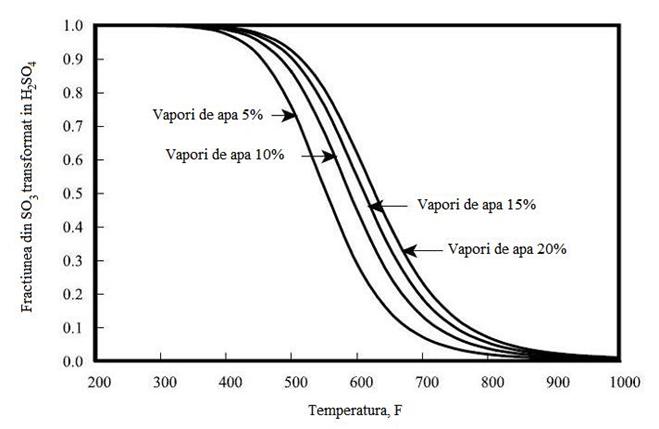 Figura 10 Echilibrul SO3/H2SO4
Figura 10 Echilibrul SO3/H2SO4
![]() (23)
(23)
unde
![]() - punctul de roua al acidului sulfuric
- punctul de roua al acidului sulfuric ![]()
P - presiunea partiala, atm
Desi utila din cauza simplitatii sale, nu arata cu exactitate punctul
de roua la temperaturi ridicate. Alte corelatii nu arata o relatie liniara
intre punctul de roua
si logaritmul din SO3 la presiune partiala. Verhoff si Banchero11 au propus o
alta ecuatie pentru punctul de roua al acidului sulfuric:
![]() (24)
(24)
unde
![]() - punctual de roua
al acidului sulfuric,
- punctual de roua
al acidului sulfuric, ![]()
P- presiunea partiala, mm Hg
Okkes si Badger12 a propus o relatie care se bazeaza pe simplitate corelatiei lui Haase si Borgmann, dar este adaptata pentru a se potrivi curbei de date:
![]() (25)
(25)
unde
![]() - punctual de roua
al acidului sulfuric,
- punctual de roua
al acidului sulfuric, ![]()
P - presiunea partiala, atm
O problema in folosirea relatiilor punctului de roua al acidului este aceea de a stabili presiunea partiala a SO3. Oxidarea SO2 in SO3 este influentata de un numar de variabile,inclusiv de oxigen si concentratiile de SO2, temperatura, precum si de prezenta catalizatorilor care pot fi antrenati in particule sau pe tevile de metal ale cazanului. Neglijand influenta catalizatorilor, echilibrul termodinamic poate fi folosit pentru a estima concentratia de SO3 la temperaturi de peste 1000 C unde cinetica nu impiedica reactia, utilizand relatia:
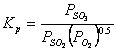 (26)
(26)
![]() poate
fi calculata astfel:
poate
fi calculata astfel:
![]() (27)
(27)
unde T - temperatura, K
Concentratia de
SO3 in gazele de ardere racite poate fi estimata folosind relatia 25, la o
temperatura de 1000 C presupunand ca cinetica 'blocheaza'
concentratia la aceasta valoare.
O alta posibilitate de a calcula punctul de roua al acidului din ecuatii,
ipoteze, si relatii este aceea de a-l
masura cu un analizor existent pe piata. Cazanele ce utilizeaza carbuni au
punctele de roua ale acidului la aproximativ 225 - 275 F.
Formarea vaporilor de acid sulfuric reprezinta o alta problema pentru aparatele
de absorbtie a SO2 umed. Vaporii microscopici se pot forma imediat la intrarea intr-un vas de
absorbtie umed . Submicron mist can form immediately at the entrance of a wet
absorber
as the flue gas is saturated with water and before gas phase SO3 and H2SO4 diffuses to large droplets of absorber liquor solution
Odata ce vaporii microsopici s-au format, acestia sunt greu de eliminate prin frecare umeda, deoarece mecanismele de interactiune si interceptare sunt slabe pentru a scoate aceste particule (picaturi de vapori de acid sulfuric). Acest lucru poate duce la emisii semnificative de vapori de acid sulfuric, care pot forma o pelicula vizibila. This has been an aggravating problem for coal-fired utility boilers that retrofitted wet SO2 absorbers downstream of existing electrostatic precipitators
to meet SO2 emission control requirements. Acest lucru a fost o problema grava pentru cazanele ce folosesc carbuni
In timp ce se reuseste inlaturarea unor cantitati substantiale de SO2 some of them went from clear stacks to a stack that emitted a bluish-gray haze.
3.2 Publicatia pentru inventarierea substantelor toxice
Pana in ultimii ani, vaporii de acid sulfuric generati de
procesele de combustie au fost uneori trecuti cu vederea si nedeclarati pentru
anuarul SARA 313 (Publicatie pentru inventarierea substantelor toxice).
De asemenea, pana de curand, utilitatile de carbuni aprinsi au fost scutite de raportarea
catre SARA. Dar cand au fost raportate, cantitatea de vapori de acid sulfuric
generata de procesele de combustie a fost foarte mare. Interesant este ca,
cerintele de raportare de vapori de acid sulfuric exclud SO3, dar includ H2SO4,
atat in vapori cat si in picaturi de apa. Acesta este unul dintre multele
lucruri bizare care pot fi gasite in normele de raportare. Dar aceasta inseamna
ca stiind reactia de conversie a SO3 in H2SO4, este importanta pentru o
raportare cat mai corecta.
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 3886
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2026 . All rights reserved