| CATEGORII DOCUMENTE |
| Demografie | Ecologie mediu | Geologie | Hidrologie | Meteorologie |
Resurse naturale si protectia mediului
Regimul de oxigen al apei naturale
CAPITOLUL I
1.1 Argument
Apa este foarte mult raspandita in natura, in toate trei straturile de agregare, sub forma de gaz sau vapori de apa - ceata, aburi si nori - in atmosfera, sub forma lichida in rauri, mlastini, lacuri, mari sau oceane si sub forma solida sau gheata. Ea acopera mai mult de 70% din suprafata pamantului atat lichida cat si solida fiind necesara vietii de pe pamant si constituie o mare parte a lucrurilor vii.
Datorita circuitului sau rapid, apa constituie o resursa care poate fi reinoita.
Timpul petrecut in diferitele faze ale circuitului variaza foarte mult. Apa poate exista in atmosfera doar cateva ore; intr-un lac sau rau, zile saptamani sau luni; in calote glaciare, gheþari sau oceane, mii de ani.
Pe parcursul circuitului sau, apa dizolva:
Ø gaze, cum ar fi: oxizii de carbon, azot si sulf;
Ø solide solubile din pamant, peste sau prin care trece.
Aceste procese pot fi 'naturale' (de exemplu formarea apei dure) sau 'nenaturale' (de exemplu dizolvarea gazelor poluante care formeaza ploaia acida).
Activitatea umana determina modificari considerabile ale
resurselor de apa naturale resurselor de apa naturale. Aceste influen . Aceste influentte se manifesta in urmatoarele privinte:
asupra reparti asupra repartittiei resurselor de apa iei resurselor de apa iintre diferitele categorii de ntre diferitele categorii de resurse;resurse;-
asupra reparti asupra repartittiei iei iin timp sau n timp sau iin span spattiu iu iin cadrul aceleian cadrul aceleiassi categorii.i categorii.
Influen Influenttele de primul tip sunt mult mai profunde ele de primul tip sunt mult mai profunde ssi, i, in acela n acelassi timp, mai i timp, mai greu de stabilit din punct de vedere cantitativ.greu de stabilit din punct de vedere cantitativ.
In primul rand, , exista activitatti ale umanitai ale umanitattii, exercitand , influente care modifica sensibil insusi regimul precipitatiilor. S-au constatat reduceri considerabile ale precipitatiilor in vecinatatea unor zone industrializate, ca urmare a emisiilor de fum industrializate, si de abur de pe platformele industriale: implicit, aceste reduceri de precipitattii, influeninfluenteaza, cel pu, cel putin local, in local, resursele de apa. De asemenea, poluarea atmosferica si formarea smogului , duc la reducerea radiatiei solare pe suprafata solului , atragand o reducere a umiditattii atmosferice si o influenta corespunzatoare asupra precipitatiilor.
CAPITOLUL 2
Continut esentializat
2.1Generalitati
In natura, apa se gaseste din abundenta, in toate starile de agregare:
in stare lichida (forma in care acopera 2/3 din suprafata pamantului; sub forma de mari, oceane, rauri, fluvii, ape subterane);
in stare solida (formeaza calote glaciare);
in stare gazoasa (atmosfera contine o cantitate considerabila de apa, sub forma de vapori de apa, invizibili).
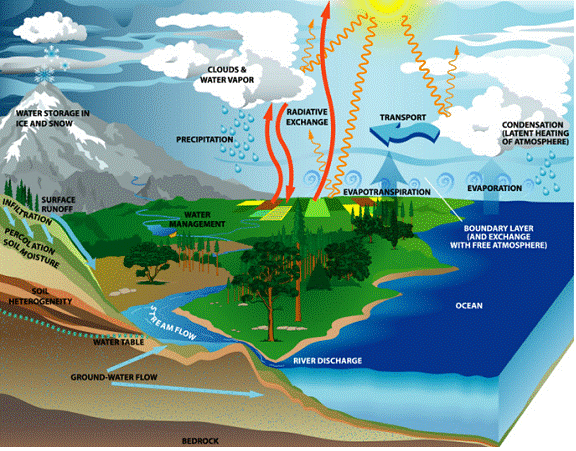
Apa urmeaza un circuit in natura.
Caldura soarelui determina evaporarea apei de suprafata. Vaporii rezultati se ridica in atmosfera. Daca in atmosfera saturata cu vapori de apa apare o scadere a temperaturii, parte din vaporii condensati iau forma de nori, ceata, ploaie, zapada sau grindina.
In anotimpurile calde, dar cu nopti racoroase se depune roua, iar daca temperatura solului este sub 0 C, se depune bruma.
Apele ajunse la nivelul solului sau cele ce rezulta din topirea zapezilor, in parte umplu din nou lacurile, raurile, fluviile, marile si oceanele. Alta parte strabate straturile de pamant, la diferite adancimi, formand apele freatice. Apa subterana poate reaparea la suprafata, fie prin izvoare, fie extrasa prin fantani, puturi sau sonde.
In natura nu exista apa pura; date fiind interactiunile cu mediul ea contine gaze, substante minerale si organice dizolvate in suspensie.
Chiar apa de ploaie, care ar trebui sa fie cea mai curata apa naturala (devenita astfel printr-o distilare naturala) poate prezenta dizolvate anumite impuritati de tipul: CO2, NH3 sau chiar H2S, SO2- ca urmare a contactului prelungit cu aerul.
In regiunile tropicale, apa de ploaie are o putere de dizolvare foarte mare. Specialistii au calculat ca in peninsula Indochina, apa de ploaie ce cade pe un hectar, pe parcursul unui an, contine 8 kg HNO3. In Brazilia, 50g apa la m3 de ceata contine 15-18 mg H2CO3 si 19 mg HNO3. Este o apa acida ce ataca rocile.
Cea mai variata compozitie dintre toate apele naturale o au apele subterane. Ele contin cantitati mari de substante solide sau gazoase. Ajunse la suprafata, aceste ape, formeaza izvoare de ape minerale.
Dupa compozitie, apele minerale pot fi:
acide (continut ridicat de CO2),
alcaline (predomina sulfatii de magneziu si sodiu),
sulfuroase (contin sulfuri alcaline),
feruginoase (contin carbonati de fier di si trivalent).
Tara noastra are un potential ridicat de ape minerale. Sunt cunoscute statiunile balneo-climaterice ca cele de la Buzias (ape carbogazoase si feruginoase), Calimanesti, Govora, Caciulata (ape sulfuroase), Slanic Prahova, Ocna Sibiului (saline).
Factorii determinanti ai efectului terapeutic precum: termalitate, prezenta gazelor dizolvate (O2, CO2, H2S, CH4, N2, gaze rare), prezenta unor substante de natura minerala sau organica (hormoni, antibiotice) permit utilizarea acestor ape in tratarea unei game foarte largi de afectiuni ale aparatului cardio-vascular, locomotor, anemii, boli ale sistemului nervos si boli endocrine.
Apele din rauri au o compozitie variabila. Sunt in general slab mineralizate. Contin Ca2+ si HCO3- si mai rar SO42- si Cl-.
Apele marilor si oceanelor sunt puternic mineralizate. Marile interioare au concentratii in saruri, fie mai mari (Marea Mediterana), fie mai mici (Marea Neagra- in special NaCl) comparativ cu apele oceanelor. In cazul Marii Moarte, concentratia de saruri este atat de mare incat viata nu poate exista. Sarurile apei de mare contin 89 cloruri, 10 sulfati, 0,2 carbonati.
Totalitatea apei pe pamant este de aproximativ 1,46 miliarde km3 din care 97 in oceane si mari, 2 in calote glaciare si 1 in rauri, lacuri, panze subterane.
Apa potabila nu trebuie sa contina organisme animale si vegetale si sa satisfaca cerinte de calitate superioara privind indicatori fizico-chimici, biologici si bacteriologici.
Alimentarea cu apa a centrelor urbane prezinta o mare importanta, caci apele trebuie sa fie tratate inainte de a fi puse la dispozitia populatiei.
Pentru epurarea apei se folosesc: ozon, clor, hipoclorit de calciu (apa de Javel), cloramina. In cazul clorului se utilizeaza aproximativ 0,1 mg clor la litru. O cantitate prea mare de clor da insa apei un gust dezagreabil si chiar un miros urat.
(CIRCUITUL APEI IN NATURA)
2.2 Principii teoretice
Analiza fizico-chimica a apei consta in determinarea proprietatilor organoleptice si fizice, precum si a compozitiei chimice.
Analiza apei se executa dupa un plan bine stabilit, tinand cont de sensibilitatea mai mare sau mai mica a proprietatilor si componentilor apei.
Substantele care se determina nu au effect nociv , toxic sau de alta natura asupra organismului uman si nici nu produc modificari in continutul apei.
Indicatia sanitara a acestor substante consta in in faptun ca ele arata , indica prezenta in apa a altor substante care pot avea efecte nocive; nu este vorba numai de substante chimice ci si de agenti microbieni care pot declansa boli infectioase sau parazitare.
Unele dintre aceste substante indicatoare se pot gasi in mod obisnuit in apele natural, de aceea nu atat prin prezenta lor cat mai ales prin modificarea brusca a concentratiei ,aceste substante au rol indicator.
Acesti indicatori sunt: oxigenul dizolvat , deficitul de oxigen si cerinta biochimica de oxigen, substantele oxidabile , diversele forme de azot, fosfatii si hidrogenul sulfurat.
.Oxigenul dizolvat cantitatea de oxigen efectiv dizolvata in apa care se cerceteaza.Diferenta dintre oxigenul de saturare si oxigenul dizolvat reprezinta deficitul de oxigen.
Cantitatea de oxigen dizolvata in apa depinde de temperature apei, presiunea aerului si continutul in substante oxidabile si microorganisme. Scaderea cantitatii de oxigen in apa duce la pierderea caracterului proaspat dandu-i un gust fad si nu satisface senzatia de sete. De asemenea scaderea oxigenului reduce capacitatea de autopurificare a apelor natural favorizand persistent poluarii cu toateconsecintele nedorite.
Determinarea este necesara pentru aprecierea impurificari cursurilor de apa , pentru controlul apelor de cazan , a apelor industriale si a celor reziduale.
Oxigenul dizolvat in apa se poaet determina prin doua metode:
Metoda volumetrica Winkler
Metoda cu indigo-carmin-aplicabila a apelor industriale ce contin sub 0.05mg/l de oxigen.
2.2.2Oxigenul chimic necesar
Oxigenul chimic necesar (OCN) reprezinta cantitatea de oxigen (in mg/l), necesara pentru oxidarea substantelor organice continute in apa , fara ajutorul bacteriilor.Consumul chimic de oxigen reprezinta cantitatea de oxigen necesara pentru oxidarea tuturor substantelor oxidabile organice si anorganice existente intr-un litru de apa. Substantele oxidabile din apa , sau consumul chimic de oxigen (CCO) sunt substantele ce se pot oxida atat la rece cat si la cald , sub actiunea unui oxidant. Oxidabilitatea reprezinta cantitatea de oxigen echivalenta cu consumul de oxifant.
Substantele organice din apa pot proveni din sol (acid humic si acid fulvic) sau in urma poluarii, caz in care concentratia lor variaza brusc. Cresterea cantitatii de substante organice in apa sau aparitia lor la un moment dat indica o poluarea a apei cu germeni care intovarasesc substantele organice.
Se determina prin doua metode:
metoda cu bicromat de potasiu (CCO Cr);
metoda cu permanganat de potasiu (CCO Mn);
2.2.3Consumul biochimic de oxigen de oxigen reprezinta consumul de oxigen necesar pentru descompunerea substantelor organice sub influenta microorganismelor existente intr-un litru de apa in conditii bine precizate si anume: in timp de cinci zile la temperature de 20 de grade Celsius. Se determina pe probe de apa diluata si nediluata facand diferenta dintre cantitatea de oxigen gasita in proga de apa imediat si dupa cinci zile de la recoltare.
CAPITOLUL 3
Determinari experimentale
3.1. Determinarea oxigenului dizolvat
3.1.1 Metoda volumetrica Winkler
1)Aparatura:
Sticle speciale de 120 - 300 ml , cu dop rodat , taiat oblic;
Pipete gradate
Balanta analitica sau electronica
Cilindru gradat
Pahare Erlenmeyer
Biureta
2)Reactivi:
Clorura manganoasa (MnC)
Hidroxid de sodiu (NaOH) si iodura de potasiu (KI)
Acid clorhidric concentrat (HCl)
Solutie de tiosulfat de sodiu0.01 N (N)
Solutine de amidon 1%
Oxigenul dizolvat in apa reactioneaza cu hidroxidul de sodiu si clorura manganoasa. Se formeaza hidroxid manganic, care cu iodura de potasiu in mediu acid pune in libertate iod, care se titreaza cu tiosulfatul de sodiu in prezenta amidonului.
3)Mod de lucru
Probele de apa pentru determinarea oxigenului trebuie luate in sticle speciale de 120 - 300 ml, cu dop rodat, taiat oblic. Sticlele vor fi umplute cu precautie pana la dop, fara a lasa nici o bula de aer.
Imediat dupa luarea probei se fixeaza oxigenul prin adaugarea a 2 ml clorura manganoasa si 2 ml hidroxid de sodiu si iodura de potasiu.
La apele cu mult bioxid de carbon se adauga reactivii de mai sus in cantitati mai mari.
Se astupa sticla cu dopul slefuit astfel ca sa nu ramana nici o bula de aer. Se agita, iar continutul flaconului devine, in functie de cantitatea de oxigen, galben sau brun. Se lasa sa se depuna cel putin 60 min. Se adauga 5 ml HCl concentrat (d = 1,19) si se agita pana la dizolvarea precipitatului, dupa care se lasa in repaus 10 min.
Din aceasta solutie se iau cu o pipeta 200 ml, se introduc intr-un vas Erlenmeyer si se titreaza cu tiosulfat de sodiu 0,01 N pana la decolorarea solutiei (galben - pai). Se adauga cateva picaturi de solutie amidon 1% ( solutia se decoloreaza in galben): se continua titrarea cu tiosulfat pana la decolorare.
Cantitatea de oxigen se calculeaza folosind formula:
mg/l oxigen = 1000/B x A/A - 2a x 0.08b mg/l
A = cantitatea de solutie luata in flacon (mg)
a = cantitatea de solutie MnC si NaOH iodata necesara fixarii oxigenului (ml)
B = cantitatea de tirant (ml)
b = cantitatea de solutie de tiosulfat de sodiu folosit la titrare (ml)
(Conform formulei de calcul 1ml de tiosulfat de sodiu corespunde la 0.08 mg oxigen)
Oxigenul dizolvat in apa oxideaza hidroxidul manganos la hidroxid manganic, care in mediu acid scoate iodul din iodura de potasiu in cantitate echivalenta cu oxigenul dizolvat in apa si se titreaza cu tiosulfat de sodiu.
Determinarea consumului chimic de oxigen
3.2.1. Meoda cu bicromat de potasiu (K2Cr2O7)
1)Aparatura
Balon cu fund rotund
Pipete gradate
Bucati de portelan poros
Refigerent de aer
2)Reactiovi
Bicromat de potasiu () 0.25 N;
Acid sulfuric concentrat (S)
Feroina
Solutie de sulfat dublu de Fe si amoniu
3)Mod de Lucru
Intrun balon cu fund rotund se introduc 20 ml apa de analizat , ca atare sau diluata , 10 ml C 0.25 N. Se adauga treptat , cu grija 30 ml S concentrat amestecand si racind dupa introducerea fiecarei portiuni. Se introduc cateva portiuni de portelat poros se monteaza refrigerentul de aer si se fierbe timp de 2 ore. Se lasa sa se raceasca si se spala refrigerentul de sus in jos cu pa distilata. In pahara se adauga cateva picaturi de feroina , apoi titrandu-se cu solutie de sulfat duble de fier si amoniu 0.25 N.
La punctul de echivalenta , culoarea solutiei vireaza de la albastru - verziu la albastru - rosiatic .
In paralel se efectueaza in aceleasi conditii o determinare martor , folosindu-se in locul apei de analizat 20ml apa distilata.
Formula de calcul:
CC = - x n x 8/V x 1000mg/l
= volumul solutiei de sulfat dublu de fier si amoniu folosit la titratrea solutiei martor(ml)
= volumul de solutie de sulfat dublu de fier si amoniu titrat pentru proba de analizat (ml)
V = volumul probei de lucru (ml)
n = normalitatea solutiei de sulfat dublu de fier si amoniu
8 = cantitatea de oxigen (mg) corespunzatoare la 1 ml C 0.25 N
Consta in oxidarea substantelor oxidabile (organice si anorganice) cu bicromat de potasiu in exces in mediu de acid sulfuric si in titrarea execsului de bicromat cu sulfat dublu fier si amoniu utilizand ca indicator feroina.
3.2.2. Metoda cu permanganat de potasiu (KMnO4)
1)Aparatura
Pahare Erlenmeyer
Pipete
Sita de azbest
Biureta
Balanta analitica sau electronic
Mojar
Balon cotat
2)Reactivi
Solutie de permanganat de potasiu 0.01 N , se prepara din 0.316g permanganate de potasiu mojarat , se dizolva in cativa ml de apa distilata intr-un balon cotat de 1000ml si se completeaza pana la semn cu apa distilata;
Solutie de acid oxalic 0.01 N se prepara din 0. 6303g acid oxalic ce se dizolva in cativa ml de apa distilata , intr-un baloc cotat de 1000ml , adaugandu-se 5 ml acid sulfuric in raport 1:3 si se completeaza pana la semn cu apa distilata
Acid sulfuric 1:3 diluat cu apa bidistilata si tratat la rece cu careva picaturi de permanganate de potasiu pana la virajul culorii la slab roz
Solutie de hidroxid de sodium 30%
Reactia chimica:
2KMnO4 + 5H2C2O4 + 3H2SO4 = 2MnSO4 +K2SO4 + 10CO2 + 8H2O
3)Mod de lucru
a)In cazul unui continut de cloruri in apa sub 300mg/l :
100 ml de apa de analizat se adauga intr-un pahar Erlenmeyer pregatit inainte fara urme de substanta organice , in care se introduce 5 ml S 1:3 si 10 ml permanganate de potasiu. Se fierbe pe sita 16 min.
Se ia vasul de pe sita si se adauga in Solutia fierbinte 10 ml acid oxalic.
Solutia decolorata titrandu-se cu permanganate de potasiu pana la virajul slab al culorii la roz persistent.
Relatia de calcul:
mgKMn/l = [(V + ) x f - ] x x 1000mg/l
V = volumul de permanganate de potasiu introdus initial in proba (ml)
= volumul de permanganate de potasiu 0.01 N titrati in proba (ml)
= volumul de acid oxalic pus in proba pentru decolorare (ml)
= factorul solutiei de pormanganat de potasiu
= echivalentul gram al permanganatului de potasiu a 1ml de solutie de KMn 0.01 N.
= volumul de apa de analizat luat in lucru (ml)
b)In cazul unui continut in apa de cloruri peste 300mg/l
100ml apa de analizat se adauga intr-un pahar Erlenmeyer peste care se adauga 0,5 ml hidroxid de sodiu 30% si 10 ml ermanganat de potasiu. Se fierbe 10 min. pe sita de azbest .Se lasa apoi sa se raceasca pana la 70˚C si se adauga in proba 5ml S 1:3 si 14 ml acid oxalic 0,01N. titrandu-se cu permanganate de potasiu pana cand lichidul incolor capatand o tenta de slab roz.
Formula de calcul :
mgKMn/l = [(V + ) x f - ] x 0.316/ x 1000mg/l
Observatii:
Pentru a exprima rezultatul de mai sus in mg/l se inmulteste cu 0,25
Factorul solutiei de permanganate 0,01N se stabileste fata de soulia de acid oxalic 0,01N.
Consta in oxidarea substantelor organice la cald si a celor anorganice la rece sub actiunea unui oxidant (Permanganat de potasiu) in mediu acid , in cazul unui continut de cloruri in pa de maxim 300mg/L sau in mediu alcalin , in cazul unui continut de cloruri in apa de peste 300mg/L.
Permanganatul ramas in exces determinandu-se cu acid oxalic (. Oxidabilitatea reprezinta cantitatea de oxigen echivalenta cu consumul de oxidant.
3.3. Determinarea consumului biochimic de oxigen
1)Aparatura:
2 sticle brune
Cilindru gradat
2)Mod de lucru:
Determinarea pe proba de apa diluata.
In 2 sticle brune se recolteaza apa de analizat , in aceleasi conditii ca pentru determinarea oxigenului dizolvat. Intr-una dintre sticlele bruna se fixeaza oxigenul , iar in cea de-a a doua se pastreaza al intunerin la temperature de cca. 20˚ Celsius timp de 5 zile. In sticla in care s-a fixat oxigenul se efectueaza determinarea exact ca la determinarea oxigenului dizolvat. Dupa 5 zile se determina oxigenul dizolvat din cea de-a doua sticla repetandu-se operatia de la prima sticla.
Formula de calcul:
mgCB/l = A -B
A= cantitatea de oxigen din proba de apa analizata imediat (mg/l)
B = cantitatea de oxigen din proba analizata dupa 5 zile (mg/l)
Determinarea pe proba de apa diluata.
Diluaraea probelor de apa cu apa de dilutie se face in scopul inlaturatii inhibitiei proceselor biodegradabile. Apa de dilutie este de regula apa de la robinet puternic aerate si declorinata.
Pentru analiza , proba se alcatuieste din 3/4 apa de dilutie si ¼ apa de analizat dupa care se amesteca.apa de dilutie este necesar sa aiba un continut de oxigen astfel incat proba pregatita pentru analiza sa sa contina o cantitate de oxigen mai mica de 2mg/d.
CBO5 mg /d = [(A-B) - (a-b)] x Δ
Δ = coeficientul de dilutie care arata cu cat a fost diluata proba de apa.
Se bazeaza pe determinarea oxigenului consumat timp de cinci zile de actre microorgansmele din apa prin diferentierea dintre cantitatea de oxigen gasita in proba de apa imediat si dupa cinci zile de rezoltare.
Metoda se aplica la apele in care sunt prezente microorganisme. Pentru apele care au devenit sterile datorita inhibarii bacteriene de catre reziduurile industriale si care necesita efectuarea unei insamantari , metoda poate fi aplicata , insa numai cu caracter experimental.
Determinarea consumului chimic de oxigen se va efectua dupa maxim 8 ore de la prelevarea probei de apa.
Oxigenul dizolvat in apa depinde de: pH , temperatura , presiunea aerului si continutul in substante oxidabile si mocroorganisme.
Scaderea cantitatii de oxigen din apa potabila o face nepotabila.
Degradarea biochimica a apelor reziduala are loc in 2 etape:
Descompunerea substantelor organice timp de 5 zile
Nitrificarea, cand amoniul este trecut la nitrit cu ajutorul bateriilor : Nitrosomonas si Nitrobacter.
Reactia care are loc este :
Organisme + nutrienti + agenti de oxifare celule noi + produsi metabolici + energie
CAPITOLUL
Concluzii
Determinarea regimului de oxigen are importanta practica:
pentru apele de suprafata la care se determina oxigenul dizolvat , CCO si CB
pentru apele potabile care se determina numai oxigenul dizolvat si CCO
pentru apele reziduale la care se deternima numai CCO si CB
Pentru determinare CCO , in practica , metoda cu permanganate de potasiu se foloseste in general pentru determinari rapide si orientative intricate reacta chimica decurge in condirii blande in timp ce metoda co bicromat de otasiu se foloseste in mod current pentru determinari laborioase si exacte.
Oxigenul din apa poate avea o provenienta variata:
-prin dizolvarea oxigenului din aer
- prin procesele de fotosinteza a florei acvatice
In apele cu turbiditate mica si expuse favorabil la soare , in timpul zilei oxigenul dizolvat se gaseste aproape de limita de saturatie , iar in timpul noptii se gaseste in cantitati foarte mici , dar exista bioxid de carbon in cantitate mare. Plantele acvatice, ziua produc oxigen , iar noapte consuma oxigen.
Solibilitatea oxigenului in apa este invers proportionala cu temperature apei. O data cu cresterea temperaturii apei , solubilitatea oxigenului in apa scade.
Existent unor impuritati oxidabile in apa schimba continutul in oxigen al apei scazandu-l mult sub limita de saturare. Astfel , substantele organice hidrogenul sulfurat , amoniacul si nitritii prezenti in apa reduc continutul e oxigen dizolvat in apa.
Scaderea brusca a continutului de oxigen dizolvat in apa dovedeste impurficarea apei respective.Pentru o buna oxigenare a plantelor , cu efecte benefice atat asupra florei si faunei acvatice cat si asupre sanatatii omului , se recomanda urmatoarele masuri:
-reducerea poluarii prin educare populatiei,printr-o legislate adecvata , prin infintarea micro statiileor de epurare chiar la locul de deversare aa apelor industrial si apoi a unor micro statii de epurare orasenesti in care doar sa se finalezeze procesul de epurare a apelor reziduale , prin refacerea si sextindetea canalizarii proportional cu necesitatiile actuale, prin folosirea a ingrasamintelor chimicesi a pesticidelor in agricultura , prin interzicerea deversarilor de ape menajere sau de hidrocarburi de pe navele fluviale , maritime sau oceanice , prin interzicerea depozitarii gunoaielor pe malurile apelor de suprafata.
- prin asigurarea debitelor de inprospatare a apelor pentru dilutia acestora;
-prin amenajearea albiilor raurilor si a malurilor lacurilor penru evitarea zonelor de stacnare a apei.
-prin crearea de fantani arteziene si de cascade pentri oxigenarea si destratificarea apei .
CAPITOLUL
Norme de tehnica a securitatii muncii in laborator
In laboratoarele de tehnici de laborator, ca in orice laborator de chimie, exista o serie de pericole ce trebuie limitate. Principalele pericole care ameninta pe cel ce lucreaza in laborator sunt:
Intoxicatiile
Arsuri ale pielii, ochilor cu substante corozive
Raniri cu cioburi de sticla, piese de metal
Incendii, explozii, arsuri cu flacara
Electrocutari
Pentru prevenirea acestor pericole trebuie respectate urmatoarele masuri:
Orice substanta cu care se lucreaza se considera in principiu toxica si se va evita patrunderea ei in organism.
Nu se mananca in laborator, nu se pun alimente pe masa de lucru.
Se va evita inhalarea de vapori de gaze degajate in reactiile efectuate. Aceste reactii se vor efectua sub nisa.
Pentru portejarea ochilor se vor folosi ochelari de protectie atunci cand este cazul.
Nu se va lucra, pe cat posibil cu cantitati mari de substante inflamabile.
Substantele inflamabile vor fi ferite de sursele de foc.
Nu se vor folosi instalatii electrice improvizate. Aparatele electrice vor fi legate obligatoriu la centura de impamantare.
Se va evita in laborator purtarea hainelor confectionate din fibre sintetice.
CUPRINS
CAPITOLUL 1pag.2
1.1ARGUMENT.pag.2
CAPITOLUL 2pag.4
2.2 PRINCIPII TEORETICE.pag.7
2.2.1 OXIGENUL DIZOLVAT..pag.7
2.2.2 OXIGENUL CHIMIC NECESAR.pag.8
CAPITOLUL 3.pag.9
3.1 DETERMINAREA OXIGENULUI DIZOLVAT..pag.9
3.1.1 METODA VOLUMETRICA WINKLER.pag.9
3.2 DETERMINAREA CONSUMULUI CHIMIC DE OXIGEN..pag.11
3.2.1 METODA CU BICROMAT DE POTASIU..pag.11
3.2.2 METODA CU PERMANGANAT DE POTASIU..pag.13
3.3 DETERMINAREA CONSUMULUI BIOCHIMIC DE OXIGEN..pag.15
CAPITOLUL 4(CONCLUZII)pag18
CAPITOLUL 5
NORME DE TEHNICA SI SECURITATE A MUNCII IN LABORATOR..pag.20
CAPITOLUL 6(BIBLIOGRAFIE).pag.22
Capitolul 6
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 7372
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2025 . All rights reserved