| CATEGORII DOCUMENTE |
| Alimentatie nutritie | Asistenta sociala | Cosmetica frumusete | Logopedie | Retete culinare | Sport |
Cromoproteine
Cromoproteinele sunt heteroproteine care au ca grupa prostetica un compus ce absoarbe in vizibil determinand o culoare specifica.
In functie de natura grupei prostetice, cromoproteinele se pot clasifica in :
cromoproteine porfirinice (hemoglobina, mioglobina - transportori de oxigen, citocromii - transportori de electroni in diverse lanturi oxidative, catalaza, peroxidazele - enzime ce functioneaza ca antioxidanti, etc.) - hemoproteine (grupa colorata hem)
cromoproteine neporfirinice (siderofilina, feritina - proteine implicate in transportul, respectiv depozitarea fierului in organism, ceruloplasmina - proteina ce contine cupru, etc.).
Unele cromoproteine sunt si metaloproteine, deoarece contin si ioni metalici.
Cromoproteinele porfirinice au ca grupa prostetica hemul o porfirina substituita deosebindu-se intre ele prin modul de legare a hemului la componenta proteica apoproteina), prin natura apoproteinei si, uneori prin mici diferente in structura hemului
Pentru a-si asigura necesarul de oxigen, gaz putin solubil in solutii apoase, neputand fi furnizat celulelor in cantitati suficiente, organismele au evoluat spre formarea unor proteine transportoare de oxigen. Pentru ca aminoacizii constituenti ai proteinelor nu pot lega oxigenul, au fost exploatate proprietatile unor metale, precum Fe, Cu, capabile sa-l fixeze. Acestea au fost incluse in structura unor proteine, in scopul evitarii reactiilor cu formare de specii reactive ale oxigenului pe care metalele bivalente le potenteaza.
Mioglobina si hemoglobina au reprezentat modele importante pentru studiul structurii si proprietatilor proteinelor si al interrelatiilor structura - functii biologice
Mioglobina (Mb) este o proteina globulara compacta, avand masa moleculara de 17,2 kD, alcatuita din hem legat de un singur lant polipeptidic cu 153 aminoacizi, globina, care prezinta structura primara, secundara si tertiara. Este cromoproteina din muschi care are rolul de a depozita oxigenul in tesutul muscular. La mamiferele care se scufunda, muschii contin mai multa mioglobina, la celelalte contin cantitati variabile, insa mai mari in muschii scheletici si miocard, conferindu-le acestora culoarea rosie.
Hemoglobinele (Hb) sunt si ele proteine globulare compacte, dar tetramerice, cu masa aproximativ 64,5 kD, continute in eritrocitele din sangele vertebratelor, alcatuite ca si Mb din hem si globina. Legaturile intre hem si globina sunt de aceeasi natura in Mb si Hb.
Hb indeplinesc roluri biologice importante:
contribuie la mentinerea constanta a echilibrului acido-bazic in sange printr-o mare capacitate de tamponare conferita de histidina, componenta proteica continand in proportie de aproximativ 10% acest aminoacid.
Structura mioglobinei si hemoglobinei. Hemul, grupa prostetica a mioglobinei si hemoglobinei, este alcatuit din protoporfirina IX si Fe2+ (vezi figura).
Protoporfirina IX este un derivat al unui nucleu format din 4 heterocicluri pirolice unite prin punti metinice (-CH=). Contine legaturi duble conjugate ce explica si capacitatea acestor sisteme de a absorbi in vizibil (hemoglobina absoarbe la 405 nm - banda lui Sort).
In functie de intensitatea luminii absorbite, se poate face dozarea hemoglobinei.
Lipsa conjugarii la unii intermediari de sinteza (uroporfirinogen, coproporfirinogen) se traduce prin absenta culorii. In lumina UV, hemoglobina prezinta fluorescenta.
Prin includerea ionului Fe2+ in nucleul protoporfirinei IX rezulta hemul. Dintre cele sase valente ale ionului Fe2+, patru sunt satisfacute de protoporfirina IX, la valentele a 5-a si a 6-a, perpendiculare pe planul protoporfirinei, putandu-se lega diferiti liganzi (O2, CO, NO).

Structura hemului hidratat
In hemul liber, reactia cu oxigenul la una din cele doua valente libere poate determina oxidarea ireversibila a Fe2+ la Fe3+, hemina rezultata neputand lega oxigenul.
Reactia de oxidare este impiedicata prin sechestrarea hemului intr-o structura proteica in care accesul la valentele libere ale Fe2+ este restrictionat. In aceasta forma, valenta a 5-a este satisfacuta de un rest de histidina din globina, iar a sasea reprezinta situsul de legare pentru oxigen, legandu-se apoi de un rest de histidina din globina.
Globina este o proteina globulara continuta in toate proteinele transportoare de oxigen, existand mici diferente structurale intre acestea. Globina din mioglobina si hemoglobina contine un numar mare de resturi de histidina (aproximativ 10% in Hb) si se poate asocia cu o molecula de hem prin diferite interactiuni necovalente.
Globina are urmatoarele roluri:
formeaza un "buzunar" pentru hem
protejeaza ionul Fe2+ de oxidare pentru a interactiona cu molecula de oxigen;
formeaza "buzunarul" in care poate fi inclusa molecula de oxigen
Partea proteica a Hb adulte rezulta prin asocierea a patru catene polipeptidice, identice doua cate doua: 2 catene α, continand fiecare 141 aminoacizi si 2 catene β, fiecare alcatuita din 146 aminoacizi. Exista similaritate intre secventa de aminoacizi din lanturile globinei din Hb si cel al Mb, 27 dintre acestia fiind identici. Lanturile α si β se unesc doua cate doua formand un dimer αβ, iar ulterior se formeaza tetramerul α2β2 .
Fiecare catena include o molecula de hem, astfel ca tetramerul Hb contine 4 resturi hem.
Structura tetramerica a hemoglobinei este esentiala pentru functiile ei biologice.
Hemoglobinele pot cristaliza formand cristale specifice ca forma fiecarei specii. Specificitatea de specie este conferita de globina, care are un continut in aminoacizi diferit de la o specie la alta.
Legarea O2 la Mb si Hb. In oximioglobina (MbO2) si oxihemoglobina (HbO2) (forme cu oxigen), la a 6-a valenta a fierului se leaga molecula de oxigen (vezi figura).
Studiile de cristalografie cu raze X, au evidentiat modificari semnificative ale dispozitiei fierului fata de planul hemului atunci cand se leaga molecula de oxigen.
Pentru Mb astfel de deplasari sunt putin importante, insa ele afecteaza sever structura hemoglobinei si ele sunt raspunzatoare de proprietatile allosterice ale acesteia.
In oxihemoglobina (HbO2), legarea primei molecule O2 la lantul α1 determina deplasarea Fe2+ spre planul porfirinei. Aceasta deplasare determina modificari conformationale ce sunt transmise lanturilor adiacente crescandu-le afinitatea pentru oxigen.
Efectul se numeste efect cooperativ pozitiv si din acest motiv aspectul curbei de saturare cu oxigen este diferit la hemoglobina si mioglobina (vezi figura).

Reprezentarea schematica a legarii hemului de globina
Mb, fiind proteina de rezerva de oxigen, leaga O2 dupa o curba cu aspect hiperbolic, avand afinitate mai mare pentru oxigen decat Hb la orice presiune.
O proteina care leaga O2 dupa o curba hiperbolica nu poate functiona ca proteina transportoare de O2, deoarece daca are afinitate mare, il poate fixa in plamani, la o presiune crescuta, dar nu-l poate ceda tesuturilor. Daca il fixeaza cu afinitate mai mica pentru a-l putea ceda tesuturilor, nu s-ar incarca la plamani cu o cantitate suficienta de O2.
Hb poate functiona ca proteina de transport de O2. Aceasta are o curba de saturare cu aspect sigmoid. Se satureaza cu oxigen in plamani, unde pO2 este de aproximativ 100 torri si cedeaza oxigenul in tesuturi unde presiunea din capilare este 40 torri.
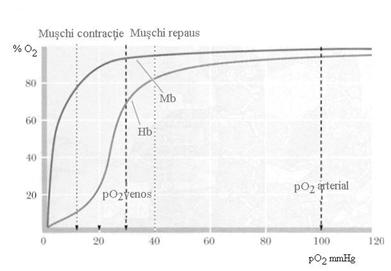
Curba de saturare cu oxigen ale Mb si Hb
Modulatori ce influenteaza legarea O2 la hemoglobina Legarea oxigenului la hemoglobina este influentata de concentratia H+, CO2, si de acidul 2,3-difosfogliceric (DPG).
Deoxihemoglobina are o afinitate mai mare pentru H+ decat oxihemoglobina. Daca pH-ul scade, se accentueaza disocierea HbO2.
![]()
Deci H+ este un antagonist al legarii oxigenului la hemoglobina.
Importanta biologica a acestei modulari rezida in faptul ca, in tesuturile in care mediul se acidifiaza ca rezultat al unor procese metabolice, se elibereaza mai usor oxigenul necesar.
Dioxidul de carbon (CO2) influenteaza oxigenarea hemoglobinei similar cu ionii H+, deoarece la dizolvarea lui in sange se formeaza H+. Anhidraza carbonica din hematii catalizeaza hidratarea CO2, iar protonii rezultati la ionizarea acidului sunt preluati de Hb si disociaza O2.
![]()
![]()
Ionii bicarbonat (HCO3-) sunt transportati la plamani. Cand hemoglobina se oxigeneaza din nou in plamani, H+ sunt eliberati, reactioneaza cu ionul HCO3- pentru a forma acidul carbonic din care rezulta CO2 ce se elimina prin respiratie. O parte din CO2 se leaga de hemoglobina, sub forma de carbamat la resturile amino, rezultand carbhemoglobina.
Un alt factor care influenteaza acceptarea O2 de catre hemoglobina este acidul 2,3-difosfogliceric (DPG). Legarea DPG la hemoglobina duce la eliberarea O2 Eritrocitele contin o concentratie de DPG echivalenta celei a hemoglobinei, de aproximativ 4,5 mM.
Legarea DPG stabilizeaza hemoglobina in forma neoxigenata, forma oxigenata avand o cavitate centrala mult prea redusa pentru legarea acestuia.
Importanta fiziologica a interactiunii DPG - Hb. Interactiunea permite adaptarea multor mamifere (primate, om) in conditiile unor presiuni reduse ale O2 (de exemplu, la altitudine, in hipoxie). Cand organismul se gaseste in conditii in care pO2 este mai mica, cantitatea de DPG creste determinand scaderea afinitatii hemoglobinei pentru O2, acesta fiind mai usor eliberat in tesuturi. La alte mamifere (cal, oaie, capra), hemoglobina are o afinitate mai mica pentru O2 si DPG nu este important pentru acestea.
Hemoglobine fiziologice In eritrocitele umane, in diferite perioade de viata, s-au identificat urmatoarele tipuri de hemoglobina care difera intre ele prin natura lanturilor, toate continand lanturile : HbA (α2β2), HbA2 (α2δ2), HbF (α2γ2), HbE2(α2ε2), HbE1(ε4).
HbE (hemoglobina embrionara) se sintetizeaza in primele luni dupa conceptie, mai intai ca HbE1 (Gower) si apoi HbE2. Ulterior, ea este inlocuita de HbF (hemoglobina fetala), majoritara intre lunile 3 si 8 de viata intrauterina.
Din luna a 3-a, incepe sa se sintetizeze si HbA (hemoglobina adulta), dar aceasta predomina abia dupa nastere. In viata extrauterina, sangele mai contine si o alta hemoglobina adulta, HbA2.
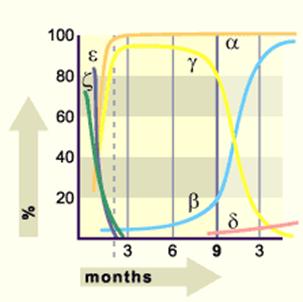
Lanturile Hb predominante in perioada intra si extrauterina
Fiecare din cele patru tipuri de hemoglobina se caracterizeaza prin:
HbF se deosebeste de HbA prin afinitatea pentru O2. Deoarece HbF nu are lanturi β, ci doua lanturi γ, aceasta interactioneaza cu DPG mai putin. De aceea, HbF are afinitate mai mare pentru O2 putandu-l lega la presiuni la care este disociat de pe HbA, ceea ce face posibila oxigenarea fatului de la mama prin schimbul de oxigen intre HbF si HbA.
calitative, se formeaza o hemoglobina cu secventa de aminoacizi diferita de cea normala, de exemplu HbS, HbC, Hb Malta, Sasketon, Boston;
cantitative, se formeaza cantitate mai mica de Hb normala sau anormala datorita cantitatii deficitare a unuia din lanturi (talasemii).
Hemoglobina glicozilata (HbA1c) este o fractiune din HbA, glicozilata prin legarea ireversibila a glucozei la valina terminala din catena . In conditii normale, pentru o glicemie de 60 - 110 mg/dl, reprezinta ~ 7,5%. Aceasta creste proportional cu concentratia glucozei in sange, fiind un indice util pentru monitorizarea diabetului zaharat, concentratii mai mari de 10% indicand un control metabolic defectuos. Aceasta forma se poate separa prin cromatografie sau electroforeza.
Carboxihemoglobina (HbCO) se formeaza prin legarea coordinativa a monoxidului de carbon (CO) la ionul Fe2+ din hem. Reactia este reversibila, afinitatea hemoglobinei pentru CO fiind de aproximativ 200 ori mai mare decat pentru oxigen, astfel ca semisaturarea are loc la o presiune foarte mica (0,012 torri), astfel Hb devenind nefunctionala.
Pana la o concentratie de 10 % HbCO nu apar simptome caracteristice. Intre 10-30% apare cefalee, la 30-50% accentuarea cefaleei, confuzii mintale, greata, voma, accelerarea pulsului, coma, la 50-60% apar convulsii, iar dupa 60-70% soc anafilactic, insuficienta respiratorie, moarte. La concentratii de 80-90%, moartea survine in cateva secunde.
Methemoglobina (MetHb). Sub actiunea oxidantilor, Fe2+ din hem se oxideaza la Fe3+ cu formarea heminei, grupa prostetica a methemoglobinei, ce nu poate transporta oxigenul. MetHb se formeaza fiziologic in mod continuu in eritrocite, dar este redusa rapid la Hb de un sistem in care intervin methemoglobin reductazele I si II, vitamina C si glutationul redus (GSH). Afectarea genetica a sintezei celor doua enzime determina acumularea MetHb si duce la lezarea membranei eritrocitare. Nou nascutii prezinta o tendinta mai mare spre methemoglobinemie, datorita unei insuficiente a sistemelor enzimatice, sensibilitatii mai mari a HbF la oxidare, hipovitaminozei C. La acestia apare si icter hemolitic.
Cantitatile mari de nitriti si nitrati pot favoriza, de asemenea, formarea MetHb. Unele medicamente determina producerea unei cantitati mai mari de MetHb ce depaseste capacitatea reductazelor existente de a o transforma in forma redusa:
a) antipiretice si analgezice: paracetamol, acetanilida, fenazol;
b) agenti antibacterieni: sulfamide, cloramfenicol;
c) agenti antimalarici: chinina;
d) compusi continuti de unele preparate dermice: unguente cu benzocaina, pirogalol.
Citocromii
Aceste heteroproteine au fost descrise, la inceput, ca pigmenti similari celor sanguini de catre Mac Munn (1886) si redenumiti citocromi pe baza calitatilor spectrale (Keilin, 1925).
In aceasta clasa de cromoproteine sunt incluse toate hemoproteinele intracelulare legate de particulele subcelulare ce au una din urmatoarele functii biologice:
intervin in conservarea energiei, fotosinteza si in metabolismul unor bacterii anaerobe;
intervin in reactii de metabolizare a unor compusi endogeni si exogeni (xenobiotice).
Functia transportoare de electroni se manifesta prin schimbarea valentei fierului din grupa prostetica sau prin schimbul de protoni:
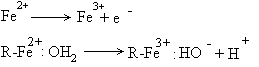
Clasificarea citocromilor se face in functie de mai multe criterii: structura grupei prostetice si modul de legare cu apoproteina, spectrele de absorbtie, potentialul redox.
Sunt denumiti, in general, cu literele mici ale alfabetului latin, urmate de anumiti indici numerici: a, a3, b, b5, c. Exista insa si denumiri particulare, de exemplu citocromii P450.
Citocromul c este o hemoproteina cu masa moleculara mica (M = 12,4 kD) alcatuita din 104 aminoacizi. Este continut in mitocondrii si se izoleaza usor din miocard. Este o proteina globulara, cu forma aproape sferica.
Citocromul c este o componenta a lantului redox din membrana mitocondriala. Citocromul c este si un mediator al procesului de moarte celulara programata (apoptoza), eliberarea sa in citoplasma ca efect al unor semnale intramitocondriale fiind importanta in continuarea evenimentelor citoplasmatice implicate in acest proces.
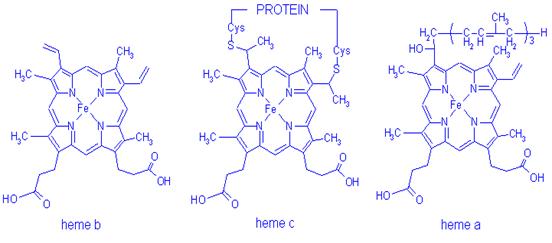
Structura hemului a, b, c
Citocromul b este tot o hemoproteina mitocondriala care are rol in desfasurarea transferului de electroni si H+ prin membrana mitocondriala. Contine acelasi hem ca si Hb.
Citocromul a este o hemoproteina mitocondriala componenta a lantului respirator care se caracterizeaza prin prezenta unei catene izoprenoidice cu 15 atomi de carbon la grupa vinil din pozitia 2 a hemului si prin transformarea grupei metil din pozitia 8 in grupa formil (-CHO). Intervine in transferul de electroni si H+ prin membrana mitocondriala in respiratia celulara.
Citocromul b5 este o hemoproteina continuta in microzomi fiind component al lantului oxidativ de la nivelul reticulului endoplasmatic neted implicat in procese biochimice particulare, cum ar fi desaturarea acizilor grasi.
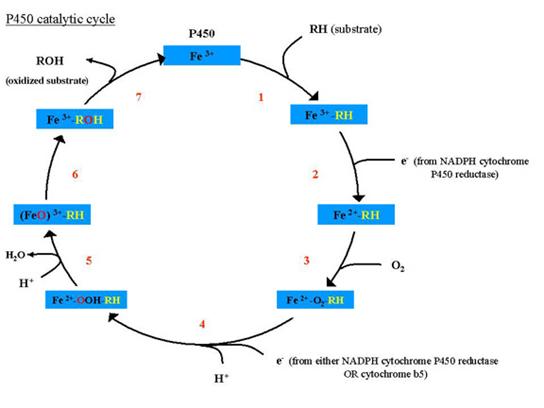
Citocromii P450 sunt reprezentati de cateva sute de hemoproteine prezente in aproape toate celulele mature, cu exceptia eritrocitelor si muschilor scheletici, denumite astfel datorita maximului de absorbtie pe care complexele cu CO ale formelor reduse il prezinta la 450 nm. Sunt grupati in mai multe familii, in fiecare familie (numerotata cu cifre arabe) existand mai multe subfamilii denumite cu literele alfabetului latin (Cyp 2A, Cyp 3C etc).
Sunt proteine oligomere alcatuite din 16 monomeri ce contin 8 molecule de hem.
Se gasesc in veziculele reticulului endoplasmatic neted si fac parte dintr-un sistem transportor de e- nefosforilant a carui energie este utilizata pentru monooxigenarea substratului (oxidaze cu functie mixta)
Sistemul oxidazelor cu functie mixta microzomale (OFMM) intervine in metabolizarea unor compusi endogeni si exogeni (hemoglobina, colesterol, medicamente, alcool, etc.), avand specificitate de substrat diferita. Multe procese metabolice ce se desfasoara cu participarea sistemului citocromilor P450:
reactiile de aromatizare si hidroxilare din biosinteza hormonilor steroizi;
oxidarea eicosanoidelor;
hidroxilarea vitaminei D3 etc.
Inducerea enzimelor din acest sistem are importanta medicala deoarece reprezinta mecanismul biochimic al interactiunilor dintre medicamente.
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 8414
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2025 . All rights reserved