| CATEGORII DOCUMENTE |
| Astronomie | Biofizica | Biologie | Botanica | Carti | Chimie | Copii |
| Educatie civica | Fabule ghicitori | Fizica | Gramatica | Joc | Literatura romana | Logica |
| Matematica | Poezii | Psihologie psihiatrie | Sociologie |
Cinetica reactiilor complexe (opuse, paralele si consecutive)
Tratamentul cinetic al reactiilor complexe se bazeaza pe principiul independentei reactiilor elementare care au loc simultan intr-o retea de reactii cuplate. Conform acestui principiu, constanta de viteza a unei reactii elementare are aceeasi valoare daca reactia
se desfasoara ca reactie izolata sau daca face parte dintr-o retea de reactii cuplate. Principiul se refera la sistemele ideale. Cand rezultatul reactiilor modifica sensibil mediul de reactie (solventul, taria ionica), se constata abateri de la acest principiu.
1. Reactii opuse, bilaterale sau antagoniste
Reactiile opuse, bilaterale, sau antagoniste rezulta prin cuplarea a doua reactii numite conventional reactia directa (scrisa de la stanga la dreapta) si reactia inversa, conform modului uzual de scriere. Produsii reactiei directe sunt reactanti pentru reactia inversa, iar produsii acesteia sunt reactantii reactiei directe. Din legea conservarii masei rezulta ca cele doua reactii sunt reprezentate cantitativ de o singura ecuatie stoichiometrica.
Reactiile opuse pot rezulta din combinarea oricaror tipuri de reactii elementare (mono, bi si trimoleculare) si sunt scrise simbolic (in aceasta lucrare) prin utilizarea unei sageti cu doua sensuri
![]()
Daca la
momentul initial sunt prezenti numai reactantii reactiei directe, atunci viteza
acesteia este maxima, iar viteza reactiei inverse este nula. Exista evident si
posibilitatea ca procesul sa inceapa cu orice compozitie initiala, incluzand si
pe cea in care sunt prezenti numai reactantii reactiei inverse. Prin scaderea
vitezei reactiei directe si cresterea vitezei reactiei inverse se ajunge la starea
de echilibru, cand ![]() . Putem
specifica starea de echilibru utilizand simbolul . Cele doua stari distincte ale unui sistem
de reactii opuse sunt ilustrate in Figura 7.
. Putem
specifica starea de echilibru utilizand simbolul . Cele doua stari distincte ale unui sistem
de reactii opuse sunt ilustrate in Figura 7.

Figura 7. Ilustrarea perioadelor tranzienta si echilibrata cu ajutorul
curbelor cinetice CA(t) si CB(t)
Vom considera pentru inceput un sistem de doua reactii monomoleculare opuse: A B. Sistemul este descris de ecuatia stoichiometrica A = B, iar la atingerea starii de echilibru este reprezentat prin: A = B. (In literatura de specialitate se utilizeaza si alte simboluri, sau se utilizeaza numai ultimul simbol pentru oricare dintre stari, cu precizarea acestora). Utilizarea ultimei notatii a condus la adoptarea notiunii discutabile de "reactie reversibila". O reactie reversibila reprezinta, in acceptia termodinamica, un
ansamblu de doua reactii opuse cu viteze egale. Pentru a marca specificul reactiilor opuse, uneori se foloseste denumirea de reactie reversibila cinetic. Din punct de vedere teoretic, pentru orice reactie "directa", exista si reactia inversa. Cand reactia inversa este
nedetectabila datorita limitarilor experimentale, reactia directa devine practic unilaterala (A B).
Evolutia temporala a unui sistem de reactii opuse poate sa fie descrisa de
o singura avansare ![]() , sau
, sau ![]() . Viteza globala de reactie este data de
diferenta dintre viteza reactiei directe si cea a reactiei inverse:
. Viteza globala de reactie este data de
diferenta dintre viteza reactiei directe si cea a reactiei inverse: ![]() . La
echilibru, cele doua viteze devin egale si vR 0 . Pana la atingerea
starii de echilibru, ecuatia cinetica are forma:
. La
echilibru, cele doua viteze devin egale si vR 0 . Pana la atingerea
starii de echilibru, ecuatia cinetica are forma:
![]()
Daca se utilizeaza avansarea volumica l se obtine: vR dl dt si
![]()
unde ![]()
Ecuatia cinetica este liniara in raport cu avansarea volumica l Cunoscand ![]() din masuratori experimentale si
determinand
din masuratori experimentale si
determinand ![]() prin derivare, ecuatia (81) poate fi
utilizata la evaluarea parametrilor
prin derivare, ecuatia (81) poate fi
utilizata la evaluarea parametrilor ![]() din graficul (sau regresia liniara):
din graficul (sau regresia liniara):
![]()
Reorganizand ecuatia (81) prin separarea termenilor care contin avansarea volumica l , se obtine:
![]()
unde ![]()
Ecuatia diferentiala (83) este asemanatoare cu cea a unui process monomolecular si poate fi integrata prin separare de variabile:
![]()
Evaluarea parametrilor ![]() este mai laborioasa cand se utilizeaza
ecuatia cinetica integrala. Dupa cum se poate verifica usor, ecuatia cinetica
integrala poate fi utilizata pentru a simula evolutia temporala a oricarui
sistem cand se cunosc parametrii cinetici si compozitia initiala.
este mai laborioasa cand se utilizeaza
ecuatia cinetica integrala. Dupa cum se poate verifica usor, ecuatia cinetica
integrala poate fi utilizata pentru a simula evolutia temporala a oricarui
sistem cand se cunosc parametrii cinetici si compozitia initiala.
Determinarea constantei de echilibru, ![]() , in conditii
mai avantajoase decat cele in care compozitia variaza, ajuta la evaluarea
parametrilor cinetici.
, in conditii
mai avantajoase decat cele in care compozitia variaza, ajuta la evaluarea
parametrilor cinetici.
Ecuatiile cinetice ale celorlalte tipuri de reactii opuse, in care una sau ambele reactii componente au molecularitati mai mari decat unu, nu mai sunt liniare in raport cu avansarea l . De exemplu, pentru reactia A B + C, ecuatia cinetica diferentiala are forma:
![]()
care poate fi adusa in forma:
![]()
Pentru oricare sistem de reactii opuse, format din reactiile elementare posibile, ecuatia cinetica diferentiala poate sa fie integrata. Solutiile se gasesc tabelate. O consecinta importanta a formei ecuatiei diferentiale neliniara decurge din posibilitatea aducerii ei intr-o forma liniara, atunci cand avansarea reactiei are valori suficient de mici, incat termenii care contin l si eventual l pot fi neglijati. O astfel de simplificare este posibila atunci cand l 1. Procesul de liniarizare a fost utilizat in cadrul metodelor de relaxare chimica. Procesul de relaxare a unui sistem apare atunci cand acesta este perturbat de la o stare de echilibru si lasat sa revina la o noua stare de echilibru. Cand aceasta revenire este insotita de transformari chimice, ea este numita relaxare chimica. Perturbarea starii de echilibru se poate face prin schimbarea concentratiei unui component sau prin schimbarea parametrilor externi (presiune, temperatura, camp electric). O schimbare rapida a parametrilor externi da posibilitatea studierii unor reactii foarte rapide, care nu mai pot fi urmarite prin amestecarea reactantilor, intrucat reactia se termina chiar in timpul amestecarii. In conditiile in care perturbarea echilibrului chimic este suficient de mica incat ecuatia cinetica a procesului de relaxare este liniara, procesul global de revenire la o noua stare de echilibru este de ordinul intai. Cand in sistem are loc o reactie singulara, curba cinetica este o exponentiala care arata ca variatia concentratiei unui component in timp este de forma:
![]()
unde DCmax este variatia maxima de concentratie, iar t este un parametru caracteristic numit timp de relaxare si este dependent de constantele de viteza ale celor doua reactii opuse si de concentratiile componentilor implicati. Masurarea experimentala a timpilor de relaxare pentru diferite compozitii da posibilitatea evaluarii celor doua constante de viteza. Pentru impactul avut asupra cineticii chimice a reactiilor rapide, initiatorul metodelor de relaxare chimica, profesorul Manfred Eigen, a primit premiul Nobel pentru chimie in 1967.
2. Reactii paralele
S-a aratat ca reactiile paralele pot fi gemene, ca de exemplu:

sau competitive, ca de exemplu:
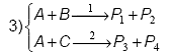
Orice sistem de reactii gemene formeaza o retea care, pentru descrierea
completa a evolutiei sale temporale, necesita masurarea unui numar de viteze de
transformare egal cu numarul de reactii din sistem: ![]() (33).
(33).
Pentru sistemul de reactii paralele 1), masurarea unei singure viteze de transformare dCA dt conduce la ecuatia:
![]()
care, prin
integrare, conduce la ![]() , unde
constanta globala k reprezinta suma celor doua constante k1
si k2. Ecuatia nu da o descriere completa a evolutiei
temporale a sistemului. Pentru o astfel de descriere se pot calcula vitezele de
transformare ale celor doi produsi:
, unde
constanta globala k reprezinta suma celor doua constante k1
si k2. Ecuatia nu da o descriere completa a evolutiei
temporale a sistemului. Pentru o astfel de descriere se pot calcula vitezele de
transformare ale celor doi produsi:

Prin integrarea celor doua ecuatii se obtine:
![]()
![]()
Cele doua ecuatii servesc atat la evaluarea parametrilor cinetici k1 si k2, cat si la simularea evolutiei sistemului.
Ponderea fiecareia dintre reactii poate fi redata cu ajutorul coeficientului de selectivitate. Pentru prima reactie, acesta poate fi definit ca:
![]() (90)
(90)
Analog se pot defini coeficientii de selectivitate pentru toate tipurile de reactii paralele.
3. Reactii consecutive
Datorita restrictiilor privind complexitatea schimbarilor structurale in reactiile elementare, cele mai multe dintre reactiile chimice naturale au loc sub forma unor succesiuni de reactii elementare. Studiul cineticii reactiilor consecutive devine astfel indispensabil in analiza evolutiei temporale a sistemelor chimice reactante, desi analiza cinetica a acestora este mai dificila.
Cea mai simpla retea de reactii consecutive consta in doua reactii monomoleculare:
![]() (91)
(91)
Reteaua contine doua reactii in care sunt implicati trei componenti.
Pentru descrierea evolutiei temporale a compozitiei sistemului sunt necesare doua viteze de transformare, care pot fi alese dintre cele trei posibile din sistem:
![]() (92)
(92)
![]() (93)
(93)
![]() (94)
(94)
Cele trei ecuatii cinetice diferentiale nu sunt independente, asa cum rezulta din legea conservarii masei:
![]()
din care se obtine prin derivare in raport cu timpul:
![]()
Se observa ca, daca se cunosc doua dintre vitezele de transformare, cea de a treia rezulta din ecuatia de mai sus. Caracteristicile cinetice ale sistemului pot fi discutate fie pe baza ecuatiilor cinetice diferentiale, fie pe baza celor integrale. Trebuie precizat ca, integrarea analitica nu se poate face decat pentru reactiile monomoleculare (de ordinul intai). Existenta unor procese bimoleculare (cu caracteristici experimentale de ordinul doi) conduce la imposibilitatea obtinerii unor solutii analitice. In aceste cazuri analiza cinetica se face fie ca pentru orice retea de reactii, fie pe baza unor simplificari care vor fi discutate in continuare.
Pentru sistemul (91), solutiile integrale se pot obtine dupa cum urmeaza:
prima reactie, (92), fiind monomoleculara, se integreaza direct conducand la:
![]()
- cea de a doua ecuatie este o ecuatie diferentiala neomogena de ordinul
intai, intrucat contine si variabila CA, care poate fi
separata in forma ![]() Partea omogena, din stanga, poate fi integrata
ca si ecuatia (92), introducand insa in locul constantei de integrare un factor
dependent de timp, Q(t), care poate fi determinat cu ajutorul ecuatiei
complete (93). Se obtine in prima etapa
Partea omogena, din stanga, poate fi integrata
ca si ecuatia (92), introducand insa in locul constantei de integrare un factor
dependent de timp, Q(t), care poate fi determinat cu ajutorul ecuatiei
complete (93). Se obtine in prima etapa ![]()
Introducand aceasta solutie in ecuatia completa (93) rezulta
![]()
care, prin integrare conduce la
![]()
unde a este o constanta de integrare.
Daca ![]() si daca la t = 0 Q(t) = 0, constanta a este
data de
si daca la t = 0 Q(t) = 0, constanta a este
data de ![]()
Concentratia intermediarului B este data de:
![]()
Concentratia
produsului final C se poate calcula din bilantul de masa. Daca se pleaca
initial de la un sistem in care ![]() se obtine
se obtine ![]() , sau
, sau
![]() (98)
(98)
Graficul compozitiei sistemului este dat in Figura
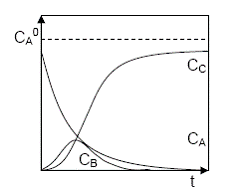
Figura Variatia in timp compozitiei unui sistem de reactii consecutive A B C
Concentratia reactantului A scade exponential in timp, concentratia intermediarului B are un maxim, iar cea a produsului final C variaza dupa o curba cu un punct de inflexiune, situat in dreptul maximului intermediarului B.
Graficul reprezinta comportarea sistemului cand cele doua constante de viteza au valori comparabile. Exista si doua comportari extreme. Cand k1 >> k2, prima reactie este cu mult mai rapida decat cea de a doua. Reactantul A se consuma practic complet inainte ca intermediarul B sa se transforme semnificativ in produsul final C. Cele doua reactii au loc pe scale de timp diferite si sunt practic decuplate.
Cand k1 << k2, intermediarul B se consuma practic total imediat ce se formeaza. Valoarea concentratiei CB scade pana la valori mult mai mici decat concentratiile celorlalti componenti, devenind astfel un intermediar activ (CB << CA, CC). In acelasi timp, pozitia maximului pe axa timpului se deplaseaza spre zero. Timpul necesar atingerii concentratiei maxime a intermediarului activ reprezinta un reper important pentru evolutia concentratiei lui si este numit perioada de inductie. In aceasta perioada concentratia intermediarului activ este comparabila cu cea a produsului final C.
Setul de solutii integrale (95) - (97) pentru un intermediar activ ia forma mai simpla:
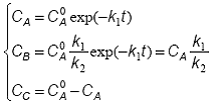
Deoarece k1 << k2, rezulta ca raportul k1/k2 << 1 si deci CB << CA. Viteza de transformare a intermediarului B ia de asemenea o forma simplificata:
![]()
Acest rezultat este utilizat in doua forme:
o ![]() , aratand ca
variatia in timp a concentratiei intermediarului activ, este nesemnificativa.
, aratand ca
variatia in timp a concentratiei intermediarului activ, este nesemnificativa.
Deseori, in locul semnului "≈", se utilizeaza semnul "=". Procedeul nu este corect intrucat ar conduce la concluzia gresita ca CB = constant, in contradictie cu rezultatul gasit anterior (CB CA (k k
o ![]() sau
sau ![]() , aratand ca,
pentru un intermediar activ, viteza de formare este practic egala cu viteza de
consum.
, aratand ca,
pentru un intermediar activ, viteza de formare este practic egala cu viteza de
consum.
Aproximatia stationaritatii
Acesta este unul dintre cele mai remarcabile rezultate ale cineticii reactiilor consecutive cuplate prin intermediari activi, numit aproximatia de intermediar activ sau aproximatia stationaritatii.
Ultima denumire provine din forma ![]() , deoarece
procesele stationare presupun invarianta lor in timp. Denumirea de aproximatia
cvasistationaritatii este mai apropiata de adevar.
, deoarece
procesele stationare presupun invarianta lor in timp. Denumirea de aproximatia
cvasistationaritatii este mai apropiata de adevar.
Dupa cum se poate verifica cu usurinta, adoptarea acestei aproximatii conduce la transformarea ecuatiei cinetice diferentiale referitoare la intermediarul activ intr-o ecuatie algebrica, ceea ce simplifica tratamentul cinetic.
Daca pentru secventa (91), formata din doua reactii monomoleculare, utilizarea aproximatiei de stationaritate reprezinta o alternativa simplificata, pentru secventele care contin cel putin o reactie bimoleculara, aceasta aproximatie reprezinta singura metoda analitica de a deduce o ecuatie cinetica.
Pentru o secventa de doua reactii bimoleculare cuplate prin intermediarul activ X:

aproximatia stationaritatii se poate scrie sub forma egalitatii dintre
viteza de formare, (vR
)f si cea de consum, (vR )c,
a intermediarului: ![]() . Concentratia
intermediarului activ, CX, in general atat de mica incat nu
poate fi detectata
. Concentratia
intermediarului activ, CX, in general atat de mica incat nu
poate fi detectata
experimental, poate fi determinata in functie de concentratiile componentilor stabili si de constantele de viteza ale reactiilor in care este implicat:
![]()
Conditia de intermediar activ pentru secventa cu doua reactii bimoleculare sau cu o reactie monomoleculara cuplata cu una bimoleculara necesita utilizarea probabilitatilor de reactie (wA << wX), spre deosebire de secventa cu doua reactii monomoleculare,
cand se puteau utiliza numai constantele de viteza.
Un tratament similar este aplicat si altor secvente cu etape bilaterale sau unilaterale, monomoleculare sau bimoleculare:
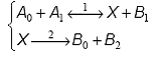
Intermediarul
X este activ atunci cand probabilitatile reactiilor de consum sunt cu mult mai
mari decat probabilitatile de reactie ale speciilor care conduc la formarea
acestuia: ![]() sau
sau ![]()
Conditia de stationaritate ia forma:

Conditia de stationaritate a unui intermediar activ se poate scrie in forma generala:
![]()
Concentratia intermediarului activ este data de:
![]()
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 1861
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2026 . All rights reserved