| CATEGORII DOCUMENTE |
| Astronomie | Biofizica | Biologie | Botanica | Carti | Chimie | Copii |
| Educatie civica | Fabule ghicitori | Fizica | Gramatica | Joc | Literatura romana | Logica |
| Matematica | Poezii | Psihologie psihiatrie | Sociologie |
Ecuatia completa a efectului termic al reactiei chimice. Temperatura teoretica de ardere
Ecuatia completa a efectului termic al unei reactii, tinand seama de caldurile latente de transformare de faza (L), de compozitia nestoechiometrica, de prezenta substantelor inerte si de reactii incomplete, se stabileste cu ajutorul ciclului de transformari schematizat in fig. XII.1, de unde:
Q1 + Q + Q2 + Q3 = 0
T fiind temperatura de referinta 298,16 oK.

Fig. XII.1. Ciclul pentru stabilirea ecuatiei termochimice complete
Rezulta:
 (XII.9)
(XII.9)
in care nA,
nB, reprezinta numarul de moli substanta care intra in reactie,
respectiv care ies din reactie; ![]() este entalpia unitatii
de reactie la T0 si Δλ este variatia gradului de
avansare al reactiei.
este entalpia unitatii
de reactie la T0 si Δλ este variatia gradului de
avansare al reactiei.
Pentru T1 = T2 = T0 si Δλ = 1, se obtine Q = +ΔHT.
Ecuatia (XII.9) permite calculul temperaturii T2 obtinute prin reactie intr-un reactor adiabatic, cunoscand temperatura reactantilor T1, caldura de reactie la T0 si capacitatile calorice molare.
In calcule se pot utiliza expresiile empirice Cp = a + bT + CT2 sau tabele cu valorile energiei interne U, de exemplu tabela XII.1.
Exemplul 6. Sa se calculeze temperatura maxima a flacarii metanului care arde cu 20% exces de aer, daca atat metanul cat si aerul sunt preincalziti la 300 oC.
Rezolvare:
Ecuatia de ardere a metanului este:
![]()
![]()
Presupunand arderea completa, fara reactii secundare, se pot calcula valorile (in ordinea N2, O2, CH4, respectiv H2O, CO2):
![]()
![]()
![]()
![]()
![]()
![]()
Presupunand o temperatura t2 = 2000 oC si inlocuind in ecuatia (XII.9) sub forma:
![]()
![]()
se obtine (LA si LB fiind nule): -25130 + 241900 - 212790 - 0 ≠ 0.
Se observa faptul ca t2 ales este putin prea mare. Dupa cateva aproximatii se gaseste t2 = 1970 oC.
Trebuie sa se remarce ca valoarea obtinuta nu reprezinta temperatura exacta reala, deoarece caldurile specifice nu sunt determinate cu exactitate la temperaturi inalte si intervin reactii suplimentare, de exemplu disocierea CO2 si H2O(g). Astfel, la 2200 K (1927 oC) si la o presiune totala de 1 at, vaporii de apa sunt disociati in proportie de 1,5% in H2 si O2, iar CO2 este disociat in proportie de 5% in CO si O2 si cu siguranta ca in flacara gradele de disociere sunt cu mult mai mari, din cauza presiunii partiale scazute a gazelor.
Prin metodele de determinare a temperaturii flacarii este si metoda spectrografiei flacarii, care permite si dozarea constituentilor gazelor arse.
Denumirea de temperatura a flacarii este criticabila, deoarece introducerea oricarui corp de masurat modifica conditiile de ardere (de exemplu reactii la suprafata). Se intelege astfel avantajul metodei spectrografice. Temperatura flacarii, calculata prin procedeul expus, reprezinta o valoare maxima. Temperatura masurata este de ordinul 0,7-0,8 din temperatura calculata.
Exemplul 7. Sa se calculeze temperatura flacarii de ardere a propanului cu cantitatea stoechiometrica de aer, presupunand ca temperatura reactantilor este de 25 oC.
Rezolvare:
Deoarece se cunosc constantele de disociere ale acestor substante, pentru o evaluare corecta a temperaturii se vor considera echilibrele:
![]() (a)
(a)
![]() (b)
(b)
![]() (c)
(c)
(disocierea apei conform reactiei (c) cu punere in libertate de OH este dovedita spectroscopic).l
Toate cantitatile de produsi se refera la 1mol propan si se fac notatiile urmatoare:
n1 - numarul de moli CO2 stoechiometric echivalent la arderea completa a unui mol combustibil;
n2 - numarul de moli de H2O stoechiometric echivalent la arderea completa a unui mol combustibil;
x - fractiunea de moli CO2 disociata conform ecuatiei (a);
y - fractiunea de moli H2O disociata conform ecuatiei (b);
z - fractiunea de moli H2O disociata conform ecuatiei (c).
La echilibru se obtine:
moli CO2 = n1(1 - x)
moli CO = n1x
moli H2O = n2(1 - y - z)
moli OH = n2z
![]()
![]()
moli N2 = n3
In total ![]() moli.
moli.
Deoarece x, y si z sunt mici fata de unitate, se poate considera numarul total de moli n= n1 + n2 + n3.
Calculand presiunile partiale la echilibru:
![]() ;
; ![]() etc.
etc.
constantele de echilibru ale celor trei reactii vor fi exprimate astfel:

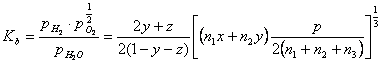

Aceste trei ecuatii cu trei necunoscute nu pot fi rezolvate deoarece, necunoscand temperatura flacarii, Ka, Kb si Kc sunt necunoscute. A patra ecuatie necesara rezulta din entalpia combustiei adiabatice a propanului (n1 = 3; n2 = 4):
![]()
![]() (d)
(d)
Deoarece se cunosc entalpiile molare si caldurile molare, se obtine astfel un sistem de patru ecuatii cu patru necunoscute x, y, z, T, care permite o solutie determinata a problemei. Rezolvarea explicita a acestor ecuatii este imposibila si se recurge la metoda aproximatiilor succesive.
Se poate considera ca amestecul initial de aer
si propan se incalzeste la temperatura de reactie T si apoi se atinge echilibrul, sau se poate considera ca reactia
decurge la 25 oC atingand echilibrul corespunzator temperaturii T si amestecul de gaze se incalzeste la
temperatura T. Deoarece in tabele se
gasesc de multe ori valorile energiei interne la diferite temperaturi (in exces
fata de energia de zero), este preferabila metoda a doua. Tabela XII.1 contine
valorile  pentru cateva gaze
obisnuite, in cal ∙ mol-1 . Entalpia se poate calcula imediat
adaugand 1,98 T.
pentru cateva gaze
obisnuite, in cal ∙ mol-1 . Entalpia se poate calcula imediat
adaugand 1,98 T.
Folosind urmatoarele valori pentru caldurile de formare:
|
|
|
|
C3H8 | |
|
CO2 | |
|
CO | |
|
H2O(g) | |
|
OH |
caldura de reactie a reactiei (d) este data de ecuatia:
![]()
Aceasta caldura de reactie trebuie sa fie egala cu suma entalpiilor produsilor si azotului (si oxigenului in cazul unui exces de aer) intre 298,16 si T K
Pentru 1 mol propan sunt necesari ![]() , deci produsul contine n3 = 18,8 mol azot.
, deci produsul contine n3 = 18,8 mol azot.
Entalpia totala a produsilor este deci:
![]()
![]() (f)
(f)
si trebuie sa fie egala cu ![]() din ecuatia (e).
din ecuatia (e).
Deoarece numarul total de moli n=25,8, rezulta
![]()
unde 51,26 = 25,8 R
Deoarece ![]() si
si ![]() ecuatia (f) devine:
ecuatia (f) devine:
![]()
![]() (g)
(g)

Fig. XII.2. Diagrama constantelor de echilibru
Valorile energiei interne care trebuie inlocuite in aceasta relatie sunt valorile date in tabela minus energia interna la 298 K.
Cu ajutorul valorilor numerice ale constantelor de echilibru din (fig. XII.2) se pot evalua x, y, z si T (Kb si Kc se determina pe ordonata din dreapta).
Presupunand T = 2250 K si p = 1 at, se obtine:
Ka = 8,8 · 10-3; Kb = 1,68 · 10-3; Kc = 2,53 · 10-3
si deci
![]()
![]()
![]()
de unde: x = 0,1; y = 0,006, z = 0,04.
Inlocuind aceste valori in ecuatia (e) se obtine:
![]()
Tabela XII.1. Energia interna  a gazelor, in cal
∙ mol-1
a gazelor, in cal
∙ mol-1
|
Temperatura, K |
H2 |
O2 |
N2 |
CO |
NO |
OH |
CO2 |
H2O |
|
| ||||||||
Calculand ![]() pentru ecuatia (g), rezulta:
pentru ecuatia (g), rezulta:
![]()
si
![]()
Se observa ca entalpia de reactie este 458080 cal, iar cresterea entalpiei produsilor intre 298 si 2250 K este 450280 cal, obtinandu-se o diferenta de 1,7%. Dupa cateva incercari se obtine valoarea de 1994 oC.
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 2862
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2026 . All rights reserved