| CATEGORII DOCUMENTE |
| Demografie | Ecologie mediu | Geologie | Hidrologie | Meteorologie |
Apa industriala este apa necesara realizarii unui numar mare de procese tehnologice din diferite ramuri industriale si alimentarii cazanelor cu abur.
In industria chimica, apa are foarte multe utilizari, fie ca dizolvant pentru gaze sau diferite substante, fie ca reactant in numeroase reactii, fie ca agent purtator de caldura, utilizata pentru incalzire si racire.
Calitatea apei necesara industriei chimice variaza in functie de operatia in care este utilizata. Sunt instalatii care impun utilizarea unei ape demineralizate, adica lipsita complet de anioni si cationi. Apa folosita ca reactant trebuie sa fie fara culoare, limpede, sa nu contina saruri de fier si mangan si nici compusi organici.
Apa naturala, folosita in scopuri industriale, nu satisface toate conditiile impuse de fiecare ramura industriala din cauza diferitelor substante dizolvate pe care le contine. Este necesara deci o pregatire a apei prin diferite metode, alese atat dupa natura apei, cat si dupa necesitatile impuse de folosirea ei.
Dupa compozitia chimica a sarurilor care predomina, apele pot fi:
ape calcaroase, care au un continut mare de saruri de calciu;
ape selenitoase, care contin preponderent sulfat de calciu si magneziu;
ape feruginoase, care contin bicarbonat feros si hidroxid feros;
ape magneziene, care contin saruri de magneziu;
ape dure, care au un continut ridicat de saruri de calciu si magneziu;
ape alcaline, care contin carbonati acizi alcalini si alcalino-pamantosi.
In afara acestor saruri, apele naturale mai pot contine siliciu sub forma coloidala ca acid metasilicic (H2SiO3) sau ca metasilicat de magneziu sau potasiu (MgSiO3, K2SiO3) si de asemenea pot contine dizolvate gaze ca CO2 si O2.
Toate aceste substante care se gasesc dizolvate in apa aduc prejudicii in folosirea ei. Astfel, sulfatul de calciu, bicarbonatul de calciu si magneziu si silicea din apa utilizata la alimentarea generatorilor de abur se depun pe peretii cazanelor si conductelor, formand o crusta aderenta care micsoreaza coeficientul de transmitere a caldurii si care poate provoca chiar explozii datorita supraincalzirilor locale a tablei cazanului. Prezenta CO2 si O2 duce la ruginirea instalatiilor.
2 Fe + O2 + 4 CO2 + 2 H2O = 2 Fe(HCO3)2 (10)
2 Fe(HCO3)2 + O2 + H2O = 2 Fe(OH)3 + 4 CO2 (11)
Dioxidul de carbon rezultat din reactia (11) isi continua actiunea coroziva dupa reactia (10), atat timp cat exista oxigen in apa.
Apele cu continut mare de saruri de calciu si magneziu prezinta inconveniente si la folosirea apei in spalatorii, deoarece consuma inutil sapun prin formarea de sapunuri de Ca, Mg, Fe, insolubile. Consumul inutil de sapun este in functie de continutul de saruri, dupa cum rezulta din tabelul urmator:
Consumul de sapun in functie de continutul de saruri de calciu si de magneziu din apa dura
|
Continutul de
saruri de calciu in | |||||
|
Din |
Se constata ca din 500g sapun adaugat
la
Pentru a inlatura inconvenientele prezentate, apele naturale necesare in diferite domenii industriale sunt supuse unor tratamente de purificare si corectare a calitatilor, care comporta urmatoarele etape: limpezire, dezinfectare, degazare, demenganizare, deferizare, desiliciere, dedurizare si demineralizare.
Operatiile de limpezire si dezinfectare se realizeaza ca si la apa potabila.
Degazarea se realizeaza prin insuflare de vapori de apa.
Cele mai importante operatii de purificare a apelor industriale sunt dedurizarea si demineralizarea.
Sarurile de calciu si magneziu dizolvate in apa ii confera duritate. Duritatea apei poate fi:
- duritate temporara, Dt, determinata de prezenta in apa a carbonatilor de calciu si de magneziu. Prin fierberea apei, bicarbonatii se descompun, dupa reactiile:
Ca(HCO3)2 = CaCO3 + CO2 + H2O (12)
Mg(HCO3)2 = MgCO3 + CO2 + H2O (13)
Carbonatii se depun sub forma de precipitate.
- duritatea permanenta, Dp, determinata de prezenta in apa a clorurilor si sulfatilor de calciu si magneziu. Aceste saruri raman dizolvate in apa chiar si dupa fierbere.
Suma duritatilor temporara si permanenta formeaza duritatea totala a apei DT:
DT = Dt + Dp.
Duritatea apei se exprima in grade germane. Un grad german corespunde la 10mg CaO/l (totalitatea sarurilor de calciu si magneziu este socotita in echivalenti de CaO).
Dupa valoarea duritatii, apele industriale se clasifica in:
- ape foarte moi 1 - 5o Ge;
- ape moi 5 - 10o Ge;
- ape mijlocii 10 - 20o Ge;
- ape dure 20 - 30o Ge;
- ape foarte dure peste 30o Ge.
Prin dedurizarea apei se inteleg operatiile de indepartare a ionilor de calciu si de magneziu.
In prezent se cunosc multe procedee de dedurizare a apei si se aplica, in practica, in functie de natura duritatii apei, cat si de gradul de dedurizare cerut de diversele folosinte ale apei.
Procedeul termic. Pentru apele cu duritate temporara mare, aceasta se inlatura prin incalzirea apei aproape de fierbere. Bicarbonatii se descompun si precipitatele se depun ca namol:
toC
![]() Ca(HCO3)2 CaCO3
+ CO2 + H2O (14)
Ca(HCO3)2 CaCO3
+ CO2 + H2O (14)
Procedee chimice. Tratandu-se apa cu diferiti reactivi chimici, se poate inlatura aproape total duritatea apei. In tehnologiile moderne se aplica procedeul cu var si soda si procedeul cu schimbatori de ioni.
Procedeul cu var si soda. Aceasta metoda se bazeaza pe faptul ca hidroxidul de calciu precipita carbonatii acizi care alcatuiesc duritatea temporara si neutralizeaza dioxidul de carbon, iar carbonatul de sodiu precipita sarurile care formeaza duritatea permanenta.
Ionii de calciu se indeparteaza sub forma de carbonat, iar cei de magneziu sub forma de hidroxid, Ca(OH)2 si MgCO3 fiind partial solubili.
In prima etapa, la tratarea apei cu lapte de var au loc urmatoarele reactii:
Ca(HCO3)2 + Ca(OH)2 = 2 CaCO3 + 2 H2O (15)
Mg(HCO3)2 + Ca(OH)2 = MgCO3 + CaCO3 + 2H2O (16)
CO2 + Ca(OH)2 = CaCO3 + H2O (17)
Prin tratarea ulterioara cu soda, clorurile si sulfatii precipita tot sub forma de carbonati:
CaCl2 + Na2CO3 = CaCO3 + 2 NaCl (18)
MgCl2 + Na2CO3 = MgCO3 + 2 NaCl (19)
MgSO4 + Na2CO3 = MgCO3 + Na2SO4 (20)
CaSO4 + Na2CO3 = CaCO3 + Na2SO4 (21)
Carbonatul de magneziu, fiind partial solubil, se va gasi partial in solutie. Precipitarea totala a lui se va realiza cu un exces de lapte de var sau cu hidroxidul de sodiu rezultat din reactia de caustificare a carbonatului de sodiu:
MgCO3 + Ca(OH)2 = CaCO3 + Mg(OH)2 (22)
Ca(OH)2 + Na2CO3 = 2 NaOH + CaCO3 (23)
MgCO3 + 2 NaOH = Mg(OH)2 + Na2CO3 (24)
Se cunosc doua variante ale acestui procedeu: cu var rece si cu var cald. Procedeul cu var cald se intrebuinteaza mai ales pentru purificarea apei folosite la alimentarea cazanelor de abur. Desfasurarea procesului are loc la temperatura de 40- 60oC, fapt care accelereaza reactiile, ajuta la decantarea namolului si la descompunerea partiala a carbonatilor acizi.
Cantitatile de reactivi se stabilesc printr-un calcul stoechiometric, in functie de duritatea apei.
Operatia de dedurizare se realizeaza intr-o instalatie fig. 7 alcatuita din doua reactoare, un dispozitiv pentru prepararea laptelui de var, ventile si pompe pentru evacuarea precipitatelor, filtru pentru retinerea suspensiilor fine.
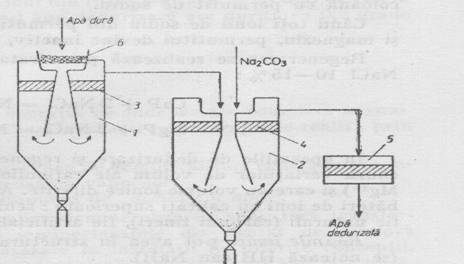
Fig.7. Instalatia de epurare a apei prin procedeul cu var si soda .
1 - reactor pentru tratare cu lapte de var.
2 - reactor pentru tratare cu soda
3,4 - filtre in interiorul reactoarelor
5 - filtru
6 - dispozitiv pentru preparearea laptelui de var
Laptele de var se prepara in dispozitivul 6 si trece cu apa bruta in reactorul 1, unde au loc reactiile (15 - 17). Apa eliberata de duritatea temporara trece prin filtrul 3 in reactorul 2, unde se adauga solutia de carbonat de sodiu. Aici au loc reactiile (18-24). Apa dedurizata trece prin filtrele 4 si 5 la consumator. Precipitatele se evacueaza din reactoarele 1 si 2 cu ajutorul pompelor.
Procedeul cu schimbatori de ioni. In industriile moderne dedurizarea apei se realizeaza cu ajutorul schimbatorilor de ioni. Schimbatorii de ioni sunt substante naturale (zeoliti, carbuni tineri) sau artificiale (permutiti, rasini) insolubile in apa, acizi sau baze si care in structura lor complexa au un cation sau anion slab legat pe care pot sa-l schimbe usor cu un alt cation sau anion dintr-o solutie cu care vin in contact.
Substantele care pot schimba cationii se numesc cationiti sau schimbatori de cationi, iar cele care pot schimba anionii se numesc anioniti sau schimbatori de anioni.
Primele substante utilizate la dedurizarea apei au fost zeolitii. Zeolitii sunt aluminosilicati naturali cu formula generala Al2O3 n SiO2 Na2O, avand structura rigida formata din atomi de aluminiu, siliciu si oxigen, asemanatoare cu un fagure de miere, in ale carui goluri sunt asezati ionii de sodiu ce se pot misca cu usurinta. Cand apa trece prin zeoliti, ionii de sodiu ies din aceste goluri si trec in solutie, locul lor fiind luat de ionii de calciu si de magneziu.
Dupa inlocuirea aproape totala a ionilor de sodiu din zeolit, acesta se regenereaza, prin reactie inversa, trecand o solutie de clorura de sodiu prin zeolit. Mai tarziu s-au sintetizat schimbatorii de ioni asemanatori cu zeolitii, numiti permutiti, care au capacitate si viteza de schimb mai mare decat zeolitii.
Ionul de schimb in structura permutitului este tot sodiul. Permutitul de sodiu este reprezentat prin simbolul Na2P.
Trecand apa printr-un strat de permutit au loc reactiile:
Na2P + Ca(HCO3)2 = 2 NaHCO3 (25)
Na2P + Mg(HCO3)2 = MgP + 2 NaHCO3 (26)
Na2P + CaCl2 = CaP + 2 NaCl (27)
Na2P + MgSO4 = MgP + Na2SO4 (28)
Schimbul ionic fiind cantitativ, se poate obtine o apa dedurizata complet, dar care va avea o reactie bazica cu atat mai mare, cu cat duritatea temporara a apei brute a fost mai mare. De aceea in practica se trateaza mai intai apa cu lapte de var pentru inlaturarea duritatii temporare si apoi se trece prin coloana cu permutit de sodiu.
Cand toti ionii de sodiu din permutit au fost inlocuiti cu ioni de calciu si magneziu, permutitul devine inactiv, si se impune regenerarea lui.
Regenerarea se realizeaza prin tratarea permutitului cu o solutie de NaCl 10- 15%:
CaP + 2 NaCl = Na2P + CaCl2 (29)
MgP + 2 NaCl = Na2P + MgCl2 (30)
In operatiile de dedurizare si regenerare, permutitul se faramiteaza din cauza variatiilor de volum ale cationilor, care se schimba (Na+ cu Ca2+ si Mg2+) si care au volume ionice diferite. Aceasta a dus la cautarea altor schimbatori de ioni cu calitati superioare: schimbatorii de ioni de natura organica, fie naturali (carbuni tineri), fie artificiali (rasini ionice).
Rasinile ionice pot avea in structura lor ca ion de schimb H+ sau Na+ (se noteaza HR sau NaR).
Pentru dedurizarea apei se utilizeaza rasini ionice in forma NaR si au loc aceleasi reactii ca in cazul folosirii permutitului de sodiu:
2 NaR + Ca(HCO3)2 = CaR2 + 2 NaHCO3 (31)
2 NaR + MgSO4 = MgR2 + Na2SO4 (32)
In industrie dedurizarea apei cu schimbatori de ioni se realizeaza in filtre cilindrice verticale construite din tabla de otel antiacid, umplute cu un strat de rasina cationica, avand ca suport un strat de pietris (fig. 8). Operatia de dedurizare cuprinde urmatoarele etape: afanarea cationitului, regenerarea, spalarea si dedurizarea.
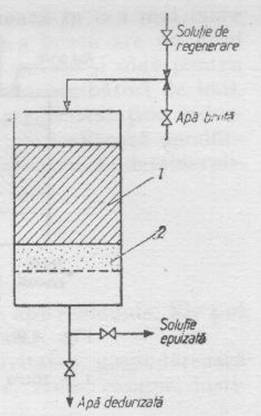
Fig. 8 . Schema instalatiei pentru dedurizarea apei cu schimbatori de ioni.
1 - coloana cu cationit
2 - start de nisip
Afanarea urmareste indepartarea impuritatilor de pe rasina si se realizeaza prin spalarea cu apa a rasinii circa 20 min. Pana cand apa de spalare nu mai este tulbure.
Regenerarea cationului este operatia prin care ccationitul isi recapata capacitatea de schimb. Regenerarea se realizeaza cu solutie de NaCl 10-15%, cand se urmareste ca ionul de schimb sa fie Na+, sau cu H2SO4 sau HCl 1-4%, cand ionul de schimb trebuie sa fie H+. Reactiile care au loc sunt:
CaR2 + 2 NaCl = 2 NaR + CaCl2 (33)
MgR2 + 2 NaCl = 2 NaR + MgCl2 (34)
Spalarea care are ca scop indepartarea urmelor agentilor de regenerare si a produsilor rezultati in procesul de regenerare, se efectueaza cu apa demineralizata timp de 30 min.
Dedurizarea apei se realizeaza prin trecerea apei dure prin filtrul cu cationit cu o viteza reglata in functie de gradul de incarcare al filtrului.
Din practica s-a constatat ca dedurizarea este mai eficienta cand sensul de circulatie al apei dure prin filtru este invers sensului de circulatie al solutiei de regenerare si al apei de spalare.
Se considera ca schimbatorul de ioni din filtru s-a saturat cu ioni de calciu si magneziu si trebuie regenerat cand apa dedurizata are duritatea 0,2 grade germane.
Prin demineralizare se intelege operatia de indepartare completa a anionilor si cationilor dizolvati in apa. Demineralizarea apei se poate realiza prin procedee fizice si chimice.
Procedee fizice: cel mai simplu procedeu de demineralizare consta in evaporarea apei in vaporizatoare si condensarea vaporilor.
Procedeul este cunoscut sub denumirea de "distilare a apei" fara transformarea fazei, utilizand membrane semipermeabile din acetat de celuloza modificata sau fibre poliamidice, asezate in instalatii de diferite conceptii.
In membranele semipermeabile se concentreaza sarurile, rezultand apa pura.
Procedee chimice:
Demineralizarea totala a apei se poate realiza prin schimb ionic utilizand rasini schimbatoare de ioni. Operatia de demineralizare se poate realiza intr-o instalatie alcatuita din doua filtre, unul cu cation puternic acid si celalalt cu anionit puternic bazic sau dintr-un filtru cu strat mixt, format dintr-un cationit puternic acid amestecat cu un anionit puternic bazic.
Rasina cedeaza ionii de hidrogen si retine in schimb alti cationi din apa, conform reactiilor:
2HR + Ca(HCO3)2 = CaR2 + 2 CO2 + 2H2O (35)
2HR + MgSO4 = MgR2 + H2SO4 (36)
2HR + CaCl2 = MgR2 + 2HCl (37)
Demineralizarea apei se realizeaza trecand apa bruta printr-un filtru cu cationit unde are loc schimbul cationit (fig.9)
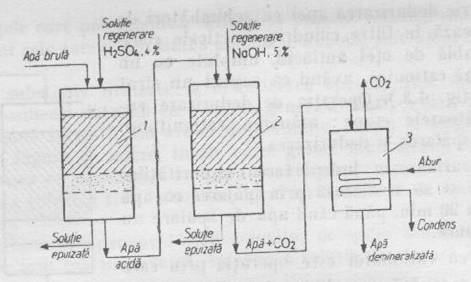
Fig.9 Schema instalatiei pentru demineralizarea apei cu schimbatori de ioni:
1 - filtru cu cationit (RH)
2 - filtru de anionit (ROH)
3 - degazor
Apa care iese din filtru cu cationit este acida; ea contine acizi minerali formati in urma schimbului ionic si CO2 provenit din duritatea temporara.
Dioxidul de carbon se inlatura trecand apa printr-un degazor in care dioxidul de carbon este eliminat prin incalzire cu aburi. Apa acida trece prin cel de-al doilea filtru cu anionit puternic bazic, unde se retin toti anionii, inclusiv acidul silicic, realizandu-se astfel si desilicierea apei.
2ROH + H2SO4 = R2SO4 + 2H2O (38)
ROH + HCl = RCl + H2O (39)
2ROH + H2SiO3 = R2SiO3 + 2H2O (40)
Apa trecuta prin filtrele cu schimbatori de cationi si anioni este demineralizata total si neutra (pH=7). Regenerarea rasinilor se realizeaza prin spalarea filtrului cationic cu o solutie H2SO4 4%.
CaR2 + H2SO4 = 2HR + CaSO4 (41)
MgR2 + H2 SO4 = 2HR + MgSO4 (42)
Si a celui anionic su o solutie de NaOH sau Na2CO3 5%
R2SO4 + 2 NaOH = 2 ROH + Na2SO4 (43)
RCl + NaOH = ROH + NaCl (44)
In tehnica moderna demineralizarea apei se realizeaza in cea mai mare parte cu schimbatori de ioni. In unele cazuri apa bruta are un grad mare de mineralizare se aplica mai intai un tratament: cu var si soda pentru micsorarea duritatii apoi se trece la demineralizarea cu schimbatori de ioni reducandu-se astfel pretul de cost al apei demineralizate. Instalatiile industriale sunt alcatuite din trei, patru perechi de filtre: unele realizeaza demineralizarea, altele se regenereaza, altele se spala. Astfel procesul de demineralizare este continuu.
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 5251
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2026 . All rights reserved