| CATEGORII DOCUMENTE |
| Alimentatie nutritie | Asistenta sociala | Cosmetica frumusete | Logopedie | Retete culinare | Sport |
IMUNITATEA ANTITUMORALA
Circumstantele in care se produce reducerea eficientei apararii imune reprezinta o importanta situatie de risc pentru dezvoltarea unor boli maligne. Astfel de exemple pot fi gasite atat in patologia umana cat si in cea animala: agamaglobulinemia ereditara legata de sex, sindromul Wiskott-Aldrich (boala ereditara legata de sex cu deficienta grava a imunitatii celulare si umorale menifestata prin triada infectii iterative, eczema si trombocitopenie), subiectii imunosupresati terapeutic (de ex. pentru mentinerea unei grefe de organ); soarecii de rasa NZB (New Zealand Black) prezinta o multime de anomalii ereditare ale imunitatii si o mare susceptibilitate la dezvoltarea unor limfoproliferari maligne spontane. Deasemenea aparitia mai frecventa a tumorilor maligne la varstnici poate fi corelata cu instalarea unei imunodeprimari care este caracteristica acestei perioade a vietii. Invers, animalele cu reactivitate imuna normala se poate opune la dezvoltarea unor grefe tumorale singenice. Acest gen de observatii a generat ideea ca celulele tumorale sunt supuse controlului sistemului imun al gazdei, control care se exercita permanent ca un mecanism de 'supraveghere' antitumorala (BURNET, 1967). Conceptul supravegherii imune se sprijina si pe argumente filogenetice: cancerul se dezvolta in aparenta numai la vertebrate, la care apare si se perfecteaza si imunitatea specifica. S-a postulat ipoteza ca dezvoltarea imunitatii ar putea fi expresia necesitatii de a rezista impotriva celulelor maligne.
In 1943, LUDWIK GROSS aduce un puternic argument experimental in favoarea ipotezei controlului imun asupra tumorilor, lucrand pe o susa de soareci singenici la care a indus sarcoame cu ajutorul unei substante iritante (metilcholantren): soarecii la care s-a produs regresia tumorii resping celulele sarcomatoase vii la orice incercare de reinoculare a acestora. Experimentul aminteste incercarile de transplantare cu celulele normale, dar cu diferenta ca in respingerea celulelor sarcomatoase nu pot fi incriminate Atg.CMH (deoarece soarecii sunt singenici) ci alte Atg. induse de transformarea maligna, care se comporta la fel cu Atg. de transplantare. Aceste 'neoantigene' tumorale au fost denumite 'TSTA' (tumor specific-transplantion-antigens). Ulterior s-au identificat pe suprafata celulelor tumorale ale animalelor experimentale si alte tipuri de Atg. O parte din aceste Atg. sunt specifice agentului oncogen utilizat in experimente (Atg. induse de virusuri oncogene sau carcinogene chimice). Alte Atg. care apar pe suprafata unor celule tumorale sunt asa-zisele 'Atg. onco-fetale' (Atg. exprimate in mod normal pe celulele embrionare si fetale, care dispar in viata postnatala, dar care sunt reexprimate dupa malignizarea unor celule).
La om, la care transplantarea sau inducerea experimentala de tumori maligne nu poate fi utilizata, din motive etice nu a putut fi demonstrata existenta antigenelor de tipul TSTA. Celulele maligne umane ar exprima conform mai multor observatii, neoantigene specifice pentru fiecare tip particular de tumora, iar anumite tumori umane exprima si Atg.fetale: Atg. carcinoembrionare Gold (in tumori colorectale si pancreatice), alfa-fetoproteina (in hepatomul primar, seminom), sulfoglicoproteina fetala (in cancerul gastric), fosfataza alcalina feto-placentara (in seminoame si teratoame). Aceste Atg. au antigenicitatea slaba si servesc mai ales ca markeri utili pentru diagnosticul in clinica al respectivelor tumori.
Tumorile pot suscita o reactie complexa de respingere la care iau parte atat Atc. specifici cat si diverse tipuri de celule cu activitate citotoxica (Fig.52, fig. 54)
activarea C';
atasarea celulelor K (mecanismul ADCC);
Anticorpii antitumorali au fost evidentiati la bolnavii purtatori de diferite tipuri de tumori. De regula acesti anticorpi sunt specifici pentru antigenele MHC ale celulelor tumorale. ~n functie de gradul de imunogenitate al celulelor tumorale, productia de anticorpi specifici poate fi masiva sau slaba. Anticorpii de mare afinitate pot `mpiedica reaparitia de noi clone tumorale, cu aceeasi specificitate antigenica.
Anticorpii cu afinitate redusa nu sunt la fel de eficienti `n blocarea antigenelor tumorale. Ei nu pot forma complexe cu antigenele tumorale eliberate, iar aceste complexe Atg-Atc pot constituit factori circulanti blocati, care au capacitatea de a inhiba actiunea celulelor T efectoare. Anticorpii cu afinitate redusa se pot fixa pe celulele tumorale, fara a realiza citoliza dependenta de complement a acestor celule. ~n astfel de cazuri, ei pot totusi contribui la citoliza prin celulele K sau prin macrofage.
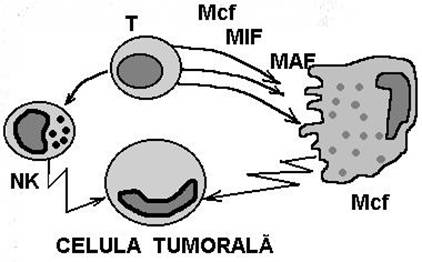
Fig. 52 Mecanisme citotoxice antitumorale nespecifice
Mecanismele de aparare celulara
~n acest proces intervin `n mod deosebit limfocitele Tc, celulele NK si macrofagele. ~ntr-o prima faza, celulele T recunosc ca non-self, celulele tumorale. Aceasta recunoastere se face `n prezenta si cu contributia macrofagelor, care de altfel participa si la reactia inflamatorie tisulara locala.Asemenea procese inflamatorii activeaza macrofagele, care devin capabile sa distruga nespecific celulele tumorale.
Limfocitele Tc sunt considerat ca deosebit de eficiente `n supravegherea imunologica. Uciderea celulelor tinta apartinand grefelor sau tumorilor, este una din cele mai importante functii efectoare ale imunitatii celulare. (Fig. 53)
Celulele Tc sunt derivate din precursorii antigen reactivi, care au proliferat si s-au diferentiat `n timpul raspunsului imun, fata de antigene de transplantare sau tumorale. Dupa al 2-lea contact in vivo sau o expunere la celulele tinta, celulele Tc devin capabile sa ucida celulele care poarta antigenul cu care au fost sesnsibilizate.
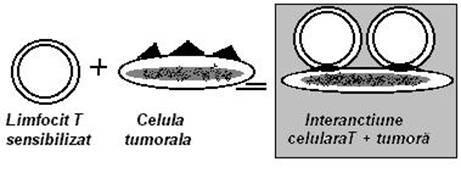
Fig. 53 Liza celulei tumorale prin limfocite T activate ( T citotoxice)
Efectul citotoxcic al celulelor Tc asupra unor celule tinta este specific si necesita un contact intim `ntre efector si tinta avand ca rezultat "injectarea" `n celulele tumorale de substante cu efect citotoxic. Dupa uciderea unei celule tinta, celulele Tc se pot desprinde si pot actiona asupra altor celule tumorale. Dupa modul de actiune se considera ca uciderea tintei se face `n mod direct si nu prin intermediul unor mediatori solubili.
Celulele NK sunt capabile sa lizeze, `n absenta complementului, un mare numar de celule tinta normale si mai ales tumorale. Ele pot sa recunoasca o gama variata de specificitati pe celulele tumorale, avand o activitate citotoxica spontana, fara o sensibilizare prealabila. Prin capacitatea de a fi prezente si active citotoxic, fara o imunizare o prealabila. celulele NK pot fi considerate " a priori" capabile sa recunoasca celulele tumorale foarte timpuriu, `n cursul dezvoltarii acestora si sa-si exercite rolul de "supraveghere" prin calitatea de celule efectoare.
Activitatea celulelor NK este necesara, `n special, pentru a controla aparitia metastazelor hematogene.
Mecanismul lizei celulare ar implica 4 faze distincte:
a. faza de recunoastere a celulei-tinta si formarea de contacte cu aceasta;
b. faza de programare pentru liza, consecutiva legarii;
c. faza de declansare a "loviturii letale" prin formarea unui complex litic;
d. faza de liza a celulei-tinta, independenta de celula efectoare.
Se considera ca celulele NK ar actiona printr-un proces de degranulare, cu eliberarea unor substante cu activitate citolitica rapida si puternica. La aceasta se mai adauga si secretia unor factori solubili citotoxici (NK cytotoxic factors) . Prabusirea activitatii celulelor NK, poate fi cel putin `n parte, raspunzatoare de lipsa unei frane `n dezvoltarea tumorilor.
Macrofagele au o activitate antitumorala demonstrabila, contribuind la producerea necrozei celulare ca si a altor fenomene asociate procesului tumoral. Participarea macrofagelor la fenomenele de rejectie a grefei nu este imunologic specifica, activitatea lor nefiind conditionata de prezenta antigenelor tumorale decat `n prima faza, de initiere a raspunsului imun, atunci cand coopereaza cu limfocitul T pentru recunoasterea celulelor tumorale.
Deoarece in etapa clinica, tumorile maligne umane evolueaza inexorabil, progresand continu si dezvoltand metastaze, trebuie admisa o pierdere a controlului exercitat de supravegherea imunologica indiferent care ar fi substratul celular al acesteia.
Mai multe mecanisme ar putea sa concure la aceasta pierdere a controlului asupra dezvoltarii tumorale:
Ø paralizia imuna a gazdei, indusa de coplesirea aparatului imun de o cantitate enorma de Atg. tumorale;
Ø 'furisarea' (sneaking-through) pe langa supravegherea imuna a unui numar redus de celule tumorale la care, prin conditiile anatomice locale, accesul elementelor imunocompetente este redus;
Ø imunosupresia gazdei prin activarea celulelor T supresoare;
Ø imunodeficienta gazdei;
Ø exprimarea slaba a Atg. tumorale sau 'mascarea lor' cu diverse substante prezente pe suprafata celulei mutante, de ex. sialomucina (glicocalixul) care le protejeaza impotriva atacului imunologic;
Ø 'modularea' Atg. tumorale (internalizarea intracelulara a Atg) sau desprinderea Atg. de pe suprafata celulara care ar 'bloca' Atc. citotoxici departe de celulele-tinta;
Ø 'facilitatea' imunologica : invelirea Atg. tumorale,exprimate pe suprafata celulelor maligne, cu Atc. care le izoleaza de componentele celulare ale aparatului imun;
Ø eliberarea de celule tumorale a unor substante solubile care ar inhiba migrarea Mcf. spre tumora.

Fig. 54 Raspunsul imun antitumoral si actiunea efectorilor umorali si celulari asupra celulei maligne
Descifrarea mecanismelor imunitare, in general si a mecanismelor imunitatii antitumorale deschide in prezent mai multe cai de tratament al bolii canceroase, care utilizeaza anticorpi specifici, citokine sau celule imunologic competente:
a) anticorpi monoclonali (AcMo) specifici antitumorali pot fi folositi in terapeutica sub 3 forme: ca atare; cuplati cu agenti citotoxici sau bispecifici.
Initial s-au utilizat AcMo ca atare, in ideea ca, dupa fixarea lor pe celulele tumorale, pot stimula prin segmentul lor efector (Fc) elemente ale sistemelor distructive ale gazdei (complementul, macrofagele, celulele K). Rezultate incurajatoare au fost obtinute in unele limfoame limfocitare cu celulele B. Acestea sunt proliferari monoclonale de celule limfoide de fenotip asemanator limfocitelor mature. Date fiind aceste caractere, celulele limfomatoase exprima pe suprafata receptori imunoglobulinici cu idiotip unic. Pentru aceste tratamente s-au construit in laborator AcMo anti-idiotipici care se vor fixa selectiv pe celulele maligne mediind prin caile amintite, eliminarea lor. In mielomul multiplu, in care cresterea plasmocitelor mielomatoase este stimulata de IL6, blocarea proliferarii tumorale poate fi obtinuta cu AcMo anti-IL6. Efectele AcMo in tumorile solide au fost mai vagi. Particularitatile vascularizatiei intratumorale, exprimarea slaba a antigenelor asociate tumorii, modularea antigenelor, neutralizarea Atc. in sange de catre Atg. desprinse de pe tumora sunt cauze probabile care explica aceste semi-esecuri.
AcMo cuplati cu dorguri citotoxice sau cu izotopi radioactivi ar servi ca vehicole pentru o terapie tintita. Unele rezultate incurajatoare au fost observate in limfoame. Recent a devenit posibila construirea unor molecule de AcMo hibride, care contin Fab-uri cu specificitati combinatorii diferite: pentru Atg. ale celulei tumorale si pentru markeri ai unei celule citotoxice. Asemenea Atc. bispecifici au fost incercati in tratamentul melanomului metastazat.
O limita majora a tratamentelor cu AcMo este antigenicitatea acestora: fiind produsi de linii celulare murine ei trezesc rapid sinteza de anticorpi neutralizanti la pacientii care urmeaza aceste scheme. In prezent se incearca prin metodele de inginerie genetica crearea unor anticorpi terapeutici mai putin imunogenici prin sudarea unor Fab-uri de provenienta murina cu resturi de Ig umane.
b) Terapia cu citokine
Interferonii prezinta activitate antineoplazica, mediata de unele dintre efectele lor anticelulare (modificarea ciclului celular, interferarea fenotipului oncogenelor) si imunomodularea (modificarea expresiei Atg.CMH, activarea Mcf si a celulelor NK). IFN este activ in leucemia cu tricoleucocite (hairy cell leukemia), leucemia limfatica cronica, limfoame, leucemia granulocitara cronica, mielom multiplu, melanom metastazat, sarcomul Kaposi secundar sindromului de imunodeficienta dobandita (SIDA).
IL2 (singura sau asociata cu IFN gama) este un activator major a trei categorii de celule efectoare (LfT cit., Mcf si celulele NK), cu ajutorul carora este capabila sa stapaneasca proliferarea unor limfoame, neoplasme renale sau colonice sau a melanomului diseminat.
c) Terapia cu celulele imunocompetente
Are ca principiu izolarea unor subseturi purificate de celule, cultivarea lor cu citokine ( de ex. cu IL2) in vederea activarii lor in vitro si reinjectarea lor ulterioara la bolnavul de la care au fost recoltate. In prezent sunt utilizate in acest model elemente denumite conventional LAK (Lymphokine activated killers), provenite din celulele NK, MAK (Macrophages activated killers) derivate din monocite circulante si TIL (Tumour-infiltrating lymphocytes). Primele sunt izolate din sange. TIL se recolteaza din fragmente tumorale rezecate chirurgical. Sunt celule limfoide care infiltreaza tumora. Dupa activarea lor in vitro dobandesc prioprietati citotoxice asupra tumorii. Reinjectate la bolnavii donatori ele migreaza preferential in teritoriile tumorale unde-si desfasoara actiunile lor citotoxice. In plus, ele pot fi transformate prin diverse manipulari, in agenti vectori de substante antineoplazice.
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 2951
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2026 . All rights reserved