| CATEGORII DOCUMENTE |
| Alimentatie nutritie | Asistenta sociala | Cosmetica frumusete | Logopedie | Retete culinare | Sport |
Cancerul
Cancerul reprezinta una din principalele cauze de mortalitate in tarile dezvoltate dar nu numai. Incidenta relativ ridicata precum si cresterea numarului de factori de risc, atribut al civilizatiei, a impus atentia deosebita care este acordata in prezent acestei maladii in cadrul laboratoarelor de cercetare medicala moderne. Cancerul apare in urma unui proces genetic in care o serie de mutatii duc la activarea proto-oncogenelor si/sau pierderea functiei genelor supresoare tumorale (despre care se stie astazi ca impreuna regleaza dezvoltarea si diferentierea celulara) crescind in mod gradat capacitatea celulei de a prolifera autonom. Pina in prezent au fost identificate si caracterizate multe gene implicate in carcinogeneza. Noi dovezi stiintifice indica importanta genei erbB-2/neu in cancerul de sin si un nou tip de tratament bazat pe anticorpi monoclonali" umanizati".
Introducere
Este bine cunoscuta in lume incidenta mare a cancerului de sin, una din 12 femei (in SUA una din 8 femei) avind nesansa de a-l dezvolta. Desi din 1985 incoace cancerul de sin nu mai este primul din cauzele de moarte la femei, fiind inlocuit cu cel de plamin, totusi prevalenta si mortalitatea ramin semnificative. Clinic carcinomul este mai frecvent la glanda mamara stinga, cel mai des in quadrantul supero-extern, peste 80% din cazuri avind punctul de plecare in epiteliul ductal fiind deci adenocarcinoame
Dezvoltarea normala a glandei mamare este reglata prin interactiuni complexe ale unor hormoni si factori de crestere, unii secretati chiar de celulele mamare, avind functii autocrine. Printre acesti hormoni se numara: estrogenii, progesteronul, androgenii, glucocorti-coizii, prolactina, hormonii tiroidieni, insulina si insulin-like growth factor (IGF-I si II), cit si EGF si TGF. Pe de alta parte un rol negativ pe glanda mamara il au inhibitorii dezvoltarii epiteliale cum ar fi TGFa si polipeptida recent descoperita numita mamastatina (Figura 1).
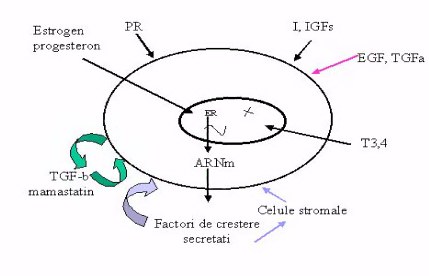 Fig. 1. Modul de interactiune al
diferitilor factori asupra procesului de proliferare celulara
Fig. 1. Modul de interactiune al
diferitilor factori asupra procesului de proliferare celulara
Factorii de crestere si hormonii actioneaza prin legarea de receptori specifici. Receptorii hormonilor polipeptidici sint localizati tipic pe membrana celulara, in timp ce receptorii hormonilor steroizi se afla in interiorul celulei ori in nucleu. Multi din acesti hormoni au un rol activ in formarea epiteliului glandei mamare si in lactatie. Tesutul gladular mamar normal este reglat de acesti hormoni si receptorii lor, deci a fost normal sa se presupuna ca celulele maligne derivate din aceste tesuturi normale ar putea exprima receptori pentru multi din acesti hormoni si sa aiba un anumit grad de dependenta hormonala. In afara factorilor de crestere polipeptidici si receptorii lor, celulele canceroase de sin exprima si citeva oncogene, ca de exemplu gene implicate in procese reglatorii normale care atunci cind se supra-exprima induc un fenotip malign. Produsul oncogenelor poate fi reprezentat de factori de crestere sau receptori ai factorilor de crestere. Oncogenele care se exprima in celule de cancer de sin includ membrii ai familiilor myc, ras, receptori pentru EGF (erbB) cit si receptorul HER-2/neu (erbB-2).
Literatura de specialitate a aratat ca estrogenii, antiestrogenii, progestativele si antipro-gestativele regleaza puternic anumiti factori de crestere ca cei din familiile EGF, TGFa ca si factori de crestere si proteine de legare pentru familia IGF. Receptorul HER2/neu joaca un rol important in stimularea proliferarii celulelor epiteliale dar nu numai, si este activat de hormonul de crestere al epidermei sau EGF (Epidermal Growth Factor). Printre produsii naturali secretati de celule epiteliale ale glandelor mamare, in lapte si colostru, se numara si factorii de crestere, care au roluri deosebit de importante in dezvoltarea nou-nascutului, dar si in cresterea si carcinogeneza glandei mamare. EGF care este cel mai abundent factor de crestere din lapte este un reglator al proliferarii si diferentierii glandei mamare la soareci in vivo. EGF isi mediaza activitatea prin interactiunea cu o familie numeroasa de receptori situati la suprafata celulelor, cunoscuta si sub denumirea de familia erbB, una din multiplele familii de oncogene descoperite si studiate
pina in prezent.
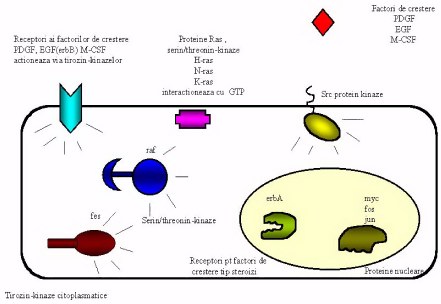
Fig 2. Sumar al
oncogenelor si rolul lor in cresterea si proliferarea celulara. Hormonii de
crestere PDGF (platelet derived growth factor) EGF (epidermal growth factor) si
M-CSF (macrophage-colony stimulating factor) complexeaza receptorii
tirozin-kinaze specifici initiind transmiterea semnalului celular. Mutatii
intervenite in grupele de proteine
S-a dovedit ca intr-o patrime din cazurile de cancere de sin una din oncogenele dominante joaca un rol critic, in sensul existentei unui pronostic prost - mai ales legat de metastazare - si care se coreleaza cu supraexpresia unui anumit receptor proto-oncogenic. Astazi este binecunoscut ca un factor de risc in producerea cancerului de sin la om, activarea oncogenei HER-2/neu. Produsul oncogenei este un membru al superfamiliei de receptori tirozin kinazici (EGFR, IGFR, HER-2/neu) numit si erb-B2 (HER-2/neu) ce se exprima exagerat in aceste cancere de sin realizind o amplificare genica ce duce la transformarea epiteliului uman din sin. Si in alte cancere epiteliale cum ar fi unele forme de cancere de plamin, vezica urinara, ovar, cap si git, receptorii EGFR, IGFR, HER-2/neu se exprima exagerat.
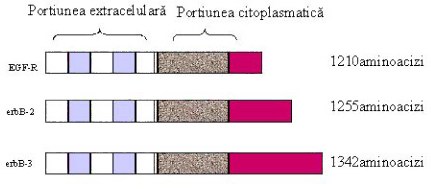 Fig.
3 Receptorii tirozin kinazici
Fig.
3 Receptorii tirozin kinazici
Modificari date de familia receptorilor EGF in cancerele umane:
|
|
EGF R |
erbB-2 |
erbB-3 |
![]()
|
Supra-expresia |
Carcinom cu celule squamoase Adenocarcinom Glioblastom |
Adenocarcinom (sin, stomac, colon, glanda salivara) |
Adenocarcinom (sin) |
![]()
|
Alterari structurale |
Glioblastom Carcinom cu celule squamoase |
Adenocarcinom intestinal |
|
![]()
"Umanizarea" anticorpului monoclonal anti-p185HER2
Oncogena HER2 care codifica pentru o proteina cu rol de tirozin kinaza (p185HER2) a fost descoperita la sfirsitul anilor 80 si amplificarea ei a fost corelata la inceput cu cancere de colon si de sin. Proteina p185HER2 face parte din familia de receptori pentru hormonul de crestere epidermica EGF (Figura 2 si 3). Amplificarea genei HER2 este raspunzatoare pentru 25-30% din cancerele de sin si ovar. Ideea de a folosi un anticorp monoclonal obtinut pe soarece impotriva p185HER2a aparut aproape concomitent cu descoperirea si caracterizarea acestui receptor, dar cercetatorii s-au lovit de declansarea raspunsului imunologic la om provocat de imunoglobulinele specifice ale soarecelui. Din seria de anticorpi produsi in soarece si caracterizati, anticorpul desemnat 4D5 a fost cel mai activ intr-o serie de experimente cheie, cum ar fi inhibitia proliferarii a numeroase linii de celulelor canceroase care supra-produceau p185HER2. In cautarea unei solutii pentru administrarea fara pericol a acestui anticorp la om cercetatorii s-au gindit la transplantarea regiunilor hiper-variabile CDR (complementary determining regions) de la lantul V (variabil) din soarece la o structura a domeniului V uman prin tehnici de recombinare a ADN. Administrind un anticorp cu o secventa in majoritate de imunoglobulina caracteristica umana, raspunsul imunologic este putin probabil sa mai apara. Problema principala ramasa de investigat fiind o activitate similara a anticorpului recombinant cu cea a anticorpului initial produs in soarece. Pentru "umanizarea" anticorpului 4D5 cercetatorii au studiat numeroase modele structurale de complecsi antigen-anticorp si au ajuns la concluzia ca o portiune de aproximativ 10-15 amino acizi (reprezentind CDR) este suficienta pentru a asigura afinitatea anticorpului pentru antigen si neutralizarea antigenului. Structura unui anticorp este reprezentata schematic in Figura 4, iar Figura 5 reprezina o structura determinata prin difractia de raze X a unui complex antigen cu portiunea Fab (V + CH1 light si heavy)a unui anticorp. Anticorpul leaga antigenul cu ajutorul regiunilor hiper-variabile care contin aceste CDR, specifice pentru fiecare tip de antigen.
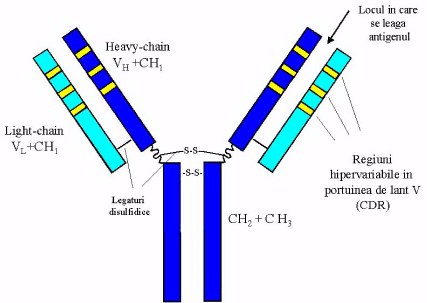 Fig 4. Schema unui anticorp si a
regiunilor hipervariabile care contin CDR. Pentru "umanizarea" anticorpului 4D5
(Herceptin) regiunile hipervariabile din soarece au fost grefate pe scheletul
unei imunoglobuline umane
Fig 4. Schema unui anticorp si a
regiunilor hipervariabile care contin CDR. Pentru "umanizarea" anticorpului 4D5
(Herceptin) regiunile hipervariabile din soarece au fost grefate pe scheletul
unei imunoglobuline umane
Printr-o strategie de mutageneza "gene conversion" ambele lanturi ale anticorpului "light-chain" si "heavy-chain" au fost asamblate si introduse intr-o linie de celule embrionice renale umane 293 (embryonic kidney cell line) prin intermediul unui adenovirus. Celulele 293 au produs anticorpul "umanizat" rhuMAb HER2 in cantitati de 7-15 mg/l de cultura, acesta a fost purificat si testat pentru activitate folosing linia de celule de BT-47 (cancer de sin). Rezultatele au fost extrem de promitatoare in vitro dar si in vivo pe soareci. Testele pe linia de celule SK-OV-3 (cancer ovarian) nu au arata insa o inhibitie a proliferarii la fel de spectaculara. Procentul de inhibitie la tratarea celulelor cu o combinatie rhuMAb HER2 si paclitaxel de a fost in cazul BT-47 de 67%, SK-BR-3 (de sin) de 50% si SK-OV-3 de numai 32%.
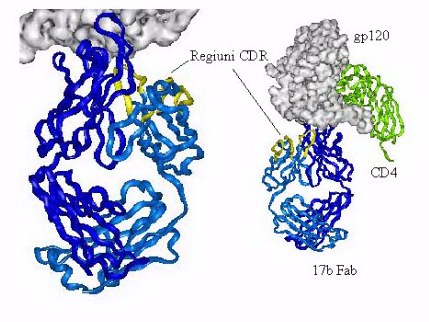 Fig 5. Structura prin difractie de raze X
a complexului proteinei (envelop protein) a HIV gp120 (reprezentare spatiala)
cu anticorpul 17b (lantul heavy chain in albastru inchis si lantul light chain
in albastru deschis, cu regiunile CDR in galben, regiunile CDR au fost
evidentiate numai pentru lantul light chain). In verde este reprezentat
receptorul CD4 al celulei T, raspunzator pentru legarea virusul HIV de membrana
celulara
Fig 5. Structura prin difractie de raze X
a complexului proteinei (envelop protein) a HIV gp120 (reprezentare spatiala)
cu anticorpul 17b (lantul heavy chain in albastru inchis si lantul light chain
in albastru deschis, cu regiunile CDR in galben, regiunile CDR au fost
evidentiate numai pentru lantul light chain). In verde este reprezentat
receptorul CD4 al celulei T, raspunzator pentru legarea virusul HIV de membrana
celulara
Ulterior celulele umane 293 au devenit prima optiune in industrie pentru producerea de anticorpi monoclonali. Mai nou numeroase firme de biotehnologie dau o atentie tot mai mare producerii de anticorpi cu randament crescut, folosind reactoare din ce in ce mai sofisticate si incercind manipularea si modificarea genetica a celulelor pt a le stimula sa produca cit mai mult din proteina de interes. Aceasta activitate febrila desfasurata in ultimii ani ne da o idee despre importanta anticorpilor monoclonali folositi ca agenti terapeutici, se pare ca aceasta tehnica este la inceput de drum si prezinta potential atit medical cit si de succes financiar in biotehnologie.
Herceptin-o noua arma impotriva cancerului
Studii clinice
Un nou agent terapeutic cu totul nou ca conceptie, un anticorp monoclonal "umanizat" s-a aratat foarte promitator in lupta impotriva cancerului. Rezultatele obtinute in 1998 in urma unui studiu clinic cu Herceptin (cunoscut si sub numele de trastuzumab, proprietate a firmei americane Genentech, Inc.) au aratat ca acesta poate imbunatati substantial eficacitatea chimioterapiei impotriva unor cancere de sin avansate mai ales la cele care au metastazat. Firma Genentech nu ne face cunoscuta secventa de aminoacizi a produsului sau aflat in studii clinice dar Herceptin este desemnat in literatura de specialitate si sub numele de 4D5, ceea ce ne da o idee asupra provenientei acestuia.
Primele studii pe scara larga implicind 469 de femei au dus la disparitia tumorilor la 8% dintre cele care au primit o terapie combinata iar pentru alte 41% tumorile au scazut considerabil in volum. De asemenea s-a constatat ca femeile care primesc Herceptin aditional la chemoterapia standard au reactionat mult mai bine decit cele care au mers doar cu chemoterapia clasica. In medie femeile care au primit Herceptin au cistigat 3 luni inainte ca tumorile sa inceapa sa progreseze.
Genentech, Inc. a anuntat in mai, 2000 rezultatele preliminare ale unui studiu clinic faza II in care Herceptin a fost folosit ca agent terapeutic singular la femei care au dezvoltat cancer metastatic de sin HER-2/neu pozitiv si nu au fost tratate in prealabil (cancer cu detectie tirzie). Studiul a aratat ca un procent de 26% din femei, (30 din 114) au raspuns pozitiv la tratament. (date prezentate la al 36-lea meeting anual al Societatii Americane de Oncologie Clinica ASCO). Rata medie de supravietuire a fost de 24.4 luni. In acest studiu femeile au fost impartite in 2 grupe. Un grup a primit numai Herceptin o doza initiala de 4 mg/kg , urmata de de doza de mentinere administrata saptaminal de 2 mg/kg, celalat grup primind o doza dubla initiala 8 mg/kg urmata de 4 mg/kg de mentinere. Parametrii urmariti (rata de raspuns, timpul pina la progresie si supravietuirea) au fost similare in cele doua grupe de studiu. In plus Herceptin a fost bine tolerat de pacienti, ca reactii adverse cele mai frecvente fiind frisoane (25%) astenie (23%) febra (22%) dureri (18%) greturi si varsaturi (14%), in general cu prima administrare.
Relevanta si importanta Herceptin. Cind se poate folosi Herceptin?
Herceptin a fost aprobat in Septembrie 1998 pt a fi folosit la femei care au dezvoltat cancer metastatic de sin care este HER-2/neu pozitiv, adica exprima proteina HER2 in cantitati anormal crescute. Este indicat pentru tratament ca singur agent terapeutic, fie in combinatie cu Taxol (paclitaxel), studiile clinice aratind 14% raspuns ca tratament singular si 42% in combinatie.
Supra-expresia proteinei HER2 de catre celulele canceroase (tumoare HER2/neu pozitiva) este detectata printr-o metoda bazata pe Fluorescence in situ hybridization (FISH), in care se detecteaza in mod indirect amplificarea genei HER2/neu. Deasemenea se poate folosi si o metoda clasica de imunohistochimie (IHC). Ambele metode dau rezultate bune in detectia HER2, FISH insa prezina avantajul unei dozari cantitative.
Conform datelor actuale aproape 1.6 milioane de femei au fost diagnosticate cu cancer de sin in Statele Unite si aproape 180 000 de cazuri noi apar in fiecare an. Dintre acestea firma Genentech apreciaza ca aproximativ 164 000 de femei au cancer de sin metastatic. Dintre acestea 25-30% au tumori HER2/neu pozitive si sunt candidate la terapie folosind Herceptin. Deaceea in paralel, testarea de rutina a femeilor cu cancer de sin pentru HER2/neu este de mare importanta in indentificarea pacientelor care ar putea beneficia in urma terapiei cu Herceptin.
O peptida care mimeaza Herceptin, o alternativa?
Avind in vedere greutatea producerii anticorpilor monoclonali in cantitati suficiente pt a acoperi cererea cercetatorii de la University of Pennsylvania s-au gindit la variante mai mici si mai usor de sintetizat ale anticorpului 4D5 (Herceptin) care sa aibe activitate similara in neutralizarea receptorului p185HER2. Cercetatorii au analizat numeroase modele de complecsi anticorp-antigen si au pornit de la observatia ca in general dintre cele 6 regiuni hipervariabile ale unui anticorp, portiunea CDR3 a lantului greu (heavy chain) este de cele mai multe ori implicata in contactul direct cu antigenul. In cursul mai multor ani de studiu un numar impresionant de peptide cu secventa derivata din regiunea CDR3 au fost sintetizate si testate pentru afinitate pentru receptorul p185HER2. Pentru design rational s-au folosit secvente CDR3 ale anticorpului monoclonal 4D5 dar si secvente analoge dintr-un alt anticorp desemnat 7.16.4 cu actiune neutralizanta asupra receptorului p185HER2. Peptidele cu o afinitate pentru receptorul p185HER2 sub 200 M nu au fost considerate suficient de active si nu au fost explorate in continuare. Ideea de baza a acestor experimente a fost producerea unei peptide cit mai mici si deci usor de produs pe scara larga care sa "mimeze" anticorpul monoclonal Herceptin si deci sa neutralizeze receptorul p185HER2
Analiza a numeroase peptide a aratat ca pentru a poseda activitate inhibitoare a p185HER2 o anume conformatie structurala de tip "agrafa" (hairpin) este necesara. Peptida ciclica cu secventa FCDGFYACYMDV are o afinitate de 300 nM pentru receptorul p185HER2, comparat cu cea a Herceptin care este de 1nM. Aceasta peptida denumita AHNP a fost testata intr-o serie de experimente in vitro, implicind linii de celule SK-BR-3 sau T6-17 care supra-exprima HER2/neu dar si in vivo, in soareci. Experimentele pe celule au aratat ca peptida AHNP produce in mod specific inhibitia proliferarii celulelor care supraexprima p185HER2 pe suprafata lor. Experimentele pe animale au aratat ca in plus AHNP intirzie cresterea tumorilor cind este administrata in amestec cu doxorubicina, dar si cind e administrata unic. Tumorile grefate subcutanat in soareci au continuat sa creasca in cele din urma in toate animalele tratate. Cercetatorii se declara multumiti de rezultatele obtinute si trag concluzia ca au creat un agent care este citostatic, nu citotoxic. Ei pledeaza pentru administrarea de peptide care sa constituie inlocuitori ai anticorpilor monoclonali. Astfel s-ar usura procesul de productie a agentului terapeutic si l-ar face mai ieftin si accesibil scara larga. Din pacate rezultatele aratate pina in prezent nu pledeaza 100% in favoarea folosirii peptidelor pentru a substitui Herceptin insasi.
Terapia cancerului in viitor
Terapia viitorului se va adresa oncogenelor dar si genelor tumor-supresoare. Oncogenele sunt cele se activeaza prin mutatii punctiforme, amplificari si disreglari si duc la promovarea cresterii celulare anormale. Oncogele codifica pentru proteine cu proprietati dominate de transformare in proliferarea celulara si supravietuirea celulelor. Alaturi de oncogene, care au rol predominant in declansarea si progresarea cancerului genele cu rol in supresia tumorilor (tumor supressor gene) contribuie si ele dar in cu totul alt mod. Produsul acestor gene au rol in a bloca diviziunea celulara in urma sesizarii de stricaciuni produse in ADN, de exemplu ca urmare a expunerii la radiatii UV. Mutatii in aceste gene sau chiar pierderea lor (deletion) duc la proliferarea celulara in absenta mecanismului de reparare a ADN-ului, si deci deschid posibilitatea unor multitudini de mutatii. Una din primele gene si proteine care au fost descoperite si au revolutionat intelegerea procesului de aparitie a cancerului a fost p53. Absenta acestei gene in sine nu este suficienta pt a declansa boala dar genereaza o predispozitie catre cancer. Soarecii transgenici care nu au aceasta gena (p53 -/-) dezvolta tumori si mor in citeva luni dupa nastere. Proteina p53 se afla implicata intr-un lant extrem de complex de interactiuni care sunt si acum in curs de descifrare. Insa in acest moment sunt cunoscute si studiate mult mai multe oncogene decit gene tumor-supresoare. Produsele oncogenelor, proteinele, au rol in intregul lant de transmitere al semnalului de proliferare-diviziune (signal transduction) sau apoptotic celular (apoptosis). Sunt reprezentate de toate clasele, de la factori de crestere, receptori, kinaze pina la proteinele nucleare si factori de transcriptie. (Figura 2). Datorita acestei uriase complexitati a proteinelor si interactiunilor lor, implicate in mecanismul celular putem intelege de ce progresul in cercetarea cancerului pare ca evolueaza atit de greu. Totusi zilnic sunt descoperite noi gene si proteine, iar recenta finalizare a secventarii genomului uman, plus dezvoltarea galopanta a tehnicilor de screening si a biotehnologiei promite sa accelereze procesul de trecere de la cauza (oncogena) la medicament. Se pot enumera foarte pe scurt citeva din directiile de terapie moderna aflate in progres:
terapia prin introducerea in organism a "genei normale" pt a compensa gena defecta sau lipsa - "gene therapy" care are la baza chiar utilizarea de retrovirusuri ca agenti purtatori.
terapia prin anticorpi monoclonali "umanizati", care sa inhibe cu mare eficienta actiunea unei proteine produs al unei oncogene.
terapia prin "anti-sense RNA" care are ca efect blocarea transcriptiei genei tinta, deci anularea produsului genei (sau oncogenei).
intensificarea gasirii de noi tinte si noi agenti terapeutici conventionali (medicamente) prin accelerarea procesului de screening folosind tehnici de "high throughput". Alaturi de terapie un rol foarte important il joaca si detectarea cit mai timpurie a aparitiei bolii, in aceasta directie se va accelera descoperirea de referinte biologice specifice - "biomarkers", care pot fi produsi de degradare din urina, din singe, sputa, proteine aflate in anumite tesuturi, etc. Tehnica de spectrometrie de masa va juca un rol cheie in analiza acestor "biomarkers" si firma Ciphergen (Palo Alto, CA) propune pietii americane un aparat care functioneaza cu ajutorul unui chip de dimensiune redusa pe care se ancoreaza proba prin diferite metode (chimic, afinitate, ionic). Chipul este citit intr-un spectrometru de masa si poate analiza pina la 6 probe la o singura citire. Ciphergen studiaza in prezent identificarea unui biomarker pentru cancerul de prostata din urina.
Bibliografie:
Constantin Tasca, Curs de morfopatologie, Edit. ALL, Bucuresti, 1994
Cancer Medicine, 3rd Edition, Edited by Jamas F. Holland, Emil Frei III, Robert C Bast, JR, Donald W Kufe, Donald L. Morton, Ralph R. Werchselbaum, 1993.
Carter, P., Presta, L., Gorman, C. M., Ridgway, J. B., Henner, D., Wong, W.L., Rowland, A. M., Kotts, C., Carver, M. E., Shepard, M.H. (1992) "Humanization of anti- p185HER2 antibody for human cancer therapy" Proc. Natl. Acad Sci. USA 89, 4285-89.
Baselga, J., Norton, L., Albanell, J., Kim, Y. M., Mendelson, J. (1998) "Recombinant humanized anti-Her2 antibody (Herceptin) echances the antitumor activity of paclitaxel and doxorubicin against HER2/neu overexpressing human brest cancer xenografts" Cancer Research 50 1550-58.
Park, B.W., Zhang, H.T., Berezov, A., Zhang, X., Dua, R., Wang, Q., Kao, G., O'Rourke, D. M., Greene, M.I., Murali, R. (2000) "Rationally designed anti-HER2/neu peptide mimetic disables p185HER2 tyrosine kinases in vitro and in vivo" Nature Biotechnology 18 194-98.
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 2727
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2025 . All rights reserved