| CATEGORII DOCUMENTE |
| Alimentatie nutritie | Asistenta sociala | Cosmetica frumusete | Logopedie | Retete culinare | Sport |
Complexul Major de Histocompatibilitate (MHC)
Initial, MHC a fost recunoscut ca o regiune genetica ce controleaza principala bariera in calea transplantului tesuturilor.
Studiul MHC s-a dezvoltat datorita experimentelor de transfer (transplant) a tumorilor.
Conceptul ca respingerea unui tesut strain este rezultatul unui R.I. fata de molecule de suprafata isi are originea in studiile lui Peter Gorer in anii '30. Acesta utiliza linii inbred de soareci in scopul identificarii unor Ag de grup sanguin. In cursul acestor studii, a identificat 4 grupe de gene, desemnate I, II, II, IV care codau Ag de grup sanguin. Ulterior, in anii '40 si '50, Gorer si George Snell au realizat ca Ag-nele codate de genele din grupul II luau parte nu numai la respingerea tumorilor transplantate, dar si a altor tesuturi. Imunitatea anti-tumorala nu era dirijata defapt impotriva unor structuri caracteristice tumorii respective, ci mai degraba se datora unor Ag ale tesuturilor normale prezente si pe suprafata tumorilor.
Snell[1] a denumit aceste gene de "histocompatibilitate", iar numele de H-2 (MHC de soarece) era in legatura cu grupul II identificat de Gorer.
Functia moleculelor MHC este de a lega fragmente peptidice derivate din patogeni si de a le prezenta pe suprafata celulara pentru a fi recunoscute de catre limfocitele T potrivite. Consecintele unei astfel de prezentari sunt dezastruoase pentru patogen: celulele infectate viral sunt ucise, macrofagele sunt activate in asa fel incat sa ucida bacteriile din veziculele intracelulare, limfocitele B sunt activate pentru a produce Ac capabili sa neutralizeze si sa elimine patogeni extracelulari.
Astfel ca exista o foarte puternica presiune selectiva asupra patogenilor, care pot suferi mutatii genetice astfel incat sa scape prezentarii in MHC.
Exista insa 2 proprietati diferite ale MHC care fac ca un astfel de mecanism de scapare sa fie dificil si lipsit de succes pentru patogeni:
Tesuturile transplantate de la un donor neinrudit sunt de obicei distruse de catre SI al primitorului, deoarece celulele donorului aduc cu sine molecule de suprafata care difera de cele prezente la nivelul recipientului.
Compatibilitatea imunologica intre donor si recipient este dictata de aceste molecule de suprafata, unele dintre acestea fiind codate de MHC.
Ag-nele MHC determina o reactie rapida de rejet, in timp ce, mult mai numeroasele mHC (antigene minore de histocmpatibilitate) tind sa stimuleze o reactie mai inceata.
Desi moleculele MHC au fost descoperite in contextul transplantarii si au fost denumite Ag de transplantare, influenta (rolul) lor in rejetul alogrefelor reflecta doar intr-o slaba masura rolul lor (central) in prezentarea Ag-nelor limfocitelor T.
MHC consta din 3 grupuri majore, strans legate, atat in sistemul uman (HLA - human leukocyte antigen) cat si cel murin (H-2): MHC I, II si III.
*Recunoasterea antigenului este MHC-restrictata.
Structura MHC
Pentru a intelege mai bine distributia genelor, denumirea lor si gruparea lor, vom prezenta mai intai structura produsilor codati de aceste gene.
De-a lungul anilor, au fost propuse o serie de modele ipotetice, dar structura cristalografica a primei molecule MHC a fost rezolvata doar in 1987 (Pamela Bjorkman).
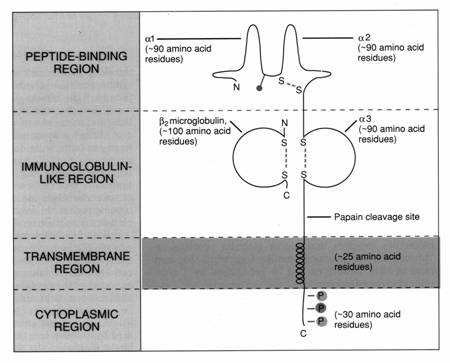
MHC I
glicoproteina
heterodimer
lantul a (lantul "greu") este codat de o gena situata in complexul genic MHC; 46 kDa
este asociat necovalent cu un lant "usor" denumit b microglobulina (b mG); lant scurt, invariabil, 12 kDa, ~100 aa, codat pe CRS 15q21 (in afara complexului genic MHC) si gasit la nivele semnificative si in serul normal; poate fi asociat si altor molecule decat lantul a al MHC I; structura globulara, prezinta legatura S-S intralant (C-like)
lantul a este compus din 3 domenii extracelulare, un domeniu transmembranar (~25 aa) si o regiune intracitoplasmatica (~20 aa), fiecare codata de exoni distincti
domeniul a1 (~ 90 aa pentru fiecare domeniu extracelular) contine un singur glican legat spre capatul N-terminal; nu prezinta leg. S-S intralant
domeniile a2 si a3 sunt stabilizate prin legaturi S-S intralant
exista polimorfism alelic ale HLA-A, B si C[2] localizat aproape in exclusivitate la nivelul domeniilor a1 si a
domeniile a3 si b mG sunt Ig-like
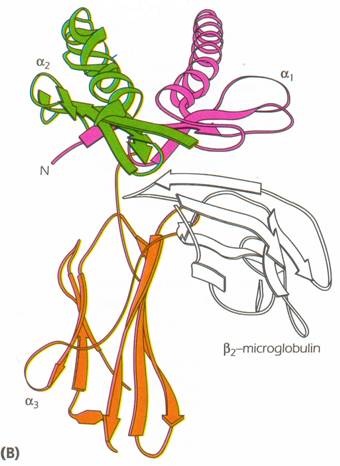
domeniile a1 si a2 au o structura unica; fiecare consta din 4 straturi b pliate anti-paralele care sunt conectate in partea C-terminala cu un a helix arcuit
domeniile a1 si a2 sunt aranjate simetric, conducand la formarea unei platforme alcatuite din 8 foi b pliate si 2 a helix-uri pe margine
acest aranjament conduce la formarea unei cupe destinate legarii peptidului, avand dimensiunea de 25 lungime, 10 latime si 11 inaltime. Punctele de contact dintre cupa MHC si peptid se gasesc atat la nivelul fundului cat si la nivelul marginilor, un rol important jucandu-l "buzunarele" formate
reziduurile de la nivelul marginilor sunt destinate legarii TCR (margine superioara)
in concluzie, reziduurile polimorfice sunt regasite atat la nivelul fundului cat si la nivelul marginlor (partile laterale si superioare)[3]
Ca urmare a organizarii domeniilor a3 si b mG ca domenii globulare, moleculele MHC I fac parte din superfamilia Ig-nelor.
Domeniul a3 pare sa fie inalt conservat intre moleculele MHC I si contine o secventa care interactioneaza cu molecula CD8 prezenta pe suprafata limfocitelor T citotoxice.
b mG interactioneaza in foarte mare masura cu domeniul a3 si interactioneaza de asemenea cu aa ai domeniilor a1 si a2. Interactiunea lantului a cu b mG, dar si cu peptidul din cupa este esentiala pentru plierea corecta a intregii molecule si pentru stabilitatea ei structurala.
Asamblarea (care are loc in RER) incepe prin asocierea lantului a in curs de pliere cu b mG. Acest dimer "gol", metastabil, este apoi stabilizat prin legarea unui peptid potrivit pentru a forma structura trimerica nativa a moleculei. Acest complex este in cele din urma transportat la suprafata celulei.
In absenta b mG-nei, lantul a al MHC I nu este exprimat pe membrana. Acest lucru este ilustrat de celulele Daudi, care sunt incapabile sa sintetizeze b mG, ca si de soarecii b mG KO. Desi mARN-ul este translat in proteina, celulele nu exprima lantul a
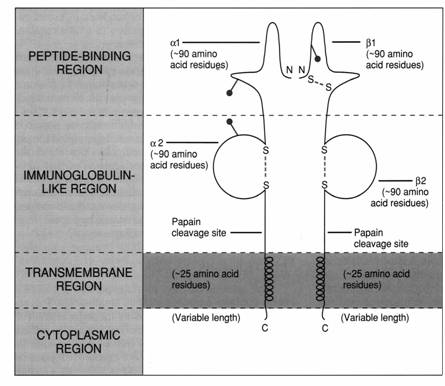
MHC II
glicoproteine
heterodimeri
lant a, 35 kDa
lant b, 27 kDa
lanturile sunt asociate necovalent
ambele lanturi sunt codate de gene situate in regiunea MHC II
fiecare lant este format din cate 2 domenii extracelulare, un domeniu transmembranar si o regiune intracitoplasmatica
lantul b are 2 legaturi S-S intralant; lantul a are doar una
legatura S-S din domeniul b1 al MHC II corespunde cu cea din domeniul a2 al MHC I
glicozilarea domeniului a1 al MHC II corespunde glicozilarii domeniului a1 al MHC I
Bazat pe aceste similaritati (si altele), Brown et al. (1988) a propus un model in care structurile N terminale a1 si b1 ale MHC II sa fie analoge cu a1 si a2 ale MHC I. Aceasta predictie a fost ulterior confirmata prin cristalografie.
Cupa de legare, ca si la MHC I, este alcatuita dintr-o podea formata din 8 foi b pliate anti-paralele, marginita de fiecare parte de a helix-uri.
Un nivel suplimentar de variatie individuala in gama de molecule MHC II de suprafata este creat de variatiile in asocierea lanturilor a si b polimorfice, mai ales la heterozigoti. S-a demonstrat ca asocierea se afla sub control alelic.
O diferenta marcanta intre MHC I si MHC II a aparut prin studiul unui MHC II uman, HLA-DR1. Acesta se prezenta ca un dimer de heterodimeri ab. Dimerul este orientat de asa maniera incat cele 2 cupe de legare sunt orientate in directii opuse. Nu se stie inca exact daca aceasta forma dimerica se manifesta si in vivo sau e doar un artefact.
Distributia tisulara:
MHC I are o distributie larga, dar nu ubicuitara.
Se gaseste pe majoritatea celulelor nucleate, dar si pe plachete.
Nu se gaseste MHC I pe epiteliul corneei (expresie nedectabila), in regiunea exocrina a pancreasului, pe celulele acinare ale parotidei, pe neuronii din SNC, pe celulele trofoblastului vilos, iar pe majoritatea tesuturilor endocrine expresia este foarte scazuta.
MHC II se gaseste in mod constitutiv pe celulele prezentatoare de antigen (APC) profesionale (celule dendritice, limfocite B, macrofage[4]).
Alte celule pot exprima MHC II in conditii fiziologice sau patologice. Celulele epiteliului timic, celulele Langerhans dar si limfocitele T umane activate cu Ag sau mitogeni exprima MHC II in mod normal.
Pe alte celule insa, expresia MHC II poate fi indusa: celulele epiteliale din intestin, trahee, limba, amigdale, epiglota, tubuli renali proximali, uretra, epididim, celulele placentare, endoteliu vascular, fibroblasti dermici, keratinocite, melanocite, astrocite, celule Schwann, celule sinoviale, celule epiteliale tiroidiene (asa cum se intampla in tiroidita Hashimoto), celulele pancreatice b (diabet zaharat).
Harta genica
Complexul MHC se gaseste pe CRS 6[5] si se intinde pe 2-3 centimorgani (aprox. 4 x 106 baze azotate) si contine (la om) peste 300 de gene.
Genele de clasa I ocupa ~ 1 600 kb catre telomer, genele de clasa II ocupa ~ 900 kb catre centromer si flancheaza genele MHC III, care ocupa ~1 000 kb. Regiunea MHC este astfel regiunea cea mai dens populata din intregul genom uman. Atat genele MHC I cat si MHC II sunt flancate de promotori (secvente intronice situate catre capatul 5') la care se leaga factori de transcriptie actionand la nivelul unei anumite particulare secvente. Motivele prezente la nivelul promoterilor ca si a factorilor transcriptionali au inceput sa fie identificate. Reglarea transcriptionala a MHC este mediata atat de elemente negative cat si pozitive.
De ex., factorul denumit C II TA (class II transactivator) si factorul de transcriptie RFX se leaga (ambii) la promotor-ul MHC II. Defecte ale acestor factori conduc la "bare lymphocyte syndrome" (sindromul limfocitelor "goale"); pacientii cu aceasta anomalie nu prezinta MHC II pe suprafata celulelor lor, ca atare nu pot prezenta antigenul limfocitelor T helper, acestea nu se pot activa si astfel apare o imunodeficienta foarte severa.
Expresia moleculelor MHC este de asemenea reglata de diverse citokine. Interferonii (a b g) si TNF cresc expresia de MHC I.
IFN g pare sa induca formarea unor factori specifici de transcriptie care se leaga la promoter-ul MHC I. Legarea acestui factor transcriptional la secventa specifica din promoter pare sa coordoneze stimularea transcriptiei genelor care codeaza pentru lantul a b mG, subunitatile proteasomului (LMP) si subunitatile TAP.
S-a aratat de asemenea ca IFNg induce expresia C II TA, crescand astfel in mod indirect expresia de molecule MHC II pe o varietate de celule (inclusiv celule non-APC).
Alte citokine influenteaza expresia MHC doar la nivelul unor particulare tipuri celulare. Astfel, IL-4 creste expresia de HLA II pe limfocitele B in repaus (resting), in schimb, IFNg scade expresia HLA II pe limfocitele B. Corticoizii si prostaglandinele scad de asemenea expresia HLA II.
Expresia MHC este scazuta consecutiv anumitor infectii virale, inclusiv cu citomegalovirus uman (CMV), virusul hepatitei B (HBV), adenovirusul 12 (Ad 12). In unele cazuri, reducerea expresiei MHC I se datoreaza afectarii expresiei unui component necesar pentru transportul peptidului sau asamblarii MHC I si nu diminuarii transcriptiei. In infectia cu CMV, o proteina virala se leaga la b mG, prevenind asamblarea MHC I si transportul catre membrana. Ad12 produce o scadere a transcriptiei genelor TAP-1 si 2, produsii acestor gene jucand un rol esential in transportul peptidului si, ca urmare, molecula nu se poate asambla.
Scaderea expresiei moleculelor MHC I, prin oricare mecanism, este de natura sa permita virusurilor sa evite RI. Complexele MHC I - peptid viral nu se mai formeaza si celulele infectate nu vor mai constitui tinte pentru atacul limfocitelor T citotoxice (CML)[6].
Genele MHC I
Diferitele gene HLA I sunt notate cu sufixul HLA-A, B, C, acestea codand pentru moleculele de MHC numite clasice. In afara de acestea, exista o multime de gene codand pentru MHC I non-clasice, identificate prin cartare genetica, prezente atat la om cat si la soarece. La om, ele sunt denumite HLA-E, F, G, H, J si X, la care se adauga o familie recent descoperita, numita MIC. Unele dintre acestea sunt pseudogene si nu codeaza pentru un produs proteic, dar altele codeaza pentru produsi cu functii inalt specializate.
Anumiti produsi MHC I non-clasici (E, F, G) sunt denumiti molecule Ib. Ca si moleculele clasice, moleculele Ib sunt alcatuite dintr-un lant a si b mG, dar sunt mult mai putin polimorfice si exprimate la un nivel mult mai scazut. Moleculele Ib prezinta o identitate de structura de pana la 70% cu moleculele clasice. Spre deosebire de acestea, familia MIC prezinta doar 15-30% identitate structurala cu MHC clasice, in schimb este inalt polimorfica. Produsii genelor MIC sunt exprimati la nivele scazute pe celulele epiteliale si sunt indusi de caldura sau de alti stimuli care influenteaza proteinele de soc termic (hsp - heat shock protein). Nu se cunoaste inca daca moleculele MIC au rol in prezentarea vreunui peptid.
Genele MHC II
Regiunea MHC II contine gene care codeaza atat pentru lanturile a cat si b ale MHC clasice, denumite la om HLA-DP, DQ si DR. Cartarea a revelat mai multe lanturi pentru lantul b in unele regiuni, atat la soarece cat si la om, ca si multiple gene a. In regiunea DR de ex., exista 3 sau 4 gene b functionale. Toti produsii genelor b pot fi exprimati impreuna cu produsul genei a intr-o anumita celula, crescand ca urmare numarul de molecule prezentatoare de pe celula respectiva. Daca regiunea DR contine doar o gena a, regiunile DP si DQ contin in schimb cate 2 gene a functionale.
Au fost identificate (atat la om cat si la soarece) gene MHC II care codeaza pentru molecule non-clasice. Aceste molecule joaca in general un rol de reglatori pentru moleculele clasice (DN, DO, DM).
Tot in regiunea MHC II a fost evidentiata prezenta a 2 gene, LMP2 si LMP7 care codeaza pentru subunitati ale proteasomului si 2 gene TAP si TAP2 care codeaza pentru subunitati ale transportorului de peptide din citosol in RER.
Genele MHC III
Genele din regiunea MHC III constau dintr-o colectie foarte heterogena. Aici se gasesc gene care codeaza pentru compusi ai complementului, steroid 21-hidroxilaze, proteine de soc termic, citokine (TNFa si TNF b). Unele dintre aceste gene joaca un rol in patologie. De ex. mutatiile genelor pentru hidroxilaze au fost puse in legatura cu hiperplazia suprarenala congenitala.
Polimorfismul moleculelor MHC I si II
Se manifesta o enorma diversitate a moleculelor MHC intre specii, dupa cum exista o foarte mare diversitate intre membrii unei specii. Sursa diversitatii moleculelor MHC este diferita de cea a moleculelor de Ig sau TCR. Acestea din urma sunt generate printr-un proces continuu de rearanjari genice si alte mecanisme (diversitate jonctionala, mutatii somatice etc.). Astfel, procesul este dinamic si conduce la modificari pe parcursul timpului intr-un individ.
Prin contrast, moleculele MHC exprimate de un individ nu se schimba pe parcursul vietii. Moleculele MHC apartinand unui anumit individ difera insa (adesea in mod semnificativ) de cele exprimate de un alt individ al speciei respective. Diversitatea MHC din cadrul unei specii deriva din polimorfism, adica prezenta a multiple alele candidate pentru un anumit locus. La aceasta se adauga diversitatea data de faptul ca intr-un individ genele sunt duplicate, avand functii similare sau care se suprapun. MHC-ul poseda un numar remarcabil de alele diferite, pentru aproape fiecare locus si este astfel probabil cel mai polimorfic complex genic cunoscut la vertebrate.
Analiza moleculelor HLA I a revelat pana in prezent (analiza care se bazeaza doar pe populatia caucaziana): 86 de alele pentru HLA-A, 185 de alele pentru HLA-B si 45 de alele pentru HLA-C.
La soareci, polimorfismul este la fel de semnificativ.
Moleculele MHC II umane sunt de asemenea inalt polimorfice. In total, au fost raportate 122 de alele pentru lanturile DRb (DRa are doar 2 alele, diferenta dintre ele fiind de un singur aa). In plus, exista mai multe gene DRb (9), iar un anumit individ poate avea un numar variabil (intre 2 si 5).
Frecventa acestor alele difera in functie de grupul etnic si localizarea geografica a populatiei. Estimarile actuale ale polimorfismului sunt, cu siguranta, la limita inferioara si, odata cu posibilitatea secventializarii genelor MHC, vor fi descrise si alte alele. Simplu fapt ca o serie de populatii ne-caucaziene nu pot fi caracterizate cu ajutorul Ac-ilor pe care ii avem la dispozitie ne demonstreaza acest lucru.
Date fiind elementele descrise, se avanseaza o cifra de aproximativ 1012 pentru diversitatea teoretica posibila[7]. Diversitatea observata este mai mica insa decat cea teoretica. Faptul ca nu se manifesta chiar o distributie intamplatoare si ca anumite combinatii de alele apar mai frecvent decat ar prezice calculul probabilitatilor a condus la notiunea de "dezechilibru de inlantuire" (linkage disequilibrium) . Motivele pentru aparitia acestui fenomen nu sunt intelese pe deplin. Cel mai simplu ar fi acela ca nu a trecut suficient timp si nu s-au incrucisat un numar suficient de generatii pentru a se atinge un echilibru intre alelele prezente la nivelul populatiei respective. Haplotipurile care sunt supra-reprezentate in populatie reprezinta cu siguranta si rezultatul urmatorilor factori:
In ciuda dezechilibrului de inlantuire, exista un polimorfism enorm la nivelul MHC-ului uman si este foarte dificil sa "potrivim" un donor cu un acceptor.
Desi nu este deloc usor de analizat in laborator un astfel de fenomen, este clar ca sunt implicate mai multe mecanisme genetice: mutatii punctiforme, conversii genice - prin care o secventa este inlocuita, in parte, de o alta provenind de la o gena homologa, crossing-over homolog dar inegal, etc.
Toate genele MHC, indiferent de varianta alelica, sunt dominante, iar exprimarea lor este codominanta, deci ambele gene alele de pe cromosomii omologi se exprima pe suprafata celulelor. Desi acest tip de exprimare este cel normal, este important de subliniat ca exprimarea simultana a alelelor prezente pe cromosomii omologi reprezinta o importanta diferenta fata de excluzia alelica ce apare in cazul genelor Ig si ale TCR. Mai mult decat atat, unele celule (cum ar fi limfocitele de exemplu) incearca sa exprime cat mai multe tipuri de molecule MHC, astfel ca, per ansamblul organismului, avem de a face cu un set complet de molecule, expresie a tuturor genelor din Complexul Major de Histocompatibilitate.
O alta proprietate a genelor ce alcatuiesc sistemul HLA este inlantuirea stransa si transmiterea in bloc de la parinti la copii a genelor alele ce formeaza pe fiecare cromosom 6 un anumit haplotip. Notand haplotipurile parentale, corespunzatoare celor doi cromosomi 6 omologi cu ab si cd la copii sunt posibile urmatoarele combinatii genotipice (fiecare parinte transmite, prin gameti, unul din cele doua haplotipuri): ac, ad, bc si bd- fiecare cu o probabilitate de 25%. De aici rezulta ca fiecare dintre copii va fi semidentic cu fiecare dintre parinti iar in fratrie exista probabilitatea teoretica ca fratii si surorile sa fie: semidentici (50%), identici (25%), diferiti (25%).
MHC si susceptibilitatea la boala
Exista o serie intreaga de afectiuni care au fost asociate cu anumite particulare alele. Printre ele se gasesc afectiuni autoimune, infectii virale, defecte ale sistemului complement, afectiuni neurologice.
Prin compararea frecventei alelei respective la pacienti cu anumita boala cu frecventa alelei in populatia general se poate calcula "riscul relativ".
HLA-DR4 aduce un risc relativ de 10 x mai mare ca persoana respectiva sa dezvolte artrita reumatoida. Exista o asociere foarte puternica intre HLA-B27 si spondilita anchilozanta (risc relativ de 90 x mai mare).
Totusi, existenta unei astfel de asociatii nu trebuie interpretata strict in sensul ca prezenta unei anumite particulare alele MHC a produs boala. Relatia intre o alela MHC si o particulara boala este mult mai complexa. S-a sugerat astfel ca datorita apropierii dintre genele TNFa si TNFb cu locusul HLA-B, aceste citokine ar putea fi implicate in distrugerea cartilajului.
Atunci cand riscul relativ este scazut, este probabil ca multiple gene, dintre care doar una este MHC, sa influenteze susceptibilitatea fata de boala respectiva. Bolile nu sunt "mostenite" intr-o maniera mendeliana. Gemenii monozigoti sunt un bun exemplu, ei mostenesc acelasi factor de risc MHC, dar, in unele cazuri, doar unul dintre ei dezvolta boala. Aceasta sugereaza ca e nevoie de factori genetici si de mediu multipli, mai ales in ceea ce priveste autoimunitatile. Dat fiind dezechilibrul de inlantuire, interpretarea trebuie sa fie precauta. Daca tinem cont ca gena DR4 este asociata frecvent cu gena A3, atunci concluzia ar fi ca nu numai DR4 este asociata cu artrita reumatoida, dar si A3.
Au fost emise o serie de ipoteze care explice rolul MHC in susceptibilitatea fata de o boala.
Astfel, susceptibilitatea fata de un patogen reflecta rolul unor particulare alele in responsivitatea sau non-responsivitatea fata de acel particular patogen. Apar diferente in prezentarea antigenului, care determina eficienta RI.
Daca epitopii imunodominanti ai unui patogen mimeaza anumite molecule MHC este posibil ca organismul respectiv sa nu raspunda, pentru ca nu poseda limfocitele T specifice.
Unele forme alelice ale moleculelor MHC pot servi drept tinte pentru atacul viral sau toxine bacteriene.
*Reducerea polimorfismului MHC in cadrul unei specii poate predispune specia respectiva la afectiuni infectioase. Astfel, jaguarii sunt suceptibili la infectii virale, dat fiind faptul ca se inmultesc in cadrul unui grup relativ restrans si, ca urmare, diversitatea e din ce in ce mai restransa.

Studiul HLA-A2, Aw68 si B27 a demonstrat diferente in forma santului de legare, a conformatiei buzunarelor si a spatiilor de pe podea care sunt formate de reziduuri polimorfice. In HLA-B27, exista o cisteina in pozitia 67, langa intrarea in buzunarul 45. Accesul la buzunar poate fi blocat de aa cu lanturi laterale mari, prin intermediul unei legaturi S-S cu cys67, afectand drastic forma lui B27.
Exista diferente de expresie nu numai in functie de tipul celular ci si in functie de stadiul de dezvoltare al celulei sau gradul de activare. Astfel, pe monocite si macrofage, nivelul MHC II este scazut pana la contactul cu Ag-nul.
Aceasta situatie nu va afecta insa celulele NK, actiunea acestora nu depinde de prezentarea peptidului viral in MHC I.
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 5329
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2026 . All rights reserved