| CATEGORII DOCUMENTE |
| Alimentatie nutritie | Asistenta sociala | Cosmetica frumusete | Logopedie | Retete culinare | Sport |
Modularea expresiei chemokinelor MCP-1 si fractalkina in celulele musculare netede (CMN) umane activate de glucoza crescuta
1. Glucoza crescuta induce expresia MCP-1 si fractalkinei in CMN. Rolul functional al acestor chemokine. Efecul fenofibratului si clofibratului.
a. INTRODUCERE SI OBIECTIVE
Anormalitati ale cresterii, proliferarii, migrarii si hipertrofia celulelor musculare netede (CMN) vasculare sunt implicate direct in dezvoltarea complicatiilor vasculare care apar in diabet. Multi factori contribuie la acelerarea bolilor la pacientii diabetici. Dincolo de secretia diminuata a insulinei si rezistenta la insulina, in ultima vreme, inflamatia atrage din ce in ce mai multa atentie ca contributor la complicatiile diabetului.
Anterior, am amintit ca MCP-1 este o chemokina pro-inflamatoare cu rol important in atragerea monocitelor din fluxul de sange la locurile activate sau lezate ale endoteliului. Recrutarea, activarea si expansiunea ulterioara a monocitelor/macrofagelor in peretele vasului arterial duc la formarea celulelor spumoase. In procesul inflamator, celulele spumoase elibereaza enzime hidrolitice, citokine, chemokine, factori de crestere care amplifica procesul inflamator. Toate aceste evenimente, alaturi de proliferarea CMN intimale, duc la stenoza sau la ocluzia completa a vaselor. CMN au receptor de MCP-1, prezenta lui pe aceste celule explicand rolul pe care il are MCP-1 in procesul de migrare al CMN din medie si adventicie in intima. Modelele murine de ateroscleroza au demonstrat rolul central al MCP-1/CCR2 in recrutatrea monocitelor si formarea leziunii. In contextual hiperlipidemiei, a fost descrisa cersterea expresiei MCP-1 in CMN [Xu et al., 1992] si a CCR2 de pe monocite [Han et al., 1998], ceea ce justifica numarul crescut de monocite recrutate in peretele vascular [Taubmann et al., 1992; Namiki et al., 2002]. In acest context, este interesant sa urmarim modularea expresiei MCP-1 in CMN de catre glucoza crescuta.
Fractalkina, o chemokina descoperita recent, diferita structural de celelalte chemokine fiind legata la un lant mucinic transmembranar, reprezinta un alt candidat important in recrutarea leucocitelor in aterogeneza. Proteina transmembranara functioneaza ca o molecula de adeziune eficienta, care in conditii de flux, captureaza monocite si celule T la endoteliul activat printr-un mechanism independent de integrine [Fong et al., 1998; Zernecke et al., 2001]. Taierea lantului mucinic de catre metaloproteaze specifice, ca ADAM17 produc forma solubila a fractalkinei cu proprietati chemoatractante pentru monocite si celule T [Tsou et al., 2001; Garton et al., 2001]. Modurile diferite de functionare a fractalkinei depind de forma de prezentare si de localizarea intralezionala a acesteia. Cand este exprimata de CMN, fractalkina poate fi usor taiata de metaloproteaze si transformata in forma solubila, ajutand la infiltrarea macrofagelor [Lesnik et al., 2003]. In contrast, fractalkina transmembranara de la suprafata endoteliala este greu accesibila metaloproteazelor, fiind astfel predestinata sa medieze adeziunea monocitelor. Fractalkina se leaga la receptorul ei specific, CX3CR1, un receptor cuplat cu proteina G, sensibil la toxina pertusis.
In CMN fractalkina este indusa de citokine proinflamatoare (TNF-a si INFg) si poate media adeziunea monocitelor la CMN. Nivele crescute ale expresiei genice a fractalkinei au fost observate in unele artere umane cu leziuni aterosclerotice avansate [Greaves et al., 2001]. De asemenea, fractalkina a fost gasita in intima vaselor de la pacientii diabetici [Wong et al.,2002].
Recent s-a demonstrat ca TNF-a activeaza factorul de transcriptie kB (NF-kB) si induce expresia fractalkinei si a receptorului CX3CR1 intr-o maniera dependenta de timp in CMN aortice de sobolan [Chandrasekar et al., 2003]. Mai important, acest grup a aratat ca fractalkina creste adeziunea celula-celula si proliferarea CMN aortice, indicand rolul acesteia (ca si al MCP-1) in initierea si progresia bolii. Data fiind redundanta expresiei si functiei chemokinelor in leziunile aterosclerotice nu este usor de imaginat de ce deletia unei chemokine individuale sau a receptorului acesteia duce la o reducere semnificativa a formarii leziunii. Asta poate arata ca MCP-1 si fractalkina nu actioneaza independent, si mai degraba impreuna, recrutand monocitele circulante in leziuni, si de asemenea poate insinua existenta unei specializari functionale a chemokinelor si a receptorilor lor in diferitii pasi ai recrutarii aterogenice, atribuindu-le roluri non-redundante.
In acest context, in prima parte a acestui studiu am urmarit modularea expresiei fractalkinei si MCP-1de catre glucoza crescuta si rolul functional al expresiei acestor molecule in CMN aortice umane. De asemenea am urmarit efectul activatorilor de PPARa asupra expresiei celor doua chemokine in CMN activate de glucoza crescuta.
b. MATERIALE SI METODE
Linia de celule musculare netede aortice umane obtinuta la noi in Institut, care au fost crescute in DMEM cu 10% ser fetal de vitel si 5% admosfera CO2. Celulele au fost folosite la pasajele 7, 8, 9 si 10.
Protocolul experimental
Celulele musculare netede crescute in conditii normale de glucoza au fost impartite, la confluenta, in celule control (crescute inca 24 ore in 5mM glucoza) si celule activate (GC, crescute inca 24 ore in conditii de glucoza crescuta, 33mM). Pentru realizarea unui gradient de concentratie, celulele confluente (crescute in conditii normale) au fost incubate ultimele 24 ore cu concentratii crescatoare de glucoza, de la 5mM la 33mM. In cazul experimentelor care au urmarit efectele medicamentelor fenofibrat si clofibrat, celulele au fost incubate timp de 24 ore in 33mM glucoza in prezenta sa absenta de medicamente.
Determinarea expresiei genice prin RT-PCR.
Metoda RT-PCR pentru determinarea expresiei genice a MCP-1 a fost descrisa mai sus, in acest capitol. Pentru a determina expresia genice a fractalkinei s-a folosit acelasi protocol ca pentru MCP-1. Primerii folosititi au fost, pentru MCP-1 sens 5′-GAC GAATGC CAA GAT CTG AGA AG si antisens 5′-CGT CTC TTT GTA GTG CTG TCA GC si pentru fractalkina, sens 5'-AACTCGAAATGGCGGCACCTT-3' si antisens 5'-ATGAATTACTACCACAGCTCCG-3' iar temteratura de annealing folosita, 69 C. Nivelele de ARNm ale MCP-1 si fractalkinei au fost normalizate relativ la nivelele ARNm GAPDH, iar rezultatele obtinute de la trei experimente independente au fost analizate statistic.
Determinarea expresiei proteice prin Western Blot
Expresia proteica a MCP-1 si fractalkinei a fost determinate din lizat cellular total. Proteina obtinuta a fost separate in gel de poliacrilamida (20% respectiv 10%) iar experimentele de Western Blot au fost facute asa cum am descris la capitolul 3.1, folosind anticorpi monoclonali, specifici pentru MCP-1 si fractalkina.
Adeziunea monocitelor la CMN in conditii statice
Pentru studiile de adeziune in conditii statice CMN au fost cultivate in placi de 24 godeuri. La confluenta, celulele au fost activate cu glucoza crescuta in prezenta sau absenta de medicamente (asa cum am descris la Protocolul experimental) timp de 24 ore. Apoi celulele au fost spalate cu mediu cald fara ser si incubate cu monocite (500 000/ml) marcate fluorescent cu cromoforul 2',7'-bis-(2-carboxyethyl)-5,6-carboxyfluprescein, acetomethyl ester (BCECF-AM). Monocitele au fost marcate imediat inainte de adaugarea lor peste monostratul de celule musculare netede prin incubarea cu BCECF-AM in concentratie de 10ng/ml, timp de 30 minute. BCECF-AM nu are efecte citotoxice pentru celule, fiind de asemenea folosit ca un indicator al viabilitatii celulare. Au urmat doua spalari in mediu RPMI cald si apoi incubarea cu CMN pentru 30 minute. Dupa 30 minute, monocitele neaderate au fost indepartate, iar cele aderate au fost lizate cu 0.5 N NaOH cu 0.1% SDS. Fluorescenta a fost determinata cu ajutorul unui cititor de microplaci (GENios, Tecan) la lunginea de unda de excitatie 485nm, si emisie 535nm.
Adeziunea monocitelor la CMN in flux laminar.
Testele de adeziune in flux laminar au fost realizate conform metodei descrise anterior [Kukreti et al., 1997; Weber er al., 1996; Piali et al., 1998]. Celulele musculare netede au fost crescute pana la confluenta in placi de cultura de 35mm care au fost asamblate in peretele camerei de flux, si montate in campul unui microscop inversat Olympus IMT-2 (Olympus Optical, Hamburg, Germany) cu obiective de contrast de faza 203 si 403. Monocitele (500 000/ml) in solutie salina Hanks continand 10 mmol/L HEPES, pH 7.4, 0.5% albumina umana, si 1 mmol/L Mg2+, 1 mmol/L Ca2+ (adaugate imediat inainte de pornirea experimentului) au fost tinute in baie termostatata la 37C si au fost perfuzate in camera de flux la o rata de 1.5dyn/cm2 timp de 5 minute. Numarul monocitelor aderate ferm dupa 5 minute a fost cuantificat in mai multe campuri (cel putin 5 per experiment), prin analizarea imaginilor inregistrate cu o camera video (JVC 3CCD) integrata sistemului si un video recorder JVC SR L 900 E si exprimate ca numar de celule per milimetru patrat.
Chemotaxie
Mediul de cultura conditionat al CMN aflate in diferite conditii experimentale, a fost recoltat si adaugat in compartimentele de jos ale camerelor duble cu filtru policarbonat cu pori de dimetru 5mm. In compartimentul de sus au fost adaugate 100 000 monocite marcate cu BCECF-AM (ca in experimentele de adeziune) si a urmat incubarea placilor la 37 C, timp de 90 minute in admosfera cu 5%CO2. A urmat dezasamblarea camerei si colectarea mediului de cultura din compartimentul de jos, unde au migrat monocitele marcate. Monocitele migrate au fost cuantificate prin masurarea la stectofluorimetru TECAN la lungimea de unda de excitatie 485 nm si emisie 535 nm. Pentru controlul pozitiv, in compartimentul de jos al camerei am pus mediu de cultura proaspat in care s-a adaugat peptidul chemoatractant fMLP (10nM).
c. REZULTATE
Expresiile genice ale MCP-1si fractalkinei induse de concentratii crescatoare de glucoza
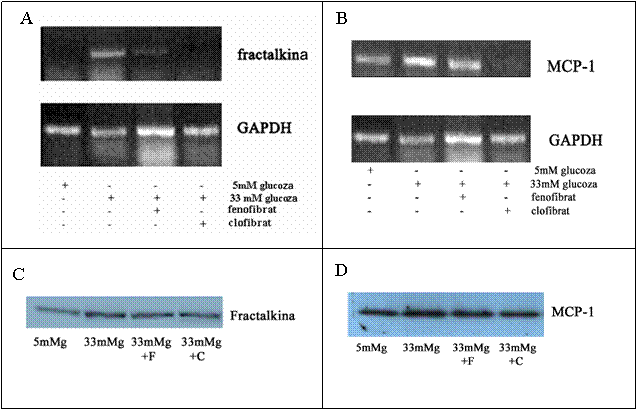
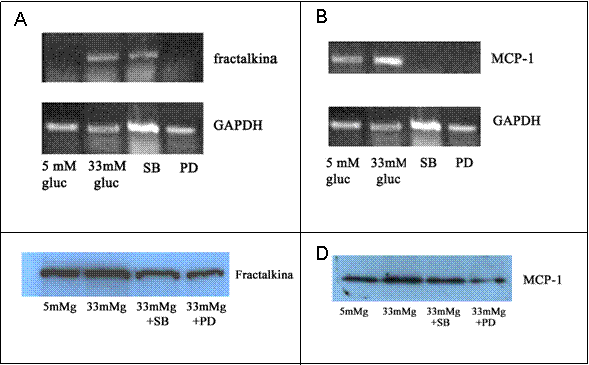
In cazul celulelor endoteliale concentratia crescuta de glucoza a indus expresia genica si proteica a MCP-1. Similar, in cazul CMN activate de glucoza crescuta, expresiile genice ale ambelor chemokine studiate, MCP-1 si fractalkina sunt crescute (figura 1). Dupa cum observam, in celulele expuse concentratiei normale de glucoza, MCP-1 este exprimata la nivel foarte scazut, iar fractalkina nu este exprimata. Expresia genica a MCP-1 este crescuta proportional cu cresterea concentratiei de glucoza, fiind maxima la 33mM glucoza. In cazul fractalkinei, desi obtinem crestere de expresie la 25mM, o crestere semnificativa se observa doar la 33mM glucoza.
Figura 1. Expresia genica a MCP-1 si fractalkinei in celule musculare netede umane activate cu concentratii crescatoare de glucoza


2) Efectul fenofibratului si clofibratului asupra expresiei fractalkinei si MCP-1
In continuare am folosit concentratia de glucoza la care am obtinut efect maxim (33mM). Celulele activate de glucoza au fost tratate cu activatorii de PPARa clofibrat si fenofibrat in concentratie de 100mM. Dupa 24 ore, celulele control, acivate si cele tratate cu fenofibrat si clofibrat au fost supuse tehnicilor de RT-PCR si Western blot. Astfel, am obtinut ca fenofibratul si clofibratul reduc semnificativ expresia genica a fractalkinei si a MCP-1 (figura 2, A si B) in celulele musculare netede activate cu glucoza crescuta. Rezultatete obtinute la nivel de expresie genica au fost confirmate de cele obtinute la nivel de expresie proteica. Astfel, expresia proteica a fractakinei si MCP-1 in omogenat celular total au fost reduse de fenofibart si clofibrat (figura 2, C si D).
Figura 2. Efectul activatorilor de PPARa asupra expresiei genice si proteice a chemokinelor MCP-1 si fractalkina
Adeziunea monocitelor la CMN activate de glucoza crescuta; chemotaxia monocitelor indusa de chemokinele eliberate in mediul de cultura de CMN expuse la glucoza
Anterior s-a amintit ca procesul de adeziune al monocitelor la CMN a avut loc in conditii de staza numai cand celulele au fost stimulate cu citokine sau lipoproteine [Ludwig et al., 2002]. Nu sunt date in literatura de specialitate cu privire la adeziunea monocitelor la CMN activate de glucoza si despre moleculele implicate in acest proces, in aceste conditii. Dat fiind ca nivelele expresiei celor doua chemokine sunt deosebit de importante, am urmarit in continuare modul in care cresterea expresiei acestor chemokine de catre glucoza crescuta este reflectat la nivel functional. Si cum proprietatea principala a acestor chemokine este de a participa la atragerea si adeziunea monocitelor, am urmarit efectul glucozei atat asupra adeziunii monocitelor la CMN activate de glucoza, dar si asupra procesului de chemotaxie a monocitelor.
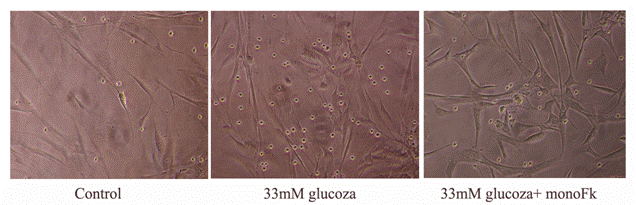
In cazul experimentelor de adeziune in conditii statice, numarul monocitelor aderate la CMN activate de glucoza este mai mare decat al monocitelor aderate la celulele control (figura 3, A). Fenofibratul si clofibratul reduc numarul monocitelor aderate datorita glucozei crescute, insa diferenta semnificativa am obtinut numai in cazul fenofibratului (figura 3, B).
Figura 3. Adeziunea monocitelor la CMN in conditii statice. A) imagini obtinute la microscopul optic. Se observa numarul crescut al monocitelor aderate la CMN activate de glucoza; B) analiza statistica a numarului monocitelor aderate la Cmnaflate in diferite conditii experimentale.
A)
B)
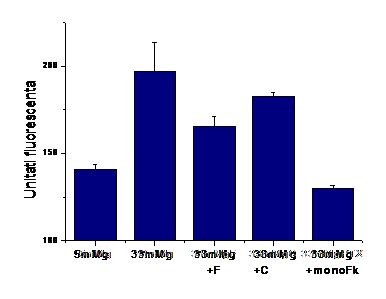
Pentru a demonstra ca procesul de adeziune al monocitelor este dependent de fractalkina, monocitele au fost incubate timp de 30 minute (inainte de adaugarea lor peste CMN) cu fractalkina (10ng/ml) pentru a bloca rceptorii de fractalkina (CX3CR1). Dupa cum putem observa in figura 3, A si B, ultima coloana, blocarea receptorului fractalkinei de pe monocite reduce semnificativ adeziunea acestora la CMN activate de glucoza. Acest rezultat demonstreaza ca fractalkina este implicata in procesul de adeziune, blocarea interactiei dintre fractalkina si receptorul ei implicand reducerea numarului de monocite aderate.
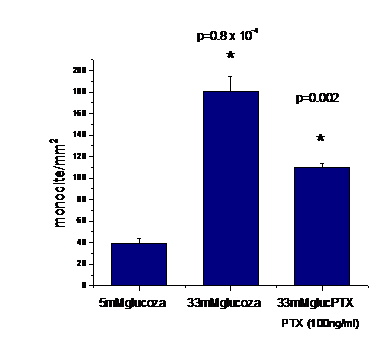
In cazul experimentelor de adeziune in conditii de flux laminar, putem observa (figura 4) ca numarul monocitelor care adera la CMN activate timp de 24 ore cu glucoza crescuta este de 4 ori mai mare decat numarul monocitelor aderate la CMN control. Astfel, procesul de aderare al monocitelor in conditii de flux laminar la CMN activate de glucoza este mult crescut comparativ cu adeziunea in conditii statice. Incercand sa extrapolam aceste rezulatate la conditii in vivo, putem presupune ca in cazul expunerii CMN fluxului de sange hiperglicemic (cand poate sa apara asa-numitul proces de de-endotelializare datorita unei leziuni), are loc un proces crescut de adeziune a monocitelor.
De asemenea, pentru a urmari rolul chemokinelor in acest proces de aderare in flux laminar continu, am incubat CMN cu pertussis toxine (PTX, 100ng/ml), o toxina care inhiba semnalizarea receptorilor chemokinici, transformand receptorul in unul nefunctional. Dupa cum putem vedea, inhibarea receptorilor chemokinici de catre toxina pertussis, reduce semnificativ adeziunea monocitelor la CMN activate de glucoza, dovedind rolul chemokinelor in procesul de adeziune. Pentru ca adeziunea monocitelor nu a fost redusa la nivel de control de catre PTX, putem presupune ca adeziunea este dependenta si de moleculele de adeziune care sunt supra-exprimate de glucoza crescuta, dupa cum am demonstrat in primul capitol al acestei lucrari.
Figura 4. Adeziunea monocitelor la CMN in conditii de flux laminar continuu.
Asa cum am precizat, MCP-1 este eliberat in mediul de cultura al celulelor, rolul sau functional fiind datorat formei solubile, eliberate extracelular. MCP-1 poate forma un gradient si atrage monocitele si celulele T din circulatie in tesut, sau se poate lega la receptor si declansa o cascada de semnalizare care are ca rezultat activarea celulei si expresia mediatorilor inflamatori. Rolul funtional al fractalkinei este dat atat de forma legata de membrana (actionand ca molecula de adeziune), cat si de forma solubila care actioneaza ca chemoatractant. In cazul experimentelor de chemotaxie monocitele migreaza in camerele duble din compartimentul de sus catre compartimentul de jos, proportional cu concentratia de chemoatractanti (chemokine) din compartimentul de jos. Astfel, mediul de cultura conditionat de la CMN control, activate de glucoza crescuta in prezenta sau absenta de fenofibrat sau clofibrat a fost colectat si pus in compartimentul de jos, iar monocitele marcate fluorescent au fost agaugate sus. Rezultatele chemotaxiei arata ca numarul monocitelor care migreaza catre mediul celulelor activate cu glucoza este mai mare decat al celor ce transmigreaza prin membrana camerei duble catre mediul celulelor control (figura 5). Medicamentele reduc numarul monocitelor transmigrate. In cazul in care in compartimentul de jos a fost mediu de cultura in care am adaugat chemoatractractanti endogeni (fractalkina solubila si fMLP), numarul de monocite transmigrate a crescut considerabil (ultimele doua coloane ale figurii 5).
Figura 5 Chemotaxia monocitelor
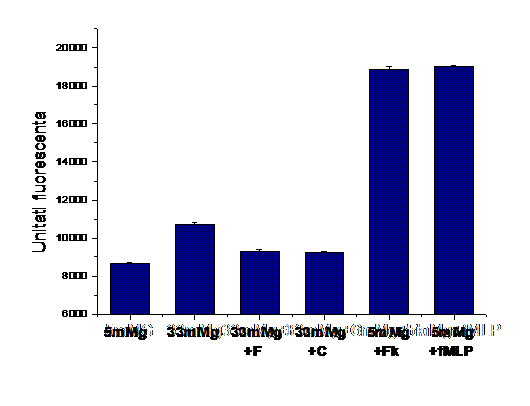
d. DISCUTII SI CONCLUZII
Leziunile aterosclerotice contin un numar mare de celule imune, in particular macrofage si celule T, care mediaza raspunsul inflamator. Monocitele circulante sunt precursori ai celulelor spumoase din leziunile aterosclerotice, iar chemokinele, in particular MCP-1 si fractalkina au rol important in directionarea si migrarea monocitelor din sange in peretele vascular. Activarea si proliferarea CMN intimale, alaturi de transmigrarea si modificarea monocitelor duc la stenoza sau la ocluzia completa a vaselor. CMN au receptor de MCP-1, prezenta lui pe aceste celule explicand rolul pe care il are MCP-1 in procesul de migrare al CMN din medie si adventicie in intima. Exista multe dovezi care demonstreaza implicarea fractalkinei si MCP-1 in ateroscleroza si patologiile cardiovasculare. Similar cu observatiile facute pe arterele coronariene aterosclerotice, unde s-au gasit nivele crescute de fractalkina si MCP-1, vasele pacientilor diabetici exprima fractalkina in inima [Greaves et al., 2001]. Rezultatele obtinute de noi evidentiaza ca nivelelul crescut de glucoza induce expresia fractalkinei si a MCP-1 in celulele muscular netede umane si sustin studiile care au identificat prezenta fractalkinei in intima vaselor diabeticilor. Interesant este ca expresia MCP-1 este indusa direct proportional cu concentratia de glucoza, fiind maxima la concentratia de glucoza cea mai mare. Si in cazul fractalkinei se observa o oarecare dependenta a expresiei in functie de concentratia de glucoza, concentratia de glucoza cea mai mare, inducand si aici expresia maxima. Ambii activatori de PPARa, fenofibratul si clofibratul reduc expresia genica si proteica a MCP-1 si fractalkinei in CMN activate de glucoza crescuta. Efectul glucozei si medicamentelor se reflecta la nivel functional, numarul de monocite aderate la CMN activate de glucoza fiind mai mare decat al celor aderate la celulele control. Procesul de transmigrare al monocitelor catre mediul conditionat obtinut de la CMN activate de glucoza este de asemenea crescut. Fenofibratul si clofibratul reduc numarul monocitelor aderate si numarul monocitelor ce sufera procesul de chemotaxie. Procesul de adeziune al monocitelor la CMN activate de glucoza este dependent de chemokine, dat fiin ca inhibarea semnalizarii receptorilor chemokinici cu toxina pertussis are ca efect numar redus de monocite aderate. In particular, rolul fractlkinei este subliniat de experimentele in care receptorul fractalkinei e la suprafata monocitelor a fost blocat (prin incubare cu fractalkina), ceea ce a dus la scaderea numarului de monocite aderate.
Dat fiind ca expresia crescuta a acestor chemokine are ca efect functional cresterea procesului de adeziune si chemotaxie, putem presupune ca acest efect ar putea fi unul din mecanismele care accelereaza progresia aterosclerozei in conditii de diabet.
2. Cai de semnalizare prin care glucoza crescuta induce expresia chemokinelor MCP-1 si fractalkina in celulele musculare netede
a. INTRODUCERE SI OBIECTIVE
Diabetul este caracterizat de concentratii crescute ale glucozei, care duc la cresterea productiei de specii reactive de oxigen (ROS) prin mai multe mecanisme, printre care: autooxidarea glucozei, stimularea caii poliol, activarea NADPH oxidazei. Stresul oxidativ rezultat (imbalanta dintre producerea ROS si sistemul antioxidant) joac rol cheie in patogeneza diabetului.
ROS eliberate de CE, CMN si monocite/macrofage sunt mediatori ai cailor de semnalizare pro-inflamatoare. Tintele principale ale ROS includ factori de transcriptie, proteine tirozin fosfataze si tirozin kinaze, proteine kinaze activate de mitogen (MAPK), canale ionice, fosfolipaze [Droge, 2001.
Desi studii recente au aratat ca concentratiile crescute de glucoza pot induce disfunctii ale diferitelor cai intracelulare de transducere a semnalului, mecanismele exacte declansate de hiperglicemie care produc boli vasculare, raman complexe. Modificari ale structurii, functiei si reglarea factorilor de transcriptie par sa fie pasi de semnalizare majori care ar putea juca un rol esential in patogeneza si tratamentul bolilor cardiovasculare asociate diabetului.
Legatura dintre hiperglicemie si disfunctiile vasculare este conturata de caile de transducerea a semnalului, ca activarea izoformelor specifice de PKC, a diferitelor protein kinaze activate de mitogen (MAPK) [Srivasta, 2002]. S-a aratat ca printre caile MAPK, calea p38MAPK este indusa de glucoza crescuta in CMN vasculare, in celulele pancreatice si in celulele mesangiale [Igarashi et al., 1999; MacFarale et al., 1997; Wilmer et al., 2001].
In studiul nostru am urmarit efectul glucozei crescute asupra fofso-protein kinazelor ce apartin cailor ERK1/2 si p38MAPK, pentru a gasi modul in care glucoza induce expresia MCP-1 si a fractalkinei.. De asemenea, pentru determinarea modului de actiune al fenofibratului si clofibratului, am testat efectul acestora asupra activarii fosfo protein kinazelor (pERK1/2 si p-p38MAPK).
b. MATERIALE SI METODE
Protocolul experimental
Celulele musculare netede crescute in conditii normale de glucoza au fost impartite, la confluenta, in celule control (crescute inca 24 ore in 5mM glucoza) si celule activate (GC, crescute inca 24 ore in conditii de glucoza crescuta, 33mM). Pentru realizarea unui gradient de concentratie, celulele confluente (crescute in conditii normale) au fost incubate ultimele 24 ore cu concentratii crescatoare de glucoza, de la 5mM la 33mM. In cazul experimentelor care au urmarit efectele medicamentelor fenofibrat si clofibrat, celulele au fost incubate timp de 24 ore in 33mM glucoza in prezenta sa absenta de medicamente. Pentru determinarea cailor de semnalizre implicate in expresia MCP-1 si fractalkinei, inainte de activarea cu 33mM glucoza, CMN au fost preincubate cu inhibitori specifici ai MAP kinazelor p38 MAPK si ERK1/2 (SB 203580, si PD 98059).
Determinarea expresiei genice prin RT-PCR.
Metoda RT-PCR pentru determinarea expresiei genice a MCP-1 si fractalkinei a fost descrisa anterior. Nivelele de ARNm ale MCP-1 si farctalkinei au fost normalizate relativ la nivelele ARNm GAPDH, iar rezultatele obtinute de la trei experimente independente au fost analizate statistic.
Determinarea expresiei proteice prin Western Blot
Investigarea expresiei proteice a diferitelor protein kinaze s-a facut in omogenate celulare obtinute prin lizarea CMN aflate in diferite conditii experimentale cu tampon de liza specific pentru fosfo proteine. Tamponul de liza folosit este alcatuit din: 50mM HEPES, 5mM EDTA, 50mM NaCl, 1% Triton, pH 7.4, continand inhibitori de proteaze (10mg/ml aprotinina, 1mM PMSF, 10mg/ml leupeptin) si inhibitori de fosfataze (50mM fluorid de sodiu, 1mM ortovanadat de sodiu, 10mM pirofosfat de sodiu). Proteina nucleara (50μg) a fost analizata in gel de poliacrilamida (10% SDS-PAGE) iar experimentele de Western Blot au fost efectuate cu ajutorul anticorpilor monoclonali specifici fiecarei proteine testate si anticorpi secundari corespunzatori. Benzile proteice din membrana de nitroceluloza au fost evidentiate cu ajutorul kitului luminescent ECL si densitometrate cu softul Total Lab 1.11 de la Pharmacia.
Metoda luminescenta de testare a activitatii NADPH oxidazei
Activitatea NADPH oxidazei in omogenate celulare a fost determinata printr-o metoda chemiluminescenta descrisa anterior de Ungvari et al. (2003). Reactia se face intr-un volum total de 150ml continand tampon fosfat (50mM), EGTA (1mM), pH 7.0, 5μM lucigenin (5μM) si NADPH (100μM). Reactia a fost declansata prin adaugarea omogenatului celular (100μg proteina). Emisia a fost inregistrata in fiecare secunda, timp de 20 minute la un luminometru (GENios, Tecan). Activitatea NADPH oxidazei a fost exprimata ca unitati relative de lumina (RLU)/ μg proteina.
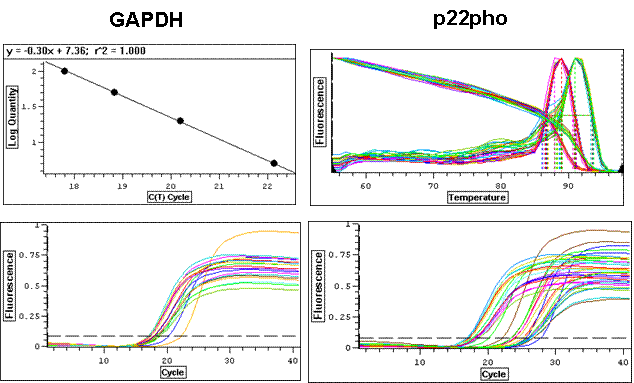
Real Time PCR
Experimentele de Real Time PCR au fost efectuate pentru a urmari efectul glucozei crescute asupra subunitatii p22 a NADPH oxidazei. Cuantificarea subunitatii p22phox a NADPh oxidazei s-a facut prin amplificarea cDNA folosind un termociclu real-time Opticon 2 DNA (MJ Research). Conditiile de amplificare optimizate au fost: 0.4mM pentru fiecare primer, 4mMMgCl2, si temperatura de annealing la 65 C si de extensie la 72 C, timp de 40 cicluri. Cuantificarea relativa a fost facuta folosind metoda comparativa CT, gena GAPDH fiin folosita ca un control intern.
c. REZULTATE
Expresiile MCP-1 si fractalkinei induse de glucoza crescuta in celulele endoteliale umane sunt reduse inhibitori ai p38MAPK si ERK1/2
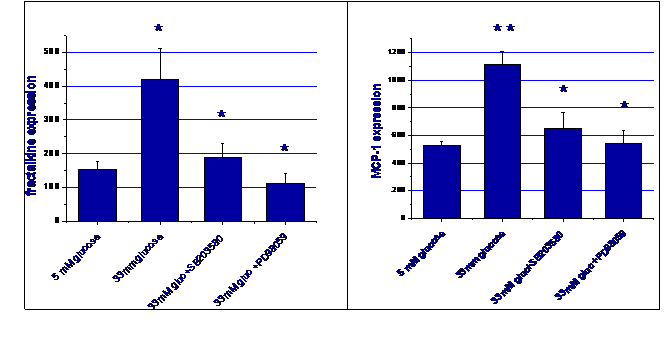
Exista multe studii care arata ca activarea PKC, PTK, MAPK, si NF-kB pot fi implicate in producerea chemokinelor. Astfel, am presupus ca unele din aceste cai de semnalizare pot contribui la expresia chemokinelor indusa de glucoza crescuta in CMN. Mai intai CMN au fost pretratate cu PD 98059, 20 μmol/L (inhibitor al ERK1/2) si cu SB 203580, 10 μmol/L (inhibitor al p38 MAPK).
Figura 6. Efectul inhibitorilor MAP kinazici asupra expresiei MCP-1 si fractalkinei
C
F E
Ambii inhibitori au redus semnificativ (figura 6, E si F) expresia genica si proteica a fractalkinei si MCP-1 indusa de glucoza crescuta (figura 6, A,B, C si D). Aceste date arata ca p38 MAPK si ERK1/2 sunt implicate in modularea expresiilor fractalkinei si MCP-1 in conditii de glucoza crescuta in celulel musculare netede umane.
2) Activarea p38MAPK si ERK1/2 de catre glucoza crescuta este inhibata de fenofibrat si clofibrat
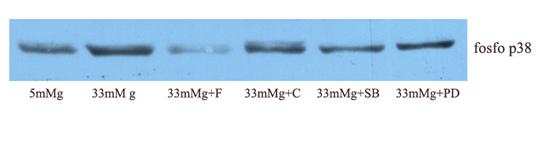
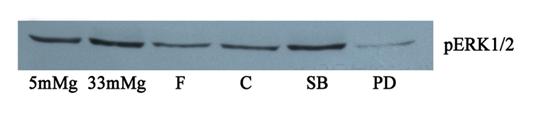
Anterior s-a arat ca in celulele endoteliale calea p38 MAP kinaza este activata de stimuli ce induc stres, incluzand ROS, hiperglicemie si cytokine proinflamatoare [Surapisitchat et al., 2001]. Activarea p38 regleaza inducerea genelor inflamatoare si activarea altor cai de semnalizare inflamatoare, inclusiv NF-kB [Evans et al., 2001]. Datele existente pana in prezent demonstreaza ca fosforilarea si activarea caii p38 sunt implicate in expresia unor molecule pro-inflamatoare [Rousseau et al., 1997]. Activatorii de PPARa au proprietati anti-inflamatoare, astfel am urmarit efectul acestora asupra asupra formei fosforilate (activate) a p38MAPK. Rezultatele de Western blot arata ca ambele medicamente folosite, fenofibratul si clofibratul, reduc activarea fosfo p38MAP kinazei. Pentru realizarea unor controale am preincubat (30 minute) celulele musculare netede cu inhibitor specific al caii p38 MAPK (SB 203580) sau al caii ERK1/2 (PD 98059) si apoi le-am activat cu 33mM glucoza. Dupa cum era de asteptat, inhibitorul de p38 a redus drastic activarea p38MAPk indusa de glucoza, inhibitorul de ERK1/2 neavand niciun efect asupra fosfo p38MAPK. Dupa cum se observa in figura. 7, activatorii de PPARa au redus semnificativ fosforilarea p38MAPK.
Figura 7. Expresia formei activate a p38 MAPK (fosfo p38 MAPK)
In cazul fosfo ERK, concentratia mare de glucoza induce fosforilare crescuta a acestei MAPK. Fenofibratul si clofibratul reduc fosforilarea ERK, astfel ca efectul anti-inflamator al acestor medicamente poate fi datorat inhibarii cailor de activare ale MAP kinazelor. Dupa cum era de asteptat, (figura 8) inhibitorul de p38MAPK nu are efect asupra pERK1/2, iar inhibitoul de ERK1/2 (PD 98059) inhiba de tot forma fosforilata a ERK1/2.
Figura 8. Expresia formei activate a ERK1/2 (fosfo ERK1/2)
2) Activarea NADPH oxidazei de glucoza crescuta in CMN
Pentru a investigata mecanismele prin care glucoza crescuta activeaza caile MAPK kinazelor, si cunoscand ca speciile reactive de oxigen sunt activatori ai acestora, ne-am uitat la nivelul speciilor reactive de oxigen induse de glucoza. Practic, stiind ca sursa principala de specii reactive de oxigen in CMN este NADPH oxidaza, am determinat activitatea acesteia in conditii normale si crescute de glucoza. Activitatea NADPH oxidazei determinata cu ajutorul lucigeninei (metoda chemiluminescenta) este crescuta de concentratia mare de glucoza, in CMN (figura 9), ceea ce este echivalent cu nivele crescute de specii reactive de oxigen. Activatorii de PPARα inhiba activarea NADPH oxidazei (figura ), ceea ce sugereaza ca aceste medicamente pot reduce fosforilarea MAP kinazelor p38 MAPK si ERK1/2 prin reducerea stresului oxidativ indus de glucoza crescuta.
Figura 9. Activitatea NADPH oxidazei in celulele musculare netede umane
Enzima NADPH oxidaza este o enzima asociata membranei care care catalizeaza reducerea unui elecron de la oxigen, folosind NADPH sau NADH ca donori de electroni. Ea are cinci componente: p40phox, p47 phox, p6 phox, p22phox si gp91phox. in celulele neactivate, trei din aceste componente p40, p47 si p67 sunt prezente intr-un complex in citosol. Celelalte doua componente, p22 si gp91 sunt legate de membrana. Cand aceste doua grupuri sunt separate prin distributia lor diferita in in cele 2 compartimente celulare, ca in celulele neactivate, enzima este inactiva. Daca are loc translocarea complexului citoplasmatic la membrana, enzima devine activa.
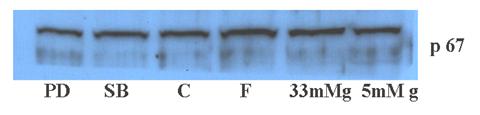
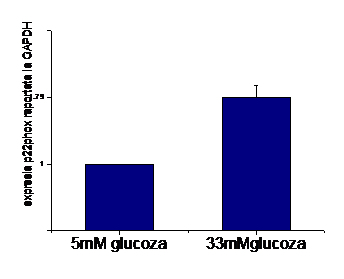
Pentru a determina mecanismul de activare al NADPH oxidazei de catre glucoza crescuta, am urmarit efectul acesteia asupra doua din subunitatile NADPH oxidazei. Rezultatele obtinute arata ca glucoza activeaza subunitatea p22phox a NADPH oxidazei, iar fenofibratul si clofibratul scad espresia acesteia (figura 10, A). De asemenea, inhibitorul de ERK1/2 dar nu de p38 MAPK reduce expresia p22phox. In contrast, subunitatea p67 a NADPH oxidazei nu este modificata semnificativ de glucoza crescuta (figura 10, B). Desi clofibratul induce o scadere aparenta a acestei subunitati, efectul nu este semnificat In literatura de specialitate activarea subunitatii p22phox este echivalenta cu activarea NADPH oxidazei, in timp ce subunitatea p 67phox pare sa fie o subunitate ne-esentiala a NADPH oxidazei. Astfel, putem conclude ca nivelele crescute de glucoza induc crsterea expresiei p22phox si astfel activarea NADPH oxidazei, iar medicamentele inhiba activarea NADPH oxidazei prin scaderea expresiei proteice a a cestei subunitati.
Figura 10. Expresia proteica a subunitatilor p22 si p67 a NADPH oxidazei.


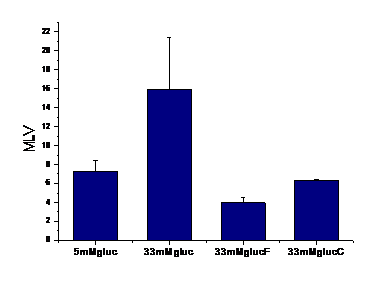
B

In continuare am determinat expresia genica a subunitatii p22 phox. Astfel am facut analiza cantitativa a expresiei genice a p22phox (figura 5) prin real time PCR si rezulatele confirma pe cele obtinute la nivel de proteina, expresia genica a subunitatii p22 fiind crescuta de concentratia de 33mM glucoza.
Figura 11. Expresia genica a subunitatii p22phox
A
B
d. DISCUTII SI CONCLUZII
Daca studiile mai vechi prezentau o redundanta functionala aparenta a chemokinelor in recrutarea aterogenica, studiile din ultima vreme aduc dovezi pentru existenta unei specializari elaboarte si a unei colaborari intre chemokine in pasii distincti ai procesului de recrutare a diferitelor celulele mononucleare.
Rezultatele noastre anterioare arata ca nivelul crescut al glucozei induce expresia MCP-1 in celulele endoteliale umane si ca activarea factorilor de transcriptie NF-kB si AP-1 de catre speciile reactive de oxigen (induse de glucoza), sunt implicati in acest proces. Prezentul studiu demonstreaza ca celulele musculare netede umane activate de glucoza exprima nivele crescute de fractalkina si MCP-1. Acest efect este reflectat la nivel functional in numarul crescut de monocite care sufera procesul de chemotaxie si care adera la CMN activate de glucoza. Caile de semnalizare implicate in supra-expresia celor doua chemokine in CMN activate de glucoza sunt activarea cailor MAP kinazelor: p38MAPK si ERK 1/2. Inhibitorii specifici ai acestor MAP kinaze, SB 203580 si PD 98059 reduc expresiile genice si proteice ale MCP-1 si fractalkinei.
Stresul oxidativ asociat nivelelor crescute de glucoza este implicat, de asemenea, si in cazul celulelor musculare netede. Astfel, activitatea NADPH oxidazei este indusa de glucoza prin cresterea expresiei subunitatii esentiale a acestei enzime, p22phox. Fenofibratul si clofibartul reduc expresia subunitatii p22phox a NADPH oxidazei, rezultat ce evidentiaza unul din posibilele mecanisme prin care activatorii de PPARa reduc nivelul speciilor reactive de oxigen. Glucoza crescuta nu are efect semnificativ asupra subunitatii p67phox a NADPH oxidazei.
Aceste rezultate sugereaza ca hiperglicemia creste expresia MCP-1 si fractalkinei in celulele vasculare si astfel poate promova initierea si progresia aterosclerozei, supra-expresia acestor molecule de catre hiperglicemie fiind probabil, unul din factorii care accelereaza ateroscleroza in diabet. De asemenea, este interesant de observat ca activarea PPARa de fenofibrat si clofibrat, duce la scaderea expresiei chemokinelor inflamatoare MCP-1 si fractalkina, in conditii hiperglicemice, ceea ce sugereaza ca activarea PPARa este o cale prin care se pot atenua efectele daunatoare ale hiperglicemiei.
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 1580
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2025 . All rights reserved