| CATEGORII DOCUMENTE |
| Alimentatie nutritie | Asistenta sociala | Cosmetica frumusete | Logopedie | Retete culinare | Sport |
Oportunitatile si aplicatiile oferite de toxicogenetica sunt frecvent discutate alaturi de cele promise de toxicogenomica.
Raspunsul la medicamente si la compusii chimici din mediu variaza in functie de genotip. Unii pacienti reactioneaza bine la medicamente, in timp ce altii nu prezinta ameliorari sau chiar prezinta reactii adverse. Indivizii pot manifesta reactii adverse la diferiti agenti din mediu, precum alergenii. Secventierea genomului uman si determinarea polimorfismului acestuia au oferit oportunitati pentru intelegerea bazei genetice pentru raspunsul diferit la agenti toxici, domeniu cunoscut ca toxicogenetica.
Toxicogenetica descrie mutatiile de la nivelul genomului care sunt capabile sa influenteze relativa susceptibilitate a unui individ (grup de indivizi) la efecte adverse asupra sanatatii ce pot rezulta din expunerea la factori exogeni.
Toxicogenomica analizeaza schimbarile intervenite in expresia genelor induse a intra in activitate in sistemul biologic de expunerea la xenobiotice (Gant, 2002).
Cele doua discipline prezinta complementaritate. Polimorfismele care altereaza functia biologica pot schimba spectrul genelor implicate in raspunsul la factori toxici.
Numai aproximativ 0.1% din trei miliarde de perechi de baze care compun genomul uman variaza ca secventa intre indivizi. Informatia codificata in acesta mica portiune a genomului poate avea efecte profunde asupra constitutiei biologice. Cele mai dramatice exemple sunt cele in care mici alterari ale secventei unei gene pot cauza moarte prematura, sau dizabilitati severe (Alberts si colab., 2002; Habener & Wiliams, 2002; King si colab., 2002).
Boli care nu erau considerate a fi determinate genetic - de exemplu obezitatea, cancerul si boli cardiovasculare- pot avea componente genetice semnificative. Constitutia genetica afecteza, de asemenea, recunoasterea xenobioticelor si raspunsul la acestea si, drept consecinta, susceptibilitatea lor relativa de a induce efecte daunatoare.
Polimorfismul poate afecta functia biologica in numeroase moduri. Modificarea nucleotidelor in zona reglatoare a unei gene poate avea un impact semnificativ asupra integritatii functiei unei proteine. Polimorfisme in regiunile promotor pot modifica nivelul de exprimare a unei proteine, in timp ce acelea care afecteaza jonctiunile exon-intron pot cauza alterari ale splicingului ARN-ului mesager (Kuehl si colab., 2001). Polimorfisme ce implica segmente mai mari ale genomului includ deletii, conversii si duplicatii.
Etapele initiale de metabolizare a medicamentelor si a altor agenti chimici sunt realizate in principal de citocromul P450 (CYP), familie de enzime (Danielson, 2002; Nebert & Russell, 2002). S-a observat ca multe dintre cele 63 de gene ale CYP uman prezinta polimorfisme care determina raspunsul diferit la xenobiotice.
Polimorfismul genelor CYP2D6 a fost intens studiat. Enzima codificata de aceste gene este responsabila de metabolizarea a pana la 25% a tuturor medicamente- lor si, probabil, o proportie similara din compusii chimici din mediu.( Ingleman-Sundberg si colab., 1999). Polimorfismul sever al CYP2D6 altereaza activitatea enzimei si nivelul acesteia.
O proportie de 6% din populatia caucaziana poseda deletia in conditie homozigota a genei CYP2D6 si drept consecinta este incapabila sa metabolizeze anumite medicamente, rezultand efecte adverse nedorite. Acest fenotip poate fi cauzat si de productia unei proteine inactive si instabile rezultata dintr-o deletie, o conversie sau din mutatia unei singure perechi de baze la nivelul genei. Alte polimorfisme rezulta din producerea unei variante de proteine cu activitate scazuta.
Polimorfismele care determina cresterea nivelului de activitate a enzimelor CYP2D6 se datoreza amplificarii genei, ajungandu-se ca unii indivizi sa prezinte 13 copii ale genei.(Johansson si colab., 1993). Pacientii cu nivele neobisnuit de ridicate ale enzimei CYP2D6 pot metaboliza medicamentele atat de rapid incat tintele terapeutice nu sunt atinse cu doze normale.
La nivelul altor familii de gene, polimorfismul poate afecta si raspunsul individului la xenobiotice. Majoritatea compusilor chimici sunt metabolizati pe o cale care implica " faza I" (functionala) si "faza II" (conjugativa). (Rushmore & Kong, 2002). Enzimele citocromului P450 participa in faza I. Variatiile in activitatea enzimelor fazei a II-a, spre exemplu a glutation S-transferazei, pot afecta de aseme- nea raspunsul la medicamente si la agenti chimici din mediu. Polimorfismul in alte familii de gene poate afecta raspunsul la xenobiotice, iar aici sunt incluse si genele care codifica transportorii substantelor medicamentoase, diverse proteine din membrana plasmatica, receptorii nucleari si canalele ionice. Desi au fost constatate putine polimorfisme in aceste familii de gene, trebuie avut in vedere ca aceste variatii genetice exista.
Studiile de genetica moleculara au inceput sa elucideze bazele ereditare pentru diferentele in susceptibilitatea la anumiti factori de mediu toxici inhalati. Polimorfismul unei nucleotide in regiunea promotor a genei factorului de necroza tisulara (TNF-α ) si a genei interleukinei 1 (IL-1) a fost asociat cu boli inflamatorii cronice. S-a evidentiat interrelatia dintre aceste particularitati genetice si susceptibilitate la silicoza prezenta la mineri. Au fost analizati trei sute douazeci si cinci de fosti mineri cu variate grade de silicoza pulmonara si o suta saizeci si patru care nu prezinta acesta boala. Prezenta variantei TNF-α (-238) a fost asociata cu silicoza severa, in timp ce receptorul antagonist IL-1 (+2018) si varianta TNF-α (-380) au fost evidentiati la subiectii cu forma incipienta sau severa a bolii (Yucesoy si colab., 2001).
Alergia poate fi definita operational ca fiind un efect advers care poate rezulta prin stimularea producerii de raspunsuri imune specifice. Studii relativ recente au evidentiat ca desi polimorfismul IL-10 pare sa nu determine susceptibilitatea adultului la astm, se produce o asociere certa intre halotipuri si nivelul IgE serice si numarul de eozinofile circulante la subiectii astmatici (Gawroriska-Szklarz si colab., 2001).
Genele CYP1A1, CYP1A2 si CYP1B1 (codifica citocromul P450 1A1, 1A2 si 1B1) sunt reglate la mamifere de receptorul de hidrocarburi aromatice (AHR- aromatic hydrocarbon receptor). Enzimele CYP1 sunt responsabile pentru activarea si detoxifierea a numeroase hidrocarburi aromatice prezente in produsii de combustie. O multime de substrate pentru enzimele CYP1 sunt liganzi pentru AHR.
S-au efectuat studii pe linii de soareci care au o disruptie a genei CYP1 si s-au observat efecte paradoxale; in vitro sau in culturile de celule aceste enzime arata activarea metabolica a arilaminelor, in timp ce la animalele cu gena intacta aceste enzime sunt uneori mai importante decat in potentarea metabolica. Datele obtinute pe animalele care prezinta gena in forma functionala sunt in contradictie cu politica companiilor farmaceutice ale caror testari de rutina sunt insuficiente. Daca un medicament de testat prezinta inducerea CYP1, urmatoarele teste sunt in general intrerupte de teama unor efecte toxice sau carcinogenice.
Genele umane ale CYP1B1 au fost descoperite relativ tarziu comparativ cu cele pentru CYP1A1 si CYP1A2 care au fost identificate cu mai mult de douazeci de ani in urma. Inainte ca activitatea enzimatica a CYP1B1 sa fie caracterizata, s-a crezut ca CYP1A1 este responsabil pentru activitatea hidrolazica.
CYP1A1
Nivele crescute ale ARNm, proteinelor si activitatea enzimatica ale CYP1A1 sunt de obicei detectate urmarind inductia realizata de hidrocarburi aromatice ciclice; in realitate, numerosi inductori sunt la randul lor metabolizati de CYP1A1.
Activitatea inductibila a CYP1A1 este intalnita in fiecare tesut al corpului inclusiv vase de sange, celule endoteliale, celule epiteliale ale pielii si ale tractului gastrointestinal, la fetus si chiar la embrion (S. Malebo, M. Ingelman-Sundberg, 2001).
In populatia asiatica dar nu si in cea caucaziana sau in populatia africana, CYP 1A1 alela 2 poate fi asociata cu o mutatie care afecteaza metabolizarea compusilor din fumul de tigara si a carei prezenta se leaga de susceptibilitatea de a dezvolta cancer. Gena umana CYP1A2 este localizata la doar 23.3 kpb de gena CYP1A1.
CYP1A2
Produsul CYP1A2 este implicat in metabolizarea anumitor medicamente si a numeroase amine aromatice din mediu: amine N-heterociclice care se gasesc in mancarea gatita pe gratar cu carbune, 2-amino-1-metil-6-fenilimidazopirina si arilamine precum 2-acetilaminofluorena si 4-aminobifenilul. O activitate substantiala a CYP1A2 se intalneste in ficatul mamiferelor. Activitatea genei umane CYP1A2 este indusa de hidrocarburi aromatice policiclice in ficat, tractul gastrointestinal, epiteliul nazal si la nivelul creierului. Exista numeroase diferente intre indivizi in ceea ce priveste modul de impachetare al CYP1A2 din ficat.
La om au fost descrise cel putin paisprezece mutatii in interiorul si in apropierea genei CYP1A2, in trei cazuri s-a constatat o scadere a activitatii enzimatice si intr-un caz o crestere a inductibilitatii.
CYP1B1
Produsul acestei gene metabolizeaza numeroase hidrocarburi aromatice policiclice si de asemenea amine N-heterociclice, arilamine si numeroase alte substante carcinogene. Expresia CYP1B1 este ridicata in celulele endoteliale vasculare, sani, prostata, uter si in diverse tesuturi de la nivelul capului. Diferente individuale semnificative in nivelul proteinelor CYP1B1 si CYP1A1 au fost evidentiate in plamani la om, desi ceea ce este constitutiv si ceea ce este inductibil este dificil de stabilit functie de subiectii fumatori, nefumatori si fosti fumatori.
Se cunoaste faptul ca variatiile individuale in ceea ce priveste repararea ADN se coreleaza cu riscul de cancer. Capacitate de reparare a ADN scade o data cu inaintarea in varsta. Atat metodele genotipice cat si cele fenotipice pot fi folosite pentru a stabili riscul de cancer la fumatori. Fumul de tigara induce nivele mult mai mari al unor enzime de reparare decat cele normale.
Se considera ca aceste polimorfisme genetice afecteaza nivelul biomarkerilor si riscul mutatiilor in gena p53, in tumori. S-a evidentiat faptul ca si comportamentul fumatorilor are o componenta genetica, efectuandu-se studii pe fumatori incepatori si pe cei la care obiceiul de a fuma persista (J. Natl, 2002).
Pana in prezent au fost descoperite cel putin 22 de mutatii la nivelul si in apropierea genei umane CYP1B1 insa niciuna nu cauzeaza o scadere a activitatii enzimatice. Multe dintre aceste mutatii sunt asociate cu afectiuni produse de erori metabolice innascute (d.ex. cu glaucomul congenital primar, sugerand ca dezvoltarea camerei anterioare a ochiului in timpul embriogenezei poate necesita metabolizarea de catre CYP1B1 a unui substrat endogen important.).
CYP1B1 este responsabila pentru imunotoxicitatea indusa de hidrocarburile aromatice policiclice.
Controleaza numeroase gene incluzand si cele trei gene CYP1. Liganzii pentru acest receptor sunt dioxina, hidrocarburile aromatice policiclice, hidrocarburile aromatice polihalogenate, indolii, derivatii endogeni ai triptofanului, benzoflavonele intalnite in special la crucifere. Gena care codifica receptorul pentru hidrocarburi aromatice exista la toate vertebratele, si chiar si la unele nevertebrate, precum Caenorhabditis elegans (care este un nematod).
Acest receptor participa la controlul ciclului celular si la apoptoza. Pana in prezent au fost raportate cel putin noua mutatii in interiorul sau in apropierea genei pentru receptorul de hidrocarburi aromatice la om si 2,213 mutatii la soareci.
In celulele epiteliului gastrointestinal sau in hepatocite exista posibilitatea ca activitatea CYP1A1 si CYP1A2 sa fie strans legata de Faza II enzimatica, rezultand o detoxifiere eficienta mai degraba decat o crestere a toxicitatii ( Daniel A. Nebert, Timothy P. Dalton, Allan B. Okey, Frank J. Gonzalez, 2004).
Epigenomul serveste ca interfata intre mediul dinamic si genomul static mostenit. Modificarile epigenetice ale materialului ereditar, care traseaza epigenomul constau in principal in metilarea ADN. Aberatiile epigenetice au consecinte similare cu polimorfismele care determina variatii ale functionarii genelor. Datele recente sugereaza ca epigenomul este dinamic si este sensibil la semnale din mediu nu numai in perioadele critice in dezvoltare, ci si mai tarziu. S-a evidentiat ca nu numai agentii chimici, ci si expunerea la alti factori de mediu, ca de exemplu grija materna, poate afecta epigenomul.
Se presupune ca expunerea la diferiti agenti din mediu poate conduce la diversitate fenotipica individuala; conditia epigenetica poate afecta susceptibilitatea la xenobiotice. Desi actuala intelegere a impactului mecanismelor epigenetice asupra actiunii toxice a xenobioticelor este foarte limitata, se anticipeaza ca in viitor epigenetica va fi incorporata in evaluarea sigurantei agentilor chimici.
Epigenomul consta in cromatina si in modificarile acesteia la fel ca si modificarile covalente prin metilarea citozinei aflate in secventele dinucleotidice CG (Razin, 1998). Epigenomul determina accesibilitatea aparatului de transcriptie in interiorul genomului. Genele inaccesibile sunt silentiate, in timp ce genele accesibile sunt transcrise. De aici se fac distinctiile dintre configuratia condensata si cea (relativ) decondensata a cromatinei (Grunstein, 1997; Varga-Weisz & Becker, 2006). Domenii mari de cromatina care sunt netranscrise sunt denumite heterocromatina, aceste regiuni fiind localizate in jurul centromerilor si telomerilor. Portiunile de cromatina care permit exprimarea genelor sunt denumite cu termenul de eucromatina.
Un mare numar de loci din genomul uman se transcriu in ARN necodificator, care se proceseaza pana la ARNsn. S-a descoperit ca microARN joaca un rol important in tumorigeneza (Zhang si colab., 2007) si poate avea, de asemenea, rol in modularea raspunsului la substante medicamentoase (Vo si colab., 2005).
O posibilitate interesanta dar inca neexplorata este ca microARN regleaza nivelele de expresie a genelor implicate in metabolizarea medicamentelor si raspunsul la xenobiotice. Expunerea la medicamente si la substante xenobiotice poate altera repertoriul de expresie al microARN (Saito & Jones, 2006). Insasi expresia microARN este reglata de factori epigenetici precum metilarea ADN si structura cromatinei (Saito & Jones, 2006) iar aceasta poate media impactul reprogramarii epigenetice ca raspuns la expunerea la factori de mediu. De asemenea microARN poate actiona prin schimbarea structurii cromatinei si poate fi considerat o componenta a mecanismelor de modificare a cromatinei si a metilarii ADN.
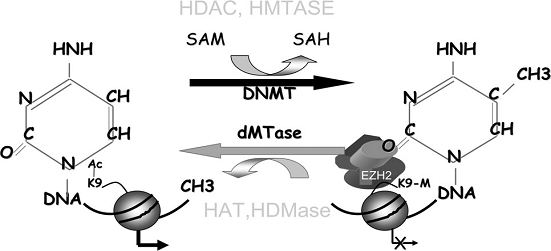
Echilibrul de metilare a ADN. Reactii de metilare si demetilare (dupa Moshe Szyf, 2007)
Masinariile moleculare de metilare si demetilare pot fi potential modulate de factori precum dieta, alcoolul, fumul de tigara sau toxice precum arsenicul. S-a constatat ca donorul de grupari metil, S-adenozilmetionina inhiba activitatea demetilazei in celulele umane si in vitro, si demetilarea in genele metastazice in cancerul de san si de prostata (Pakneshan si colab., 2004; Shukeir si colab., 2006). Nivelele de S-adenozilmetionina pot fi modulate in functie de continutul in metil din dieta, de acidul folic si de vitamina B12 ingerate prin dieta, si de consumul de alcool (Rambaldi & Gluud, 2006). Agentii care afecteaza in mod direct nivelele de metionina sau de S-adenozilmetionina pot avea efecte asupra programarii epigenetice a tumorigenezei si a genelor inductoare de metastaze.
S-a demonstrat recent ca fumul de tigara stimuleaza demetilarea genelor metastazice in celulele canceroase din plamani prin inhibarea expresiei DNMT (ADN metiltransferaza) (Liu & Co, 2007). Acesta este un exemplu clar asupra modului in care factori de risc din mediu pot avea impact asupra genomului prin mecanisme nongenotoxice. Este posibil ca acest efect al fumului de tigara sa joace un rol critic in progresul cancerului.
Este importanta identificarea xenobioticelor care afecteaza expresia DNMT si demetilazele. Un alt exemplu il reprezinta fenobarbitalul nongenotoxic carcinogen care induce hipometilare globala si hipermetilarea in unele regiuni ale genomului la rozatoare.
A.
Agenti toxici
Modularea mecanismelor epigenetice
Variatii epigenetice interindividuale
Programarea expresiei genelor anormale
Variatie fenotipica
Susceptibilitate la boli; raspuns la medicamente; comportament
B.
Grija materna in copilarie; dieta; medicamente
Modularea mecanismelor epigenetice
Variatii epigenetice interindividuale
Programare necorespunzatoare a genelor de raspuns la medicamente
Raspuns necorespunzator la toxine
A. expunerea unica la factori nocivi din mediu poate determina reprogramarea epigenetica ce poate modifica fenotipul sau raspunsul la toxine.
B. expunerea un timp indelungat la toxine poate avea ca efect reprogramarea epigenetica din care este posibil ca mai tarziu sa rezulte variatii fenotipice.
(dupa Moshe Szyf, 2007)
Receptorii nucleari reprezinta tinte atractive pentru medicamente datorita rolului lor in reglarea unei game largi de raspunsuri fiziologice. Numerosi agenti farmaceutici impreuna cu anumiti agenti chimici din mediu sunt liganzi pentru receptorii nucleari si pot cauza efecte adverse asupra sanatatii care sunt in relatie directa cu activarea receptorilor nucleari. Identificarea la nivel molecular a evenimentelor care induc un raspuns toxic este dificil de realizat.
Receptorii nucleari au un grup de liganzi activatori ai factorilor de transcriptie, care sunt responsabili de reglarea expresiei genelor asociate in sens larg cu metabolismul si cu diferentierea celulara. Un numar mare de agenti terapeutici inclusiv antibiotice, anticonvulsive, hipolipidemice si medicamente utilizate in terapia cancerului au, de asemenea, drept tinta receptorii nucleari. Liganzii sunt mici si lipofilici. Numerosi receptori prezinta expresie tesut- specifica ce este cruciala pentru specificitatea actiunii medicamentu lui. De asemenea, ei joaca roluri importante in multe procese fiziologice implicand faza I si faza II enzimatice. Aici este inclusa sinteza si metabolismul steroizilor, vitaminei D, colesterolului, lipidelor si acizilor biliari (Waxman & Azaroff, 1992; Honkakoski & Negishi, 2000).
Receptorii nucleari sunt tinte pentru numerosi agenti toxici antropogeni precum ftalatii si dioxina. In timp ce mecanismele prin care acesti agenti chimici mediaza toxicitatea sunt necunoscute, s-a demonstrat ca receptorii nucleari joaca un rol important in efectele lor patofiziologice.
Superfamilia de proteine receptori nucleari este subdivizata in 6 subfamilii, clasificare bazata pe similitudinile secventelor lor de aminoacizi (Aranda & Pascual, 2001). Structura generala a tuturor receptorilor nucleari este foarte similara si contine trei domenii functionale (1) un domeniu de legare a ligandului/de dimerizare, (2) domeniu de legare la ADN/dimerizare slaba si (3) domenii de transactivare. Domeniul de legare a ligandului si de dimerizare de la capatul carboxil terminal al receptorului se afla unde se leaga xenobioticele avand ca efect activarea receptorului. O multime de receptori necesita heterodimerizarea cu retinoid x. Domeniul de legare la ADN este responsabil pentru recunoasterea unui sit receptor-specific care consta intr-o secventa specifica de nucleotide in regiunea promotor a genei tinta. Domeniile de transactivare consista intr-o regiune de activare a functiei de transcriptie ligand-independenta (AF-1) si una de activare a functiei de transcriptie ligand-dependenta (AF-2).
AF-1 este localizata la capatul amino terminal al receptorului si este o tinta pentru cascadele fosforilante mediate kinazic, care pot afecta activitatea transcriptionala in absenta legarii ligandului.
AF-2 este localizata la capatul carboxil terminal si poate interactiona cu alti factori de transcriptie pentru a forma complexe co-activatoare care regleaza activitatea acetiltransferazica a histonelor si complexe co-represoare care regleaza activitatea deacetilazica a histonelor (Glass & Rosenfeld, 2000; Steinmetz si colab., 2001).
Receptorii nucleari regleaza transcriptia a numeroase proteine implicate in metabolismul xenobioticelor, in principal enzimele CYP450 ale fazei I (Johnson si colab., 2002). Liganzii sunt adesea neselectivi pentru un anumit receptor nuclear tinta dar sunt agonisti partiali sau totali pentru un anumit numar de receptori.
Au fost dezvoltate diverse metode pentru studierea modificarilor chimice induse in macromolecule (gene, proteine, metaboliti) care impreuna definesc raspunsul unui organ. Apararea impotriva toxinelor endo- si exogene este foarte eficienta.
Mai mult de 60% din actualele medicamente antitumorale deriva din surse naturale. Produsii naturali sunt substante "privilegiate" selectate in functie de capacitatea de a interactiona cu tintele biologice (Balazs Sarkadi si colab., 2006).
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 2279
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2025 . All rights reserved