| CATEGORII DOCUMENTE |
| Demografie | Ecologie mediu | Geologie | Hidrologie | Meteorologie |
Proprietatile generale ale apei
Apa, in stare pura, este un lichid cu densitatea egala cu 1 gr/cm3, incolor, inodor si insipid. Apa este un oxid de hidrogen si se afla in natura sub toate cele trei stari de agregare: lichida, solida si gazoasa.
Apa lichida este cea mai raspandita, ocupand cca 2/3 din suprafata Terrei, sub forma de mari, oceane, lacuri, fluvii, rauri, apa de precipitatii. Apa lichida se intalneste si in paturile superficiale ale scoartei, in depozitele permeabile sau in fisuri ale rocilor.
Apa in stare solida se intalneste in ghetarii continentali, marini sau montani, in zapezile persistente, sau in cele sezoniere din timpul iernilor boreale sau australe, in cristalii de gheata din atmosfera, in fenomenele meteorologice de grindina, bruma, chiciura etc.
Apa sub forma de vapori rezulta din procesele de evaporatie si de transpiratie si se intalneste, cu deosebire, in atmosfera, dar si in golurile din roci, mai ales la adancimi mari unde temperaturile sunt crescute, datorita gradientului geotermic (spre interiorul Pamantului temperatura creste cu 1 0C la fiecare 33 m).
In general, in stare naturala, apa nu este pura datorita proprietatii sale de a dizolva substantele solubile. Chiar si in atmosfera, in precipitatii, exista anumite concentratii chimice, adesea destul de mari care pot genera ploi acide.
Intre propietatiele generale ale apei mai trebuie mantionate cateva:
apa prezinta o mobilitate buna (uneori chiar foarte mare) sub toate cele trei stari de agragare. Este fluida, in stare lichida, plastica, in stare solida si se comporta ca un gaz foarte mobil in stare de vapori;
spre deosebire de alte substante, apa trece relativ usor de la o stare de agregare la alta, pe un ecart mediu de numai 100 0C;
apa, pura, nu este conducator de electricitate;
apa prezinta o conductibilitate termica redusa, se incalzeste si cedeaza caldura mai greu decat rocile;
apa este un lichid incompresibil.
Molecula de apa si structura ei
Prin analiza sau prin sinteza poate fi identificata constitutia apei. O molecula de apa este alcatuita din doi atomi de hidrogen si un atom de oxigen. Procentual, in greutatea moleculara ponderea o detine oxigenul (88,9 %) in timp ce hidrogenului ii revin 11,1 %.
Formarea apei din cele doua categorii de atomi se realizeaza printr - o reactie chimica insotita de degajare de caldura.
H2 + ½ O2 = H2O + 68,4 kcal
Masa moleculara a apei rezulta din sumele maselor atomilor care o compun (1 pentru H2 si 16 pentru O2).
Masa moleculara = (2 x 1) + (1 x 16) = 18
Cercetata in amanunt, molecula de apa se prezinta sub forma unghiulara, unghiul α, format de cele doua legaturi (drepte) avand valoarea de 104,50. Distanta O - H are valoare constanta atat la apa lichida cat si la starea solida
Asocierea a doua molecule de apa se numeste dihidrol (H2O)2, a trei molecule - trihidrol (H2O)3, dupa denumirea simpla de "hidrol" data moleculei de apa neasociata. Cel mai stabil este dihidrolul.
In functie de izotopii hidrogenului, in natura se intalnesc, in cantitati mici si anumite "varietati" ale apei apa semigrea (HDO), apa grea (D2O) si apa foarte grea (T2O).
Apa grea se deosebeste de cea obisnuita prin:
densitate = 1,107 gr/cm3 la 4 0C;
temperatura de fierbere: 101,6 0C;
temperatura de solidificare: - 3,3 0C .
In cazul apei cristalizate, moleculele sunt dispuse tetraedic (J. D. Bernal si R. H. Fowler, 1933), dar aceasta amenajare tetraedica este stabila numai la temperaturi foarte scazute (- 200 0C). La temperaturi > 0 0C se mentin 85 % din legaturi, la 40 0 raman 50 % din legaturi, iar la 1000 C (evaporare) dispar toate legaturile. Moleculele neasociate nu au o grupare constanta asa cum se prezinta cele asociate. Asa se explica faptul ca gheata are o densitate mai mica decat apa si pluteste pe aceasta.
Intre 0 0 si 4 0C scad brusc numarul de legaturi de hidrogen si are loc o contractie de volum. Asa se explica densitatea maxima a apei la 4 0C. Peste 4 0C dilatarea devine predominanta.
Anomaliile fizice (particularitatile) apei se explica prin fenomenul de asociere (polimerizare) a moleculelor de apa:
constanta dieletrica mare: ε = 80,75;
tensiunea specifica: σ = 73 dyn/cm;
variatia mare a vascozitatii cu temperatura;
intervalul de 100 0C in care apa exista ca lichid.
Caracteristicile calitative ale apei
Asa cum am mentionat, in stare naturala, apa nu este pura, ci o solutie, care contine substante solide si gazoase dizolvate in roci, sol sau atmosfera. La temperaturi obisnuite apa este un lichid fara gust, fara miros, si fara culoare (in straturi subtiri).
Sub influenta factorilor externi si mai ales, prin interventia omului, apa isi schimba caracteristicile de calitate, depasind limitele care o fac folosibila.
Calitatea apei este urmarita permanent de unitatile specializate ale Ministerului Mediului si Gospodaririi Apelor sau ale Ministerului Sanatatii, prin analize efectuate in laboratoare specializate.
Numarul analizelor si elementelor chimice determinate se stabileste in functie de necesitati, pentru fiecare caz in parte (pentru ape potabile, ape industriale, apa ca materie prima, irigatie, agrement etc.).
Apele naturale se caracterizeaza in mod unitar prin ansamblul proprietatilor organoleptice, fizice, chimice, radioactive, biologice si bacteorologice. Limitele lor de folosire sunt prevazute de STAS 4706/88.
Proprietatile fizice ale apei in stare lichida, solida si de vapori
In general, proprietatile fizice ale apei cele mai importante pentru hidrologie sunt: temperatura, culoarea, turbiditatea, transparenta, conductibilitatea electrica, radioactivitatea, densitatea apei, vascozitatea, starea de agregare.
Din punct de vedere fizic apa este o substanta cu proprietati unice, avand densitatea maxima (0,9999 gr/cm3) la 3,980 C, tensiune superficiala foarte ridicata, marirea volumului la solidificare, caldura specifica foarte mare, caldura latenta la topire apreciabila, conductibilitate termica ridicata, constanta electrica mare, putere izolanta deosebita, capacitate mare de dizolvare, proprietati oxidante etc.
Proprietatile fizice ale apei in stare lichida au fost cel mai bine studiate datorita raspandirii sale apreciabile in natura.
a. Temperatura apei este variabila, in interdependenta cu cea a aerului si se modifica, in tendinta si valoare, in mod asemanator cu temperatura mediului. Mersul temperaturii apei este in directa legatura cu valorile termice ale regiunii globului in care se gaseste corpul acvatic respectiv, iar gama generala de variatie este intre 00 in regiunile reci (polare sau montane inalte) si 400 in regiunile cele mai calde. Exceptie fac apele termale care sunt supraincalzite in conditii geotectonice aparte in interiorul scoartei terestre.
Temperatura apei (ca si a aerului si a mediului in general) variaza cu latitudinea, altitudinea, expozitia sau contraexpunerea versantilor (in cazul apelor de suprafata) si cu adancimea (in cazul apelor subterane unde intervine si gradientul geotermic, despre care am mai mentionat).
In cazul apelor subterane, variatiile termice sunt conditionate deci, atat cu regimul temperaturii aerului, pana la o anumita adancime, denumita zona neutra, cat si de gradientul geotermic, de la zona neutra in jos. In zona neutra, pe o anumita adancime, temperatura apei se mentine relativ constanta si are valoarea medie multianuala a regiunii respective. In preajma vulcanilor si a minelor se produc influente suplimentare asupra temperaturii apei (treapta geotermica anormala).
Un alt element care influenteaza regimul termic al apei il constituie starea de miscare a acesteia, existand diferentieri intre situatia raurilor, lacurilor, marilor si oceanelor etc.
b. Culoarea.. Apa curata este incolora, in strat subtire, dar capata o nuanta albastruie - verzuie, in straturi mai groase de 6 cm. In conditii speciale, atunci cand apa contine diferite substante dizolvate apar coloratii specifice: slab galbuie, galbuie, cafenie, laptoasa, roscata, albastra. In aceste cazuri in apa pot exista oxizi de fier, compusi ai manganului, acizi humici, substante organice, clorofila. Nu trebuie omisa nici influenta substantelor poluante artificiale care prezinta o realitate pe majoritatea cursurilor de apa din zonele populate, dezvoltate economic. Stabilirea culorii se face prin comparare cu scara colorimetrica etalon.
c. Mirosul. Apa naturala, curata, nu are miros. Anumite continuturi de substante (naturale sau artificiale) ii imprima apei si mirosuri specifice.
d. Gustul. Gustul, ca si mirosul, este incercat in general, in cazul apelor care sunt utilizate ca ape potabile. De regula apa nu are gust. Uneori apar gusturi specifice, determinate de prezenta unor substante chimice naturale sau artificiale. Cand exista un anumit gust, acesta se compara cu ceva cunoscut.
e. Turbiditatea. Este un fenomen cvasiprezent in apa si este reprezentata prin continutul de substante solide existente ca suspensii in masa de apa. Aprecierea turbiditatii se face fie prin comparatie cu o scara etalon (o evaluare aproximativa), fie prin sistemul de laborator: recoltarea unei probe - filtrare - etuvare - cantarire. Filtrul de cantareste, mai intai gol, apoi cu aluviuni. Diferenta, raportata la unitatea de volum, reprezinta turbiditatea. De exemplu: intr-o proba de 1l, diferenta intre filtrul plin si cel gol este de 0,3578 grame. Rezulta ca turbiditatea este de 0,3578 gr/l. Daca proba de apa avea 5 l turbiditatea ar fi fost:
![]()
f. Transparenta - este o proprietate a apei prin care obiectele introduse catre adancime se pot vedea pana la anumite distante. De regula se masoara cu un disc alb, cu Φ = 30 cm, numit discul Sechi.
g. Conductibilitatea electrica. Apa pura este slab conducatoare de electricitate. Apa naturala contine numeroase saruri dizolvate ceea ce o face ductila. Conductibilitatea electrica se masoara prin determinarea inversului sau, a rezistivitatii.
Conductibilitatea specifica se masoara in Ω-1 . cm-1 si are valori diferite la apa naturala fata de cea pura:
la apa naturala:
![]() deci
variabila;
deci
variabila;
la apa pura:
![]()
h. Radioactivitatea apei este o proprietate fizica pe care apa o poate primi (in anumite limite) in cazul trecerii prin zone cu roci radioactive. Se masoara in unitati Mach (U.M.) sau "emane" .
1 UM = concentratia de radium la 1 l de apa care genereaza un curent de saturatie de 0,001 unitati electrostatice.
1 UM = 3,6 "emane" = 10-3 unitati electrostatice.
Apele cu o radioactivitate mai mare de 3,5 UM/litru pot fi utilizate in scop terapeutic, cu precautiile de rigoare.
i. Densitatea apei, respectiv raportul masa/volum are valoarea 1 gr/cm3, la presiunea normala (1atm.) si la temperatura de 40C. Valorile mai exacte sunt: 0,9999 gr/cm3 la temperatura de 3,980 C, dar in mod curent circula datele rotunde. Densitatea apei lichide creste de la 00C la 40C, cand atinge valoarea maxima, apoi scade usor odata cu cresterea temperaturii.
j. Vascozitatea apei, reprezinta rezistenta pe care apa o opune la scurgere, datorita rezistentei interioare. Se noteaza cu η si variaza in functie cu temperatura. La 200 C are valoarea de 1 centipoise, reprezentand 1 / 100 poise (de la numele Poiseuille).
Vascozitatea are o importanta deosebita in utilizarea apei in anumite domenii (in special in hidraulica, hidroenergetica). Formula de calcul:
η = ![]() [kg/s/m2].
[kg/s/m2].
Se poate observa din formula, relatia dintre η si t apa.
Sub forma de gheata apa are, de asemenea, unele proprietati cu caracter de particularitate, fata de celelalte stari de agregare.
cristalizeaza in sistem hexagonal;
la presiune normala, are punctul de topire de 00C;
masa specifica =0,917 gr/cm3;
la limita de topire /inghetare, caldura latenta = 79,55 kcal/kg;
caldura specifica sub presiune constanta = 0,5 kcal/kg/grad;
rezistenta la rupere, prin incovoiere = 20 kg/cm2;
rezistenta la forfecare = 10 kg /cm2;
prezinta plasticitate.
Formele solide ale apei din natura sunt diferite: gheata, firn, zapada, chiciura, bruma, grindina, cristali de gheata etc.
 La temperatura de 100 0C (presiune
normala = 760 mm Hg) apa trece in stare de vapori, marindu-si volumul de 1651
ori. In stare de vapori apa reduce transparenta aerului, iar procesele naturale
de evaporare se estompeaza.
La temperatura de 100 0C (presiune
normala = 760 mm Hg) apa trece in stare de vapori, marindu-si volumul de 1651
ori. In stare de vapori apa reduce transparenta aerului, iar procesele naturale
de evaporare se estompeaza.
Presiunea vaporilor creste odata cu temperatura.
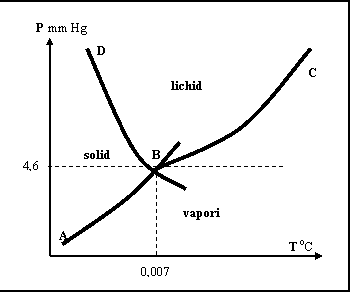
In Fig.nr. 1. se prezinta un grafic complex care cuprinde particularitatile trecerii apei prin cele trei stari de agregare si unele proprietati specifice fiecarei stari, sau treceri intre stari.
Figura nr. 1. Graficul trecerii apei prin cele trei stari de agregare
Din grafic se constata:
separarea intre fazele lichida si solida se face pe un ecart mic de temperatura. Linia B-D este putin inclinata fata de ordonata;
curbele care separa presiunea de vapori a ghetii fata de aer (A-B), respectiv a fazei lichide fata de aer (B-C), pun in evidenta ecarturi mari de temperatura. Explicatia consta in miscarea moleculelor de apa, care fac ca numai anumite particule sa treaca din starea lichida sau solida in cea gazoasa. Procesele de evaporare se fac diferentiat.
In punctul B, cu coordonate: P=4,6 mm Hg, T=0,007 0C cele 3 stari (gheata, lichid, gaz) coexista, in echilibru.
Desi este foarte raspandita in natura, apa prezinta cateva particularitati, care o deosebeste de celelalte substante si care adesea se prezinta ca niste anomalii
a. Densitatea apei
Variaza in raport cu temperatura, in limite mai largi decat alte substante. Densitatea maxima se intalneste la temperatura de 3,980 C si este de 0,9999 gr/cm3 (se considera 1,00 ). La temperaturi cuprinse intre 40 si 00 C, precum si la temperaturi mai mari de 40 C, densitatea apei scade progresiv. Exista o diferenta semnificativa intre densitatea ghetii la 00 (0,9168 gr/cm3) si densitatea apei la 00. In stare solida, sub 00 C se stabilesc legaturi rigide, cu structura hexagonala, lasand anumite spatii libere, care fac ca gheata sa pluteasca in apa. Cu cresterea temperaturii legaturile se desfac, iar la 400 C, majoritatea sunt distruse. Structura cristalina dispare. Acesta este al doilea punct de topire al apei (Gh.Brezeanu si Al.Simion-Gruita, 2002).
Densitatea apei variaza si in functie de continutul de saruri dizolvate: la salinitate 0 - densitatea apei este 1,00, la salinitate de 10 mg/l, densitatea este de 1,008 gr/cm3, iar la concentratia medie a apei de mare (35 0/00, densitatea este de 1,028 gr/cm3.
b. Caldura specifica respectiv, cantitatea de caldura necesara pentru cresterea temperaturii unui gram de apa cu 10 (exprimata in calorii) este foarte mare (1 cal/gr), fiind depasita numai de cateva substante: amoniac lichid (1,23), hidrogen lichid (3,4) si litiu. La celelalte substante caldura specifica se situeaza in jurul valorii de 0,2 cal/gr si acest fapt scoate in evidenta o particularitate - anomalie a apei.
Caldura specifica mare, alaturi de coductibilitatea termica, de asemenea ridicata a apei confera hidrosferei rolul de conservare termica si de reglator al climei.
c. Alte anomalii le reprezinta temperatura latenta de vaporizare si temperatura de topire a ghetei, care sunt mult mai mari decat la alte substante. Datorita consumului foarte mare de caldura necesar pentru evaporarea lor, apele ecosistemelor terestre nu se supraincalzesc.Temperatura naturala a apei nu depaseste, de regula, 40 0C.
d.Temperatura de solidificare a apei este ridicata, fapt ce are o mare importanta, in special, pentru activitatea biologica, destul de activa la 00 C si practic, inexistenta la temperaturi foarte scazute. Gheata care pluteste deasupra apei reprezinta si un bun izolator termic. Sub gheata viata poate continua, in limite inca destul de largi.
e. Tensiunea superficiala a apei este mare, fapt ce face ca picaturile de apa sa aiba in general forma rotunda.
f. Vascozitatea mica a apei prezinta deplasarea usoara a hidrobiontilor.
g. Apa este un solvent universal, datorita structurii sale moleculare. In general sunt mai solubili compusii care au in alcatuirea lor grupari puternic polarizate ca - OH; -COOH, NH2; -HSO3, care atrag moleculele de apa. Substanta dizolvata nu se amesteca pur si simplu cu solventul, ci se stabilesc anumite corelatii in functie de structura si proprietatile solvitului.
Proprietatile chimice ale apei.
Valorificarea complexa a apei in numeroase domenii de activitate impune cunoasterea obligatorie a propretatilor sale chimice, cu atat mai mult cu cat unele dintre directiile de utilizare se refera la alimentarea populatiei sau la mijloace terapeutice.
Pentru gospodarirea si utilizarea resurselor de apa se aplica prevederile STAS, care precizeaza limitele normale si maxime in care sunt admise anumite concentratii in apa utilizata.
Monitorizarea starii de calitate a apei se face prin recoltarea probelor si a analizarii acestora in laboratoare autorizate unde sunt determinati numerosi indicatori chimici.
Principalii indicatori de calitate ai apei sunt:
a. Rezidiul fix care reprezinta totalitatea substantelor solide minerale si organice continute in apa. Se determina prin incalzirea apei la 105 0C, evaporarea acesteia si cantarirea continutului solid. Se exprima in mg/l.
b. Duritatea apei. Acest indicator este reprezentat prin continutul de saruri de calciu si magneziu aflate in solutie si se exprima in grade de duritate. In practica mondiala se folosesc gradele germane, franceze sau engleze (la noi - gradele germane). Un grad de duritate reprezinta 10mg CaO sau 1,42 MgO la 1 litru de apa.
1 grad german = 17,9 grade franceze = 1,25 grade engleze.
In functie de duritate, apele naturale se clasifica in:
ape foarte moi 00 - 40 (grade germane)
ape moi 40 - 80 "
ape semidure 80 - 120 "
ape destul de dure 120 - 180 "
ape dure 180 - 300 "
ape foarte dure peste 300 .
In cazul apei potabile, duritatea nu trebuie sa depaseasca 120.
Duritatea apei este de trei feluri: totala (suma tuturor sarurilor), permanenta (care nu dispare prin fierbere) si temporara (diferenta dintre celelalte doua). Duritatea temporara este determinata de continutul de bicarbonati care, prin fierbere, pierd bioxidul de carbon si se precipita sub forma de carbonati insolubili care nu mai reprezinta duritate .
Duritatea mare a apei are unele implicatii negative: produce pietre la rinichi (la apa potabila), nu face clabuci cu sapun (la curatatorii si spalatorii), se depune pe cazane si conducte (la instalatii de racire, conducte, cazane de aburi), impiedica fierberea unor alimente (fasole).
c. Aciditatea apei este capacitatea unor substante din continut de a lega chimic o cantitate echivalenta de baze tari.
Este data de continutul de anioni, care pot fi echilibrati cu ioni de hidrogen, sau cu cationi de baze slabe. Aciditatea se exprima prin pH, care reprezinta inversul concentratiei ionilor de hidrogen.
Determinarea pH se face cu pH - metrul sau cu substante indicatoare. In practica, cunoasterea pH este necesara pentru stabilirea masurilor anticorozive (stabilirea dozelor de neutralizanti) sau pentru asigurarea parametrilor optimi pentru epurarea biologica si pentru supravegherea calitatii apelor naturale.
In functie de pH apele pot fi considerate acide (Ph< 7), neutre (pH = 7) sau alcaline (Ph >7).
d. Agresivitatea este propietatea unor ape de a ataca chimic, cu caracter continuu, materialele prin care circula sau cu care vin in contact (cazane, conducte, betoane, instalatii etc).
Agresivitatea apei este data de continutul de saruri, acizi, de circulatia si de temperatura acesteia. In lipsa sarurilor, agresivitatea este reprezentata si prin continutul de gaze dizolvate (O2 , CO2).
Odata cu dezvoltarea civilizatiei (si in special a industriei, agriculturii chimizate, a aglomerarilor poluate etc.) majoritatea apelor au un continut chimic alterat de fenomenele de poluare. Ca urmare, monitorizarea calitatii apei a devenit obligatorie atat pentru apele naturale (pentru comparatie ) cat si pentru cele poluate (pentru identificarea situatiilor critice). Dupa cum am mai aratat, buletinele de analiza chimica evidentiaza continutul din apa a numeroase substante mai mult sau mai putin nocive.
In aceasta gama larga de elemente identificate in apa, se evidentiaza categorii de indicatori care, fiecare in parte, isi au imprtanta lor.
a. Indicatorii de oxigen (I.0) arata continutul de oxigen din apa (indispensabil vietii) si contnutul de substante organice. Acestia sunt: O2 (oxigenul dizolvat), CBO5 respectiv consumul biochimic de oxigen la 5 zile, CCOMn si KCrO4 (ambele arata consumul de oxigen necesar pentru reducerea substantelor organice existente in apa);
b. Indicatorii de toxicitate (I.T.S.) care exprima continutul de substante toxice din apa : cianuri, fenoli, petrol, azotiti etc.;
c. Indicatorii de mineralizare (I M.) care exprima continutul total de substante minerale din apa. Sunt reprezentati prin rezidiul fix, respectiv sulfati, carbonati, cloruri, azotati etc.;
d. Metale grele. Desi nu sunt grupate intr-o categorie anume de indicatori, metalele prezinta o importanta deosebita in caracterizarea starii de poluare a apei. Acestea sunt: Fe, Mn, Cu, Zn, Cr, Pb etc.
Proprietatile organoleptice, biologice si bacteriologice ale apei
Apele constituie un mediu foarte favorabil vietii, iar bogatia si varietatea speciilor depinde de caracteristicile corpurilor acvatice.
In general sunt deosebiri intre apele curgatoare si cele statatoare sau subterane, in ceea ce priveste conditiile de viata.
In apele curgatoare traiesc anumite specii de plante si animale adaptate la diferitele conditii de viteza, temperatura, continutul de oxigen, turbiditate etc.
In lungul unui rau exista de asemenea, sectoare cu caracteristici deosebite (sector montan, de podis, de campie), deci conditiile de viata sunt mai variate decat intr-un lac. Din cauza vitezei mai mari, multe organisme sunt adaptate la conditiile de pe fundul albiilor (bentonice) unde se pot fixa sau adaposti mai bine. Organismele planctonice rezista mai greu (sau deloc in rauri), dar ele se gasesc in numar mai mare in lacuri si in ochiurile de apa din mlastini.Tot in lacuri, la adancime mai mare, conditiile de oxigenare a apei sunt mai precare, apar si gaze sulfuroase sau CO2, fapt ce permite dezvoltarea unor organisme adaptate .
Proprietatile organoleptice ale apei reprezinta un ansanblu de conditii de viata pe care mediile acvatice le ofera organismelor vii si care impun adaptarea acestora. Aceeasi situatie este si in mari si oceane cu deosebire ca aici (ca si in lacurile foarte adanci) la adancimi mai mari de 200m, posibilitatile de viata se reduc foarte mult.Valurile si curentii marini introduc mari variatii in caracteristicile organoleptice ale apei.
Din punct de vedere igienic caracteristicile de calitate ale apelor se determina prin analize biologice si bacteorologice
Analiza biologica stabileste componenta calitativa si cantitativa a populatiei din apa si identifica posibile impurificari si intensitatea acestora .
Analiza bacteriologica urmareste existenta bacteriilor din apa. Principalele grupe de bacterii sunt:
bacterii coliforme provenite din ape uzate de canalizare si din sol;
bacterii patogene, care provoaca boli hidrice ca: febra tifoida, dizenteria etc.
bacterii saprofite care fac parte din microflora normala a apei si nu produc imbolnaviri.
Apa grea
Uneori in natura se gaseste si apa cu greutate moleculara mai mare de 18, numita apa grea. Apa grea, are greutatea moleculara 20, datorita faptului ca izotopul greu al hidrogenului, numit deuteriu are masa de 2,0147 si prin combinare cu oxigenul conduce la o masa moleculara mai mare.
Apa grea are o raspandire redusa in natura. Se gaseste, in cantitati foarte mici in lichidele apoase ale tesuturilor vegetale si animale, in apa de cristalizare, ploaie, in cea rezultata din topirea ghetii si in apa de mare. Proportia in care apa grea se gaseste in natura, comparativ cu celelalte forme de apa, este 1: 6000, iar proprietatile ei fizico- chimice difera putin de cele ale apei normale: formula D2O, in loc de H2O, densitatea 1,107 in loc de 1,00, densitatea maxima la temperatura de 11 0C in loc de 4 0C, punct de topire 3,82 0, in loc de 0 0C, punct de fierbere 101,42 0C, in loc de 100 0C, greutatea atomica 2,017 in loc de 1,00, greutatea moleculara 20, in loc de 18, constanta dielectrica 81,5, in loc de 80,75.
Apa plata
Inca nu este pe deplin lamurit termenul de apa plata, dar de un timp, aceasta este tot mai des utilizat. Uneori apa izvoarelor contine, dupa caz, gaze din aer, substante solide, suspensii solide etc. Cel mai frecvent contine bicarbonat de calciu, care da apei duritate.
Pe de alta parte, intre apele de suprafata, cele subterane si vaporii de apa din atmosfera, exista legaturi permanente de interdependenta, mai slabe sau mai stranse.
Toate aceste elemente conduc uneori la situatii de mineralizare a apei in anumite conditii si atunci se poate vorbi despre apa plata ca fiind o apa minerala naturala necarbogazoasa, care la emergenta si dupa conditionare (conform art. 7 din norme) nu contine bioxid de carbon in proportie superioara cantitatii necesare pentru mentinerea in stare dizolvata a sarurilor hidrogencarbonatate din compozitia lor, dar nu mai mult de 250 mg/l. (Cf. Monitorului Oficial al Romaniei, Partea I, nr. 495/23.08.2001).
Apa plata este deci o apa minerala naturala, fara exces de CO2 .
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 12592
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2025 . All rights reserved