| CATEGORII DOCUMENTE |
| Alimentatie nutritie | Asistenta sociala | Cosmetica frumusete | Logopedie | Retete culinare | Sport |
Principalele componente proteice ale tesutului conjunctiv
Colagenul este proteina fibrilara constituent major al tesutului conjunctiv animal: tendoane, cartilaje, oase, dinti, vase de sange, piele. Procentul de colagen din tesuturi este variat: 40 % in ficat, 50 % in cartilaje, 74 % in piele, 64 % in cornee, 23 % in oase etc.
Modelul pe care il prezinta aceasta proteina confera posibilitatea executarii unor activitati ca alergarea, saritul, care exercita un stres major asupra articulatiilor si scheletului.
In tesuturile mamiferelor au fost evidentiate mai mult de 30 de tipuri de colagen, diferite ca structura si functii (Tabel 8).
Compozitia in aminoacizi il face unic si este esentiala pentru proprietatile sale. Aproape un reziduu din trei este glicocol, are si un continut crescut de prolina. Mai contine aminoacizi nonstandard: hidroxiprolina, hidroxilisina. Sinteza acestora se realizeaza prin hidroxilarea resturilor de prolina si lisina ulterior sintezei catenei polipeptidice, in prezenta vitaminei C, a oxigenului, ionilor Fe2+ si a unor hidroxilaze.
In colagen se intalnesc secvente de tipul Gly-X-Pro sau Gly-X-HOPro, unde X este un rest de alt aminoacid.
Tabel 8 Tipuri de colagen si localizarea acestora in tesuturi
|
Tip de colagen |
Localizare |
|
Colagen I |
Oase, dinti, piele |
|
Colagen II |
Cartilaje |
|
Colagen III |
Vase de sange, tesut conjunctiv moale |
|
Colagen IV |
Membrane bazale |
|
Colagen V |
Artere |
|
ColagenVI |
Rinichi, placenta, aorta |
Unitatea de baza a colagenului este tropocolagenul format din trei lanturi polipeptidice superincolacite (catene α identice sau diferite), fiecare cu aproximativ 1000 aminoacizi (Fig.12).
Catenele din tropocolagen nu pot forma structuri precum -helix si planuri pliate , deoarece au un continut crescut de aminoacizi care destabilizeaza sau rup aceste conformatii (glicocol, prolina, hidroxiprolina). Ele formeaza o structura specifica denumita triplu helix, in care fiecare din cele trei catene spiralate interactioneaza cu celelalte Triplul helix este mai relaxat decat -helixul si este stabilizat prin legaturi de hidrogen intre glicocolul de pe un lant si prolina de pe alt lant.
Impachetarea stransa a lanturilor din triplu helix ii confera o rezistenta la tensiune mai mare decat cea a unei sarme de otel cu aceeasi grosime.
In cazul colagenului de tip I, II si III, catenele triplu elicoidale formeaza fibrile de colagen, ansambluri supramoleculare in care moleculele de tropocolagen sunt asociate in mod diferit. Catenele α si moleculele de tropocolagen din fibrile sunt stabilizate prin legaturi incrucisate intre resturi de lisina si hidroxilisina, intramoleculare si intermoleculare. Natura si numarul legaturilor depinde de varsta si de functionalitatea tesutului. Colagenul tanar nu este mult incrucisat si este solubil. La animalele varstnice este insolubil, deoarece prezinta mai multe legaturi incrucisate si este mai putin flexibil. Pierderea flexibilitatii articulatiilor cu varsta se poate datora cresterii numarului de legaturi incrucisate.
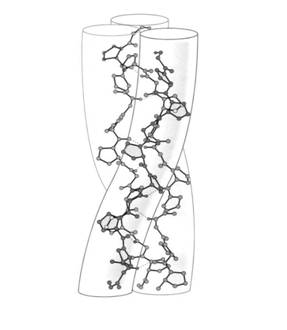
Fig.12. Reprezentarea schematica a tropocolagenului
(dupa Garrett R.H. si Grisham C.M., 1995)
Studiile de microscopie electronica au evidentiat aranjamentul repetitiv cap-coada al helixului, ce prezinta din loc in loc regiuni "goale" (hole zone) (Fig.13). In aceste regiuni se pot lega fie catene glucidice ce interactioneaza cu hidroxilisina prin glucoza sau galactoza si care au rol in asamblarea fibrilei fie microcristale de hidroxiapatita pentru mineralizarea osului, dintilor.
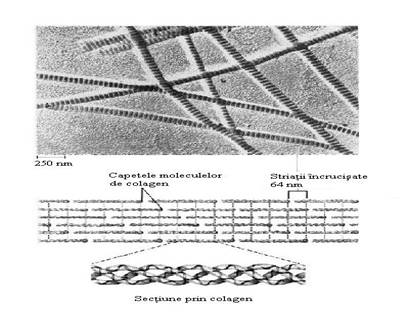
Fig.13. Imagine electronomicroscopica a fibrilelor de colagen
Colagenul este un bun model de studiu al efectelor imbatranirii asupra proteinelor din organism. Se cunosc o serie de boli caracterizate de anomalii ale metabolismului colagenului. Scorbutul, boala ce aparea datorita absentei vitaminei C, se caracteriza prin sinteza defectuoasa a colagenului si, de aceea, prin fragilitate capilara, descuamarea tegumentului. Unele boli genetice, caracterizate prin hiperextensibilitatea articulatiilor sau osteogenesis imperfecta (formarea anormala a oaselor la copii), sunt determinate de absenta unor enzime implicate in formarea colagenului, rezultand o structura mai relaxata.
Colagenul din tesuturi se poate reinnoi dupa un timp variabil pentru diferitele organe, viteza de reinnoire accelerandu-se in anumite conditii (vindecarea leziunilor, involutia uterului dupa nastere).
Degradarea colagenului se face enzimatic sub actiunea colagenazelor cu formare de peptide si hidroxiprolina libera. Hidroxiprolina este transportata la ficat pentru metabolizare sau, o mica parte, eliminata prin urina, fiind un marker de diagnostic pentru diverse afectiuni caracterizate prin degradarea exagerata a colagenului (de exemplu, afectiuni osoase) sau prin procese de fibroza.
Gliconjugati
Ozele si derivatii acestora (aminozaharuri sau ozamine, acizi uronici) sunt folosite de celule si pentru sinteza unor glucide complexe (gliconjugati) ce indeplinesc functii biologice specifice.
Glicozaminoglicani
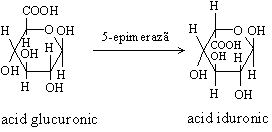
Glicozaminoglicanii (GAG) sunt polizaharide neramificate formate din unitati repetitive dizaharidice din care una este intotdeauna o ozamina (glucozamina sau galactozamina) iar cealalta un acid uronic (cu exceptia unui singur glicozaminoglican), acid glucuronic sau acid iduronic. Moleculele pot sa contina grupe sulfat legate esteric la oxigen sau la azot. Acizii glucuronic si iduronic sunt izomeri.
Se cunosc mai multi glicozaminoglicani:
Acid hialuronic
Condroitin sulfati (4-sulfat si 6-sulfat)
Keratan sulfati I si II
Dermatan sulfati
Heparina
Heparan sulfatul
Acidul hialuronic (din limba greaca, hyalos = sticla) se gaseste in lichidul sinovial, umoare vitroasa, tesutul conjunctiv lax. Contine aproximativ 50000 resturi de acid glucuronic si N-acetilglucozamina legate β1,3-glicozidic (cel mai lung glicozaminoglican). Este singurul glicozaminoglican care nu contine grupe sulfat si nu se leaga de proteina. Formeaza solutii clare, vascoase ce lubrefiaza articulatiile si dau aspectul gelatinos umorii vitroase. Contribuie la elasticitatea si rezistenta la intindere a tendoanelor alaturi de late componente ale matricei extracelulare. El poate forma insa arhitecturi moleculare "gigant" prin asamblare cu proteoglicani continand cu precadere condroitin sulfati. Legaturile glicozidice ale acidului hialuronic pot fi hidrolizate de catre hialuronidaza bacteriana, ceea ce duce la alterarea capacitatii de filtru selectiv a substantei fundamentale si la expunerea tesuturilor la invazia bacteriana. Hialuronidaza se mai gaseste in sperma cu rolul de a permite penetrarea ovulului.
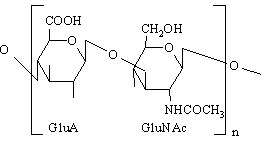
Condroitin sulfatii (4-sulfat sau 6-sulfat) se gasesc in cartilaje, oase, cornee (in limba greaca chondros=cartilaj). Sunt glicozaminoglicani mai mici care pot sa formeze cu acidul hialuronic si cu proteinele agregate mari in tesutul conjunctiv (de exemplu, agrecan). Contin acid glucuronic, N-acetilgalactozamina 4-sulfatata sau 6- sulfatata legate β1,3-glicozidic. Se leaga prin legaturi xiloza-serina de proteine. Contribuie la rezistenta la intindere a cartilajelor, tendoanelor, ligamentelor, peretilor aortei.
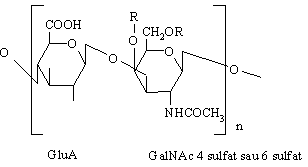 R = -SO3H
R = -SO3H
Keratan sulfatii I si II (in limba greaca keras=corn). Keratan sulfatul I este legat de asparagina si se gaseste in cornee iar keratan sulfatul II formeaza legatura O-glicozidica cu treonina si este intalnit in tesutul conjunctiv. Se mai gasesc in structurile cornoase: coarne, par, copite, unghii, gheare. Contin N-acetilglucozamina si galactoza legate 1,3-glicozidic. Nu au acizi uronici.

Heparina (in limba greaca hepar=ficat) contine glucozamina N-sulfatata si mai putin acetilata, acid glucuronic si acid iduronic (predominant). Se gaseste in mastocite, ficat, plaman, piele. Este cel mai electronegativ glicozaminoglican. Are proprietati anticoagulante folosindu-se in forma pura pentru recoltarea probelor de sange.
Heparan sulfatul contine glucozamina mai putin N-sulfatata si, mai ales, acid glucuronic. Se gaseste in fibroblasti, peretii vaselor. Este component al membranelor bazale, sinapselor.
Dermatan sulfatul (in limba greaca derma=piele) contine acid iduronic si N-acetil-galactozamina. Este larg raspandit in tesuturi (piele, vase de sange, valve cardiace carora le asigura elasticitatea).
Glicoconjugati
Glicoconjugatii (glucide complexe) includ trei clase de compusi care contin unul sau mai multe lanturi oligozaharidice legate covalent de o componenta proteica (glicoproteine si proteoglicani), de una lipidica (glicolipide) sau unite prin catene oligopeptidice (peptidoglicani). Ei indeplinesc in organisme functii biologice importante: intervin in medierea interactiilor celula-celula, adeziunii celulare, migrarii celulare in timpul dezvoltarii, raspunsului imun, vindecarii ranilor si in mecanismele moleculare care stau la baza diferitelor afectiuni.
Proteoglicani
Sunt structuri macromoleculare formate din proteine ce contin legati covalent glicozaminoglicani. Proteinele reprezinta miezul la care se ataseaza unul sau mai multe lanturi de glicozaminoglicani. Componenta glicozaminoglicanica este responsabila pentru activitatea biologica a proteoglicanilor. Continutul in glucide al unui proteoglican este mai mare decat la alti glicoconjugati putand ajunge pana la 95% din masa moleculara. Proteoglicanii se deosebesc unii de altii prin secventa proteinei, precum si prin tipul, profilul modificarilor biochimice, numarul si lungimea glicozaminoglicanilor atasati.
Proteoglicanii continand condroitin sulfati se asociaza prin intermediul unor proteine de legatura cu acidul hialuronic, formand agregate supramoleculare de dimensiuni foarte mari (circa 100 molecule de proteoglicani per molecula de acid hialuronic), cu masa moleculara de ordinul sutelor de milioane (Fig.5.11). Proteina din miezul agrecanului este una dintre cele mai mari proteine avand masa moleculara de 250-300 kDa.
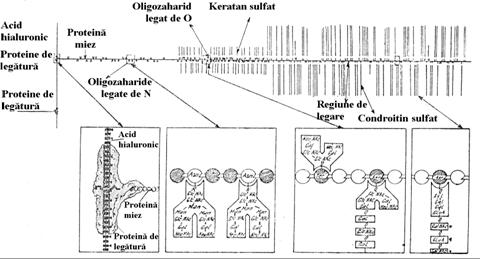
Reprezentarea schematica a unui agregat proteoglicanic
Proteoglicanii sunt componente majore ale suprafetelor celulare si matricei extracelulare (substanta fundamentala) in asociere cu unele componente ale acesteia: colagenul, elastina, proteine de adeziune ca laminina si fibronectina (Fig.5.12). Se gasesc din abundenta in tesutul conjunctiv intr-o mare varietate de forme cu compozitie si localizare diferite (tabel 5.2).
Unele proteine ale matricei sunt poliadezive, au situsuri de legare pentru multe alte componente (de exemplu, fibronectina are domenii separate ce leaga fibrina, heparan sulfatul, colagenul si integrinele, proteine ce mediaza semnale intre interiorul si exteriorul celulei).
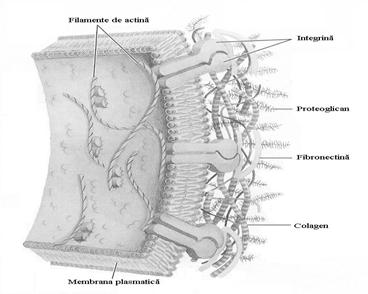
Fig.5.12 Asocierea componentelor matricei extracelulare
(dupa Nelson D.L. si Cox M.M., 2000)
Functiile biologice ale proteoglicanilor sunt importante:
Datorita glicozaminoglicanilor care sunt polianioni, proteoglicanii atrag cationii (sodiu, potasiu) sau policationii (anumite proteine cu caracter bazic) favorizand hidratarea tesuturilor in care se gasesc;
Functioneaza ca site moleculare;
Permit migrarea celulara in timpul morfogenezei si vindecarii ranilor (acidul hialuronic);
Contribuie la mentinerea formei neuronilor si confera transparenta corneei ;
Heparina are proprietati anticoagulante. Se leaga de factorii IX si X dar si de antitrombina III plasmatica pe care o activeaza in inhibarea trombinei;
Mediaza cresterea celulara;Intervin in semnalizarea celulara (proteoglicanii din matricea extracelulara sunt esentiali pentru raspunsul celulei la anumiti factori de crestere (de exemplu, heparan sulfatul din sindecan este prima tinta de care se leaga factorul de crestere fibroblastica, fibroblast growth factor, FGF).
Biosinteza proteoglicanilor debuteaza cu formarea proteinei centrale. Ulterior, un tetraholozid particular (GlcAc-Gal-Gal-Xyl) este grefat pe resturi de serina din proteina prin legaturi intre xiloza si grupa -OH. Catenele de glicozaminoglican sunt apoi polimerizate. Sinteza proteoglicanilor necesita actiunea coordonata a unor enzime extrem de specifice: transferaze, epimeraze, sulfotransferaze localizate in membrana reticulului endoplasmic si aparatul Golgi.
Sinteza incepe prin atasarea alternata a doi precursori activati:
UDP-GlcAc si UDP-GlcNAc pentru acid hialuronic, heparan sulfat si heparina;
UDP-GlcAc si UDP-GalNAc pentru condroitin sulfati si dermatan sulfat;
UDP-Gal si UDP-GlcNAc pentru keratan sulfat.
Urmeaza o multitudine de reactii biochimice (N-dezacetilari, N- si O- sulfatari, epimerizari) prin care se modifica cele doua oze constitutive ale motivului de baza.
Au durata de viata mare (zile, saptamani), pentru degradarea proteoglicanilor fiind necesare: a) enzime extracelulare:
pentru partea proteica
catepsine
![]() endoglicozidaze
endoglicozidaze
exoglicozidaze pentru glicozaminoglicani
exosulfataze
b) enzime lizozomale care definitiveaza scindarea in interiorul celulei.
Modificari cantitative sau calitative ale proteoglicanilor stau la baza a numeroase afectiuni genetice sau dobandite precum: degenerescenta cartilajului, osteoartrite, nefropatia diabetica, ateroscleroza, procesele tumorale, maladia Alzheimer.
S-au descoperit boli genetice caracterizate de acumularea glicozaminoglicanilor in tesuturi (datorita unor deficite enzimatice denumite mucopolizaharidoze dar boli caracterizate de acumularea altor glicoconjugati: maladia Tay Sachs (deficit de acetilhexozaminidaza), sindromul Hunter (deficit de iduronat sulfataza), sindrom Hurler (deficit de hialuronidaza) (Tabel 5.3).
Proteoglicanii se folosesc pentru tratamentul osteoartritelor, trombozelor, al unor tulburari oftalmologice, etc.
Principalele clase de proteoglicani
|
PG extracelulari |
Agrecan (PG-H) |
Formeaza agregate cu acidul hialu ronic (HA) |
100lanturi CS 100lanturi KS |
Cartilaj, tendon |
Hidratare (10 ml/g) Rezistenta la compresiune |
|
PG agregate interstitiale |
Verzican (PG-400) |
Structura versatila |
lanturi CS/ DS |
Fibroblaste (piele, vase sanguine) |
Rezistenta vaselor sangvine la compresiune |
|
Neurocan |
Tesut nervos |
CS |
Tesut nervos |
Conexiune intre neuroni si HA Migrarea axonilor |
|
|
Brevican |
Structura scurta |
CS sau alt GAG |
Tesut nervos |
Necunoscut |
|
|
PG interstitiali mici |
Decorina (PS-S2, PG-II, PG-40) |
Decoreaza fibrilele de colagen |
1 lant CS sau DS |
Ubiquitar |
Fibrilogeneza colagenului Modularea TGFb |
|
Lumican |
Transparenta corneei |
Mai multe lanturi KS |
Cornee, valve cardiace |
Transparenta corneei |
|
|
PG membranei bazale |
Perlecan |
Aspectul unui colier de perle |
3-4 lanturi HS |
Membrane bazale |
Permeabilitate selectiva |
|
PG membranari |
Sindecani 1 - 4 |
Grec. Syndein = "mentinerea ansamblului Fibroblaste |
3-4 lanturi HS si 2 lanturi CS/DS |
Ubiquitar |
Reglarea biodisponibilitatii, stabilitatii si activitatii citokinelor |
|
b-glican |
Legaturi cu TGF-b |
2 lanturi HS si CS |
Ubiquitar |
Receptor pentru TGF-b, activeaza/ inhiba fixarea TGF-b pe alti receptori proteici |
|
|
PG ancorati la inozitoli |
Cerebroglican |
Localizare exclusiv cerebrala |
5 situsuri potentiale de atasare a lanturilor HS |
SNC |
Migrarea neuronilor in cursul dezvoltarii |
|
PG intracelulari |
Serglicina |
Repetitii Ser-Gly in miezul proteic |
10-15 lanturi HS sau CS |
Mastocite |
Stocarea/ elibera-rea mediatorilor mastocitari |
Afectiunea |
PG implicat |
Explicatii biochimice |
Consecinte biologice |
|
Mucopoli-zaharidoze |
GAG sulfati |
Deficit in enzimele implicate in catabolizarea GAG in lizozomi |
Acumularea celulara si tisulara de GAG nedegradati |
|
Degenerescente si distrofii ale cartilajului |
Agrecan |
Modificari ale metabo-lismului agrecanilor |
Acumularea unor agregate incorecte, raspuns sensibil la agresiuni |
Ateroscleroza |
Versican |
Cresterea productiei de proteoglicani bogati in condroitinsulfat (exceptand versicanul) |
Interactiune LDL-condroitin sulfat, cu diminuarea captarii LDL in celule |
|
Distrofia corneeana maculara |
Lumican |
Absenta sulfatarii cate-nelor de KS |
Precipitarea lanturilor in reteaua colagenica din cornee (opacitate progresiva) |
Procese tumorale |
Sindecan Perlecan |
Modificarea structurii lanturilor de HS Digestia lanturilor de heparansulfati |
Cresterea capacitatii metastatice pentru celulele tumorale Disparitia barierei reprezentata de lamina bazala, extravazarea celulelor tumorale |
|
Maladia Alzheimer |
Perlecan |
Modificarea gradului de sulfatare a lanturilor de heparan sulfat |
Protectia peptidului Ab Nucleatia placilor |
Glicoproteine
Glicoproteinele sunt conjugati intre glucide si proteine ce se gasesc la toate organismele, de la virusurile animale pana la om. Componenta glucidica poate sa varieze intre 1-85% din greutatea moleculara fiind mai variata structural decat in alti glicoconjugati.
Numarul de lanturi poate varia intre 1 si 30.
Catena oligoglucidica poate contine cel putin 2-3 unitati glucidice, oze sau derivati ai acestora: galactoza, glucoza, manoza, acizii sialici (acizii N-acetil neuraminici), fucoza, N-acetilglucozamina, N-acetil galactozamina, xiloza.
Acidul N-acetil neuraminic se gaseste mai ales la capatul lantului legat, cel mai adesea, de galactoza sau N-acetil-galactozamina.
Glicoproteinele pot fi impartite in doua clase in functie de natura legaturii dintre lantul polipeptidic si lantul oligoglucidic (Fig.5.13):
glicoproteine care contin o legatura O-glicozidica intre un rest de serina sau treonina din lantul polipeptidic si N-acetil galactozamina sau, mai rar, o legatura intre un rest de hidroxilizina si galactoza sau intre serina si xiloza;
glicoproteine ce contin o legatura N-glicozidica intre un rest de asparagina si N-acetil glucozamina. Unele oligoglicoproteine pot sa contina atat legaturi N-glicozidice cat si O-glicozidice.
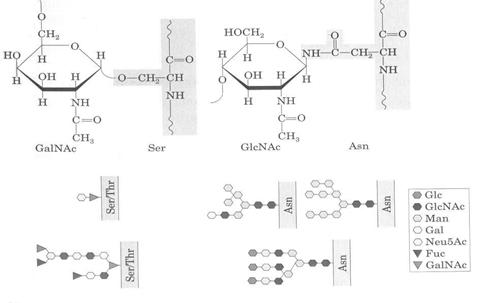
Fig.5.13 Tipuri de legaturi in glicoproteine (dupa Nelson D.L. si Cox M.M., 2000)
Functiile glicoproteinelor sunt extrem de variate:
Rol structural: colagenul, elastina, fibrina, proteinele din matricea osoasa;
Agenti protectori sau cu rol in lubrifiere: mucina, mucusul;
Rol de transport al diferitelor substante (ioni, hormoni, produsi de catabolism);
Rol imunologic: imunoglobulinele, interferonul , antigenele de histocompatibilitate;
Rol hormonal: hormonul tireostimulator (TSH), gonodotropina corionica umana, hormonul foliculostimulator (FSH) etc;
Enzime: proteaze, glicozidaze, nucleaze, factori de coagulare;
Rol in recunoasterea si interactiunea celula-celula, bacterie-celula (receptori celulari);
Roluri specifice (de exemplu, proteinele anti freeze din sangele pestilor din Antarctica);
Rol in purificarea si analiza glicoproteinelor: lectinele (din plante).
Procesul de biosinteza a glicoproteinelor O-glicozidice decurge in prezenta unor enzime din ribozomii aflati in apropierea membranei, denumite glicoproteinglicozil transferaze, care transfera pas cu pas resturile glicozil activate. Glucidele sunt activate de nucleotid polifosfati pentru a putea reactiona ca sa formeze lantul oligoglucidic: UDP-glucoza, UDP-galactoza, UDP-manoza, GDP-fucoza, CMP-Nana, UDP-GlcNAc, UDP-GalNAc. Datorita legaturii macroergice, compusii sunt activi si pot fi transferati acceptorilor potriviti. Sinteza acestor compusi se realizeaza in citoplasma, fiind apoi transportati de proteine transportoare in aparatul Golgi unde se desfasoara glicozilarea proteinelor.
Biosinteza glicoproteinelor cu legaturi N-glicozidice necesita prezenta unui intermediar cheie: oligoglucid pirofosforil dolicholul (oligoglucid-P-P-Dol).
El se formeaza prin atasarea glucidelor din lantul oligoglucidic sub forma activata la dolicholul fosforilat in prezenta dolichol kinazei.
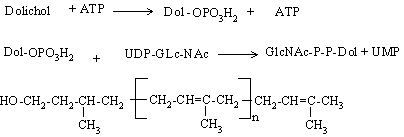
Se continua atasarea resturilor de glucid pana ce se formeaza oligoglucid-pirofosforil dolicholul:
![]()
Procesul de glicozilare se desfasoara in reticulul endoplasmatic rugos sau aparatul Golgi.
Ratiunea biologica pentru care se formeaza glicoproteinele nu este pe deplin cunoscuta. Cert este ca atasarea catenelor oligoglucidice altereaza polaritatea moleculelor proteice si solubilitatea acestora, influenteaza plierea moleculelor proteice nou sintetizate, contribuie la protejarea unor proteine fata de enzimele degradative.
Glicolipide
Glicolipidele sunt compusii care contin catene oligoglucidice atasate covalent de lipide membranare: gangliozidele din celulele eucariote, lipopolizaharidele din membrana celulara a bacteriilor gram negative (Escherichia coli, Salmonella typhimurium).
Glicolipidele de tip gangliozide sunt compusi ce contin trei sau mai multe resturi de glucide legate de un lipid, unul dintre acestea fiind N-acetilgalactoza sau acidul sialic (acid N-acetilneuraminic). Au functii importante: sunt prezente in cantitati foarte mici in membrana, intra in structura lipidelor de suprafata fiind implicate in recunoasterea celulara si imunitate (receptori pentru hormoni, anticorpi, antigene, interferon, virusuri). Sunt markeri ai grupelor sanguine. Gangliozidele se gasesc si in terminatiile nervoase fiind implicate in jonctiunile neuromusculare.
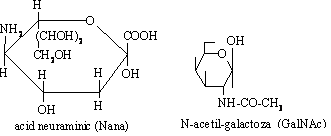
GM1 = ceramida + Gluβ 1-1) +Galβ(1-4) Nana (2-3) + GalNAc β(1-4) + Galβ(1-3)
GM2 = ceramida + Gluβ 1-1) +Galβ(1-4) Nana (2-3) + GalNAc β(1-4)
GM3 = ceramida + Gluβ 1-1) +Galβ(1-4)Nana (2-3)

Fig.5.14 Structura gangliozidelor
Acestea indeplinesc functii biologice specifice fiind raspunzatoare de proprietatile antigenice ale celulelor.
Lipopolizaharidele contin resturi de glucozamina de care se leaga catene de acizi grasi interpuse in membrana si un lant oligoglucidic expus in afara celulei avand efecte toxice pentru organismele animale (Fig.5.15).
Lantul oligoglucidic contine: glucozamina N-acetilata, manoza, glucoza, galactoza si alte oze specifice pentru microorganisme: abecoza (3,6,dideoxihexoza), L-glicero-D-manoheptoza). Din structura acestuia un fragment reprezinta miezul, comun tuturor bacteriilor, iar capatul lantului este specific fiind responsabil de reactivitatea imunologica.
Principalele proteine cu rol in contractia musculara
Miozina din filamentele musculare are structura asemanatoare -keratinei. Este alcatuita din doua lanturi grele (Mr 220 kDa) si patru lanturi usoare (Mr 20 kDa). Lanturile grele au aspectul unei "crose de golf", fiind aranjate la capatul C-terminal ca α-helix, rasucite unul in jurul celuilalt. La capatul N-terminal fiecare lant greu are un domeniu globular de dimensiuni mari unde se afla situsul de legare a ATP si se ataseaza lanturile usoare (Fig.11b).
In celulele musculare, prin cozile asociate a sute de molecule, miozina se agrega si formeaza structuri bipolare, filamente groase, miezul unitatii contractile.
In muschi, miozina este asociata actinei (Mr 42 kDa), proteina ce se gaseste insa in aproape toate celulele eucariote (Fig.11a). Moleculele de G-actina (actina globulara) se agrega si formeaza F-actina (actina filamentoasa) care, impreuna cu tropomiozina si troponina constituie filamentele fine. Si la nivelul acestor filamente exista un situs de legare si hidroliza a ATP cu rol in asamblarea filamentului.
Prin complexarea mai multor filamente fine si groase cu proteine necontractile (vimentina, desmina, -actinina, nebulina, titina etc) rezulta miofibrile (diametru 2 μ), iar din 1000 de fibrile se formeaza fibrele musculare, celule mari, multinucleate, cu diametre pana la 100 μ . Proteinele necontractile indeplinesc functii biologice specifice pentru a regla lungimea filamentelor si a controla asamblarea filamentelor.
Interactiunea actinei cu miozina se face prin legaturi slabe si numai in absenta ATP. Legarea ATP la regiunea globulara a miozinei determina o serie de modificari conformationale care au ca rezultat detasarea acesteia de F-actina din vecinatate si legarea ei de o alta molecula aflata la distanta in filamentul fin, determinand deplasarea filamentului gros de-a lungul filamentului fin (Fig.11c).
Interactiunea dintre actina si miozina trebuie controlata astfel incat contractia sa apara numai sub actiunea unui anumit semnal nervos. Tropomiozina din filamentele fine impiedica legarea miozinei. Prin eliberarea ionilor Ca2+ din reticulul sarcoplasmic mediata de stimulul nervos, troponina ii complexeaza, apar modificari conformationale ale complexului tropomiozina-troponina-filament fin, nu mai leaga miozina si se poate produce contractia musculara.
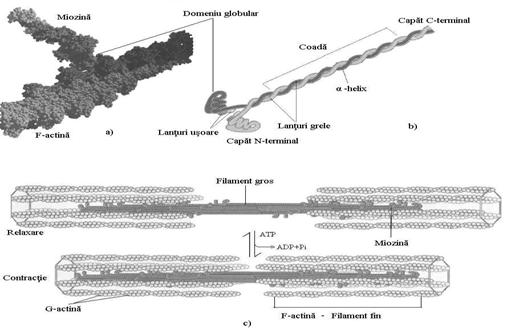
Reprezentare schematica a miozinei si a implicarii complexului actina-miozina in contractia musculara
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 3718
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2025 . All rights reserved