| CATEGORII DOCUMENTE |
| Alimentatie nutritie | Asistenta sociala | Cosmetica frumusete | Logopedie | Retete culinare | Sport |
STADIUL ACTUAL AL CUNOSTINTELOR PRIVIND PROCESUL INFLAMATOR IN DIABET
I. Molecule de adeziune - mediatori ai inflamatiei endoteliale
Mentinerea integritatii vasculare si apararea impotriva patogenilor invazivi necesita reglarea rapida a interactiilor adezive intre celulele sangelui si intre celulele din sange si peretele vascular. Controlul acestor mecanisme depinde de activarea receptorilor de adeziune care sunt deja prezenti pe celulele din sange si pe endoteliu sau expresia unor noi receptori pe suprafetele acestor celule.
Pentru a se intelege procesele implicate in reglarea migrarii leucocitelor este necesar sa se recunoasca calea prin care interactioneaza leucocitele cu endoteliul vascular. Atasarea leucocitelor, si migrarea lor ulterioara in vasculatura si in tesut necesita actiunile comune a mai multor molecule de adeziune celulara si a chemokinelor. Adeziunea celulara este una din caile prin care celulele comunica unele cu altele si este un proces complex care implica un numar mare de molecule diferite. Unele evenimente ale adeziunii celulare sunt foarte lungi ca durata si stabile, in timp ce altele sunt extrem de scurte. Interactiile stabile sunt necesare pentru ca celulele sa-si pastreze locurile lor in tesut, insa, celulele circulante au nevoie de mai multe interactii tranziente. Aceste interactii diferite sunt mediate de molecule de adeziune de diferite structuri care se lega la diferite tipuri de liganzi. Nu toate moleculele de adeziune sunt exprimate constitutiv la suprafata celulara, expresia lor fiind indusa de diferiti activatori, ca citokine, interleukine, stres oxidativ si concentratii crescute de glucoza. Activarea este indusa direct de agonist sau ca o consecinta a unei reactii de semnalizare initiata de legarea unei alte molecule de adeziune la ligandul ei specific. Astfel, adeziunea celulara si reglarea sunt procese complexe. Cele mai importante familii de molecule de adeziune sunt: integrinele, imunoglobulinele, selectinele si caderinele.
Interactia leucocitelor cu endoteliul vascular este un proces care are loc in mai multi pasi. Contactul initialal al leucocitelor cu peretele vascular poate fi un eveniment intamplator, dar ca urmare a contactului initial, are loc in continuare rostogolirea leucocitelor de-a lungul peretelui vasului adiacent regiunii lezate sau inflamate. In urma procesului de rostogolire, mediat de membrii familiei selectine, unele dintre leucocite se turtesc si adera ferm la celulele endoteliale. Aceasta alipire este mediata in principal de legarea integrinelor leucocitare de liganzii imunoglobulinici de pe endoteliu. Atat leucocitele cat si endoteliul necesita stimularea prin chemokine sau citokine proinflamatorii pentru a-si activa integrinele si a creste expresia liganzilor acestora de pe celulele endoteliale. Unele dintre aceste leucocite aderente se vor indrepta catre jonctiunile intercelulare si vor transmigra, adica vor trece printre doua celule endoteliale. Atasarea ferma a neutrofilelor la monostratul de celule endoteliale produce desfacerea jonctiunilor de ancorare (mediate de caderine). Aceste jonctiuni sunt importante pentru reglarea permeabilitatii endoteliului vascular. Trcerea leucocitelor printre doua celule endoteliale in tesuturi, la zonele inflamate, implica molecule chemoatractante si un alt set de molecule de adeziune care interactioneaza cu moleculele matricei extracelulare.
Astfel, procesul de migrare al leucocitelor din circulatie in tesut este o influentare reciproca, coordonata intre multe semnale si molecule de adeziune, in particular, selectine, chemoatractanti si integrine.
Aceste familii de proteine contin fiecare mai multi membrii (de exemplu superfamilia imuniglobuline contine 765 membrii). De regula, moleculele de adeziune au specificitate pentru substraturi particulare iar expresia lor poate fi dependenta de celula sau de stadiul de dezvoltare. Prezenta mai multor molecule de adeziune de la familii diferite pe o singura celula si specificitatea lor de legare combinata determina proprietatile adezive ale unei celule.
I.1. Familia selectinelor
Captarea
leucocitelor din fluxul de sange de catre endoteliu vascular este un exemplu
foarte special de contact celular care difera de majoritatea altor fenomene de
adeziune, pentru ca sunt invinse fortele din fluxul de sange. Pasul initial al
acestui proces este mediat de selectine care par sa fie specializate pentru
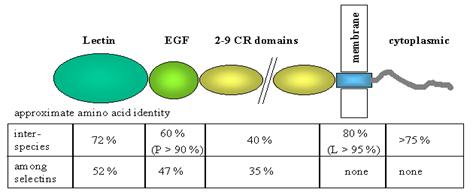
acest lucru. Selectinele sunt o familie de molecule transmembranare ce contin
un domeniu extracelular N-terminal cu omologie structurala cu lectinele
dependente de calciu, urmat de un domeniu omolog factorului de crestere
epidermal (EGF) si de un numar de 2-9 secvente repetitive consens similare cu
cele gasite in proteinele sistemului complement (figura 1). Cu numai trei
membrii (E-, L-, si P-selectina), selectinele formeaza cea mai mica si mai nou
identificata familie de molecule de adeziune celulara. Toti liganzii cunoscuti
ai selectinelor sunt glicoproteine transmembranare care prezinta structuri
oligozaharidice. Ei interactioneaza cu domeniul lectinic al selectinelor,
prezent la toti membrii acestei famlii [Bevilacqua et al., 1993]. Toate cele trei selectine pot recunoaste
glicoproteine si/sau glicolipide care contin tetrazaharidul sialyl-Lewisx
(sialyl-CD15) [Bevilacqua & Nelson 1993]. Acest tetrazaharid se gaseste pe majoritatea
celulelor circulante si este compus din acid sialic, galactoza, fucoza si
N-acetil-galactozamina. L-selectina se gaseste pe majoritatea tipurilor de
leucocite, E-selectina este specifica pentru celulele endoteliale activate si
P-selectina pe endoteliu si plachete
activate.
Figura1. Structura selectinelor. (preluata dupa Klaus Ley, 2001)
Fiecare din acesti receptori de adeziune sunt inserati printr-un domeniu transmembranar si au o coada citoplasmatica scurta. Atasarea initiala a leucocitelor, in timpul inflamatiei, este mijlocita de familia selectinelor [Springer 1995] si produce o alunecare usoara a leucocitelor de-a lungul endoteliului prin interactii tranziente, reversibile si adezive, proces numit rostogolirea leucocitelor. Afinitatea de legare a selectinelor este relativ redusa, dar suficienta pentru a incetini leucocitele si astfel pentru a realiza rostogolirea lor. In timpul rostogolirii, leucocitele pot sa fie activate de chemoatractanti, probabil crescand afinitatea receptorilor de adeziune b leucocitari pentru lganzii de pe endoteliul activat. De asemenea, prezenta unui semnal chemotactic face ca leucocitele sa se strecoare printre celulele endoteliale ale venulelor si sa migreze in centrul inflamator.
L-selectina
L-selectina este cea mai mica selectina vasculara (74-100 kDa) si este exprimata constitutiv pe granulocite, monocite si limfocite circulante. Acest membru al familiei selectinelor este cunoscut si sub alte nume ca: LECAM-1, LAM-1, Mel-14 antigen, gp 90, Leu 8/TQ-1. L-selectina este importanta pentru homingul limfocitelor si adeziunea acestora la venulele postcapilare si nodurile limfatice periferice. In plus, aceasta molecula de adeziune celulara contribuie in mare masura la capturarea leucocitelor in timpul primului pas din cascada de adeziune. In urma stimularii chemoatractante, L-selectina se exprima imediat la suprafata leucocitului, iar dupa captura acestuia este indepartata de la suprafata membranara printr-un mecanism proteolitic [Molad et al., 1994]. L-selectina interactioneaza cu patru receptori sau liganzi cunoscuti MAdCAM-1, GlyCAM-1, CD34 si PSGL-1. Impreuna cu alte molecule de adeziune celulara, functia L-selectinei si rolul ei in cascada de adeziune au fost investigate in multe experimente ce au folosit soareci transgenici. In soarecii deficienti pentru L-selectina rostogolirea leucocitelor indusa de trauma, in mezenter sau venule musculare este initial normala, dar scade in timp [Jung et al., 1996]. Astfel, s-a tras concluzia ca L-selectina este critica in pasul de rostogolire dupa trauma chirurgica si este necesara pentru recrutarea neutrofilelor in inflamatie. Cu toate astea, traficul initial al neutrofilelor pare sa nu fie afectat de absenta L-selectinei, pentru ca leucocitele periferice si neutrofilele numarate in acesti soareci au fost normale. In soarecii deficienti la L-selectine si tratati cu TNF-a, datele rezultate sugereaza ca rostogolirea leucocitelor este dependenta de P-selectina [Ley et al., 1995]. Pierderea L-selectinei la acesti soareci reduce eficienta rostogolirii mediata de E-selectina. Aceste experimente arata ca L- si P-selectina mediaza rostogolirea leucocitelor dar ca L-selectina singura nu poate indeplini aceasta functie in conditiile de viteza existente in vivo. L- si P-selectina coopereaza intr-un mod in care, in absenta P-selectinei, L-selectina trebuie sa initieze interactiile leucocitelor pentru a permite rostogolirea usoara dependenta de E-selectina. In plus, L-selectina sau P-selectina trebuie sa fie prezente sa medieze captura inainte de inceputul rostogolirii leucocitelor. Fara prezenta uneia dintre aceste doua selectine rolingul nu poate avea loc.
P-selectina
P-selectina este cea mai mare selectina cunoscuta, avand 140 kDa si se mai intalneste si sub denumirile de CD62P, GMP-140, PADGEM. Contine noua domenii repetitive consecutive si se extinde aproximativ 40nm de la suprafata endoteliului. P-selectina este exprimata in granulele a ale plachetelor activate si in corpusculii Weibel-Palade ai celulelor endoteliale [Fijnheer et al., 1996; Koedam et al., 1992]. P-selectina este exprimata la suprafata membranara dupa cateva minute de la stimularea celulelor endoteliale cu mediatori inflamatori ca histamina, trombina sau phrobol ester. Expresia P-selectinei apare de asemenea si in urma unor traume chirurgicale ce au loc de exemplu in timpul prepararii unui tesut pentru microscopie intravitala. In general, expresia P-selectinei are viata scurta, atingand maximul dupa numai 10 minute. Sinteza aditionala de P-selectina are loc in doua ore, indusa de diversi agonisti. Principalul ligand pentru P-selectina este PSGL-1 care se gaseste constitutuiv pe toate leucocitele dar mai exista si alti liganzi, ca CD24 si liganzi necaracterizati. Interactiile de scurta durata intre P-selectina si PSGL-1 permit leucocitelor sa alunece de-a lungul endoteliului venular. In soarecii deficienti pentru P-selectina, rolingul indus de trauma nu se observa initial, dar apare dupa 1-2 ore [Kunkel et al., 1996]. In acest caz, acest roling intarziat este dependent de L-selectina, iar leucocitele se rostogolesc mai repede decat in soarecii normali, indicand ca L-selectina singura nu poate efectua un roling normal in vivo.
Pe de alta parte, in soarecii deficienti la L-selectina, P-selectina mediaza rolingul leucocitelor indus de trauma. In venulele stimulate cu TNF-a, P-selectina si E-selectina tind sa aiba functii suprapuse. Astfel, la soarecii deficienti la P-selectina rolingul este redus semnificativ numai daca e blocata E-selectina iar in soarecii knokaut la E-selectina trebuie introdus un anticorp anti-P-selectina pentru a reduce rostogolirea [Kunkel EJ & Ley K 1996]. Corespunzator, in soarecii dublu deficienti pentru E- si P-selectina si tratati cu TNF-a nu se observa procesul de rostogolire al leucocitelor [Fox-Robichaud A & Kubes P 2000]. Desi P- si E-selectina par sa aiba functii suplimentare, observatiile rezultate din experimente arata ca P-selectina este responsabila pentru rolingul initial, in timp ce E-selectina permite rostogolire lenta si adeziune mai mare.
E-selectina
E-selectina este exprimata pe celulele endoteliale in conditii de inflamatie ca raspuns la tratamentul cu citokine inflamatorii [Bevilacqua et al., 1989]. Experimentele de microscopie intravitala au aratat ca functia acestei molecule este de a media rostogolirea leucocitara, si ca se suprapune in mare cu functia P-selectinei [Hickey et al., 1991; Bullard et al., 1996]. In plus la medierea rolingului leucocitar, E-selectina participa la transformarea rolingului in adeziune ferma. Soarecii deficienti pentru E-selectina au numar redus de leucocite aderate ferm in raspuns la chemoatractanti locali [Ley et al., 1998] sau la stimulare cu citokine [Milstone et al., 1998]. Acest lucru poate fi legat de vitezele de rostogolire mult mai mari existente in absenta E-selectinei.
E-selectina este exprimata in microvasele pielii in conditii normale [Keelan et al., 1994] si exista unele evidente ca E-selectina are o importanta particulara in inflamatia din piele, ajutand la recrutarea limfocitelor T specifice pielii [Picker et al., 1991]. In urma stimularii cu citokine sau LPS a celulelor endoteliale in cultura, expresia E-selectinei atinge maximul cam la 4 ore si scade catre valoarea bazala dupa 24 ore. Liganzii E-selectinei care sunt responsabili pentru interactiile din timpul rostogolirii nu sunt cunoscuti. Pentru doi liganzi candidati, PSGL-1 [Asa et al., 1995] si ESL-1 [Steegmaier et al., 1995] s-a aratat ca nu sunt necesari pentru rolingul mediat de E-selectina in orice conditii. Nu este clar daca ligandul fiziologic pentru E-selectina este o glicoproteina. In functie de nivelul de expresie al E-selectinei, viteza de rostogolire a leucocitelor variaza intre 5mm/s [Jung et al., 1998] si mm/s [Ley et al., 1998]. Pentru ca rata de disociere a E-selectinei este similara cu cea a P-selectinei [Smith et al., 1999] este foarte posibil ca E-selectina si ligandul ei, sau amandoua, sa fie exprimate mai mult decat P-selectina si PSGL-1. Viteza rolingului mediat de E-selectina este remarcabil invarianta cu rata fluxului de sange. Dat fiind ca E-selectina participa si la adeziunea ferma [Ley et al., 1998], s-a aratat ca soarecii deficienti la E-selectina si CD18 (lantul b comun al integrinelor b2 ) prezinta un defect inflamator sever care duce la moartea timpurie [Bradley et al., 2001], sugerand ca E-selectina opereaza 'in continuarea' P-selectinei, catre pasul de adeziune ferma al cascadei.
I.2. Familia integrinelor
Integrinele sunt o familie mare de glicoproteine transmemebranare heterodimerice alcatuite din doua subunitati asociate necovalent a si b care mediaza interactiile celula-celula, celula-matrice extracelulara si celula-patogen. La vertebrate s-au gasit pana in prezent 19 subunitati a integrinice diferite si 8 subunitati b [Humphries 2000] care formeaza cel putin 25 heterodimeri ab ceea ce face din integrine cea mai diversa familie de molecule de adeziune din punct de vedere structural si functional. In timp ce unele integrine par sa fie specifice pentru un singur ligand, altele recunosc mai multe proteine ale matricei extracelulare si, in timp ce interactia integrina -ligand poate depinde de o secventa de recunoastere scurta din ligand (motivul RDG din α5β1) alte integrine recunosc conformatia inteagra a ligandului [Giancotti & Ruoslathi 1999]. In celulele aderate, integrinele sunt de regula concentrate la situsurile de atasare celulara numite adeziuni focale. In aceste locuri, integrinele nu numai ca ancoreaza celulele la matricea extracelulara prin domeniul lor extracelular, dar de asemenea, prin domeniul citoplasmatic integreaza atasarea cu organizarea intercelulara a citoscheletului de actina. Ele sunt alcatuite dintr-o subunitate mare (subunitatea a) de 120-170 kDa si o subunitate mica (subunitatea b) de 90-100kDa (figura 2).
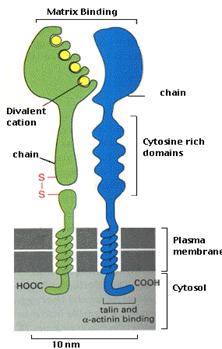
Figura 2. Structura integrinelor. (preluata dupa Klaus Ley, 2001)
Subunitatea mare contine situsuri de legare pentru cationii divalenti (Mg2+ si Ca 2+) care sunt necesari pentru functiile adezive ale integrinelor. Integrinele mamiferelor formeaza cateva subfamilii care au subunitati b comune si care se asociaza cu diferite subunitati a
Integrinele b2 sunt exprimate exclusiv pe leucocite iar dupa activare sufera o schimbare conformationala datorata fosforilarii subunitatii b. Totusi, aceasta fosforilare nu este nici necesara nici suficienta pentru activarea conformationala. Starea de activare este controlata de situsul GFFKR imediat adiacent domeniului transmembranar al subunitatii a [Song et al., 1992]. Integrinele b2 includ 4 heterodimeri diferiti CD11a/CD18 (LFA-1), CD11b/CD18 (Mac1), CD11c/CD18 (p150,95) si CD11d/CD18. O mutatie in gena ce codifica molecula CD18 are ca rezultat o boala genetica, LAD (deficienta de adeziune leucocitara). Pacientii cu LAD prezinta infectii bacteriale repetate datorita imposibilitatii recrutarii granulocitelor ca raspuns la infectii.
O alta integrina importanta, membru al subfamiliei de integrine b1 de pe lecocite este VLA-4 (CD49d/CD29). VLA-4 se leaga la ligandul sau VCAM-1 si este responsabila pentru adeziunea leucocitelor la endoteliul vascular si pentru recrutarea leucocitelor in aria inflamata.
I.3. Familia imunoglobulinelor
Imunoglobulinele sunt proteine plasmatice care includ toate moleculele anticorp cunoscute. Multe din moleculele implicate in raspunsul imun al vertebratelor au un domeniu precursor comun, si anume domeniul imunoglobulinic. Totusi, exista molecule care nu au functii imunologice, desi prezinta domenii imunoglobulinice. Toate genele care codifica aceste molecule inrudite au fost denumite superfamilia de gene imunoglobulinice. Membrii acestei familii au fost definiti prin prezenta uneia sau mai multor regiuni omoloage cu unitatea structurala de baza a moleculelor imunoglobulinice, unitatea Ig (Figura 3).
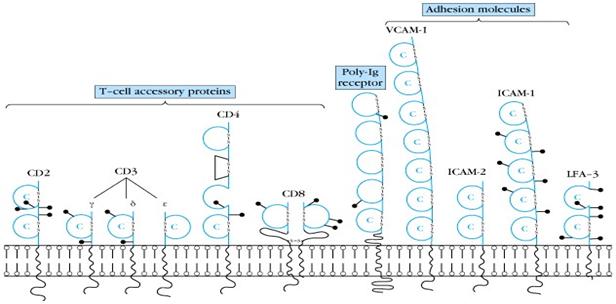
Figura 3. Structura imunoglobulinelor
Membrii familiei de molecule de adeziune celulara imunoglobuline au trasaturi genetice si structurale comune cu moleculele imunoglobulinice si contin cel putin un domeniu imunoglobulinic. Endoteliul vascular exprima moleculele familiei imunoglobulinice care actioneaza ca receptori pentru integrinele leucocitare. ICAM-1 (CD 54) si VCAM-1 (CD 106) sunt doua imunoglobuline cu o importanta particulara in cascada de adeziune.
Structura ICAM
Moleculele de adeziune intercelulara (ICAM) sunt glicoproteine ale suprafetei celulare exprimate pe o varietate de tipuri celulare, cu modele distincte de reglare genica si functii efectoare.
ICAM sunt inrudite structural cu familia imunoglobuline si sunt liganzi pentru integrinele b prezente pe leucocite, LFA-1 [Staunton et al., 1990] si MAC-1 [Smith et al., 1989]. Au fost identificate 5 molecule ICAM clasificate impreuna pentru ca au doua sau mai multe domenii comune repetitive Ig-like. Aceste domenii se gasesc in portiunea extracelulara a proteinei. In general ICAM traverseaza membrana celulara si contin o coada citoplasmatica scurta [Springer 1990]. S-a aratat ca domeniul citoplasmatic al ICAM-1 pare sa interactioneze cu proteina citoscheletala a-actinina dar nu cu talina, tensina sau vinculina [Carpen et al., 1992]. Datorita distributiei mari si reglarii specifice, ICAM-1 este cea mai studiata din cele cinci molecule ICAM. ICAM-1 (CD54) are 5 domenii Ig-like, cu primul domeniu responsabil pentru legarea la LFA-1 si al treilea domeniu responsabil pentru legarea la MAC-1 [Staunton et al., 1990; Vonderheide et al., 1994]
Desi ICAM-1 este exprimat constitutiv la nivele scazute de celulele endoteliale si unele limfocite si monocite, expresia acestei molecule este crescuta semnificativ in prezenta citokinelor (TNF, IL1, INF), a concentratiei crescute de glucoza [Huang et al., 1993] si speciilor reactive de oxigen. In functie de tipul celular, ICAM-1 participa la traficul celulelor inflamatorii, in interactii celula-celula in timpul prezentarii antigenului, in patogeneze microbiale si in evenimente de semnalizare. S-a aratat ca in functie de tipul de celula examinat, ICAM-1 activeaza kinaze specifice prin fosforilare avand drept urmare activarea factorilor de transcriptie si cresterea productiei de citokine, cresterea expresiei proteinelor membranare, producerea speciilor reactive de oxigen (ROS) si proliferare celulara.
Rolul ICAM-1 ca molecula de adeziune
Ca ligand pentru integrinele b , ICAM-1 pare sa participe in interactii leucocite-leucocite, leucocite-endoteliu, leucocite-celule epiteliale si migrare transendoteliala [Smith et al., 1989]. Migrarea neutrofilelor incepe cu o incetinire, apoi rostogolirea acestora de-a lungul suprafetei celulelor endoteliale, urmata de cresterea expresiei integrinelor β2. Adeziunea la ICAM-1 de pe celulele endoteliale precede migrarea transendoteliala a acestor celule inflamatorii. Functia ICAM-1 ca molecula de transducere a semnalului nu poate fi clar definita datorita varietatii mari de tipuri celulare examinate.
VCAM-1
VCAM-1 este membra a superfamiliei imunoglobuline si are un rol important in inflamatie, raspuns imun si evenimente de semnalizare intracelulara [Gahmberg et al., 1997]. A fost prima molecula descrisa ca molecula de adeziune endoteliala indusa de citokine. Ea poate lega integrina leucocitara VLA-4 (a b ) ce apartine subfamiliei integrinelor, pentru a recruta leucocitele la locurile cu inflamatie [Lee et al., 2001]. Forma predominanta a VCAM-1 in vivo are o regiune extracelulara N-terminala ce contine 7 domenii imunoglobulinice [Jones et al., 1995]. Expresia sustinuta a VCAM-1 in urma stimularii dureaza aproximativ 24 ore si promoveaza adeziunea limfocitelor, monocitelor, eozinofilelor si bazofilelor. De asemenea, VCAM-1 are un rol foarte important, fiind molecula care participa la recrutarea leucocitelor in regiunile aterosclerotice. Ca rezultat, VCAM-1 este privita ca tinta terapeutica importanta.
PECAM
PECAM-1 este membru al superfamiliei imunoglobuline exprimata pe suprafata plachetelor si leucocitelor, si de asemenea concentrata la jonctiunile laterale ale celulelor endoteliale. Este o glicoproteina transmembranara de 130kDa care a fost descrisa initial ca echivalentul endotelial al GP IIa (subunitatea b integrinica) un antigen de diferentiere mieloid si antigenul CD31 prezent pe suprafata monocitelor, granulocitelor, plachetelor si celulelor endoteliale. Identitatea de PECAM-1 (CD31) a fost stabilita in 1990 prin clonarea acesteia de trei grupuri diferite [Huang et al.,1993; Allport et al., 2001]. PECAM matur are un domeniu extracelular de 574 aminoacizi ce cuprinde 6 domenii omoloage imunoglobulinice, un domeniu transmembranar din 19 reziduuri si o coada citoplasmatica de 118 aminoacizi. Domeniul imunoglobulinic extracelular contine situsuri specializate care mediaza interactiile trans-homofile dintre moleculele de PECAM de pe celulele adiacente [Etzioni et al.,1999; Mizgerd et al., 1996; Wong et al., 1997], anticorpii realizati la aceasta regiune blocand efectiv migrarea transendoteliala a leucocitelor [Alon et al.,1995; DeGrendele et al., 1996; Salmi et al., 2001]. Domeniul citoplasmatic al PECAM-1 este complex, fiind codificat de 8 exoni scurti, susceptibili diferentiat la splicing alternativ, si duce la generarea de specii de ARN mesager care dau nastere la izoforme PECAM-1 distincte [Ware & Heistad 1993].
PECAM-1 este implicata in diferite procese biologice ca: transmigrarea leucocitelor, migrare celulara, angiogeneza, semnalizarea celulara si adeziune celulara. Studii functionale si biochimice au aratat ca PECAM-1 contine motive inhibitorii tirozinice imunoreceptoare (ITIMS) intracitoplasmatice care, daca sunt fosforilate mediaza functii inhibitorii [Hua et al.,1998; Henshall et al., 2001; Newman et al., 2001]. PECAM-1 mediaza interactii adezive celulare prin legarea homofila la PECAM-1 de pe celulele adiacente, implicand domeniul 1 imunoglobulinic N-terminal. In afara de legare homofila, PECAM-1 prezinta si interactii hetorofile cu liganzi diferiti, integrina a b , CD38 [Deaglio et al., 1998; Prager et al., 1996]. In celulele endoteliale PECAM-1 este implicat in formarea initiala si stabilizarea contactelor celula-celula la jonctiunile laterale ale CE, la mentinerea unei bariere de permeabilitate vasculara, modularea migrarii celulare, migrarea transendoteliala a monocitelor si neutrofilelor si formarea de noi vase de sange in angiogeneza [Albela et al.,1991; Muler et al., 1993; DeLisser et al., 1997].
JAM (molecula de adeziune jonctionala) este de asemenea membru al familiei imunoglobuline, concentrata selectiv la jonctiunile intercelulare ale celulelor endoteliale si epiteliale. S-a sugerat ca JAM contribuie la functia adeziva a jonctiunilor stranse si ca regleaza transmigrarea leucocitelor [Fanning et al., 1999]. JAM are aproximativ 32kDa prezentand doua domenii extracelulare de tip imunoglobulinic si doua situsuri de N-glicozilare. Evidentele experimentale au artat ca JAM poate media adeziunea homofila si poate influenta transmigrarea monocitelor. Aditia unui anticorp monoclonal anti-JAM in mediul de cultura al celulelor endoteliale (CE) inhiba atat transmigrarea spontana cat si cea indusa de chemokine a monocitelor. JAM este primul component molecular al jonctiunilor stanse care s-a dovedit ca are un rol direct in reglarea transportului celular imun.
I.4. Familia caderinelor
Caderinele sunt o familie de glicoproteine transmembranare care mediaza adeziunea celula-celula dependenta de calciu [Aberle et al.,1996; Gumbiner et al., 1996; Takeiki 1995].
Acesti receptori de adeziune sunt exprimati virtual pe toate tipurile celulare care formeaza tesuturi solide si sunt implicati in adeziunea intercelulara dependenta de calciu. Primele trei caderine descoperite au fost denumite dupa tipul de tesut in care au fost localizate: E-caderina (pe suprafata celulelor epiteliale), N-caderina (pe suprafata celulelor nervoase), P-caderina (pe suprafata celulelor din placenta). Caderinele sunt localizate in structurile jonctionale si anume la jonctiunile 'adherens'. In aceste jonctiuni, caderinele sunt concentrate si conectate prin domeniul lor citoplasmatic la o retea complexa de proteine citoscheletale, catenine [Hulsken et al.,1994; Leach et al., 1993; Klymkowsky & Parr 1995; Peifer 1995]. Aceste proteine citoscheletale sunt β-catenina, placoglobina, α-catenina, p120ctn, ZO-1, vinculina si α-actinina care se leaga direct sau indirect la receptorul membranar. Asocierea celula-celula mediata de caderine este reglata atat de nivelele de calciu extracelular cat si de semnalele din celula ce moduleaza stabilitatea complexelor asociate caderinelor, ducand la o concentrare mai slaba sau mai mare de caderine. S-a aratat ca fosforilarea proteinelor p120ctn si a β-cateninei influenteaza adeziunea celula-celula dependenta de E-caderina. In vivo si in vitro, mentinerea asocierilor intercelulare intre tesuturile embrionare este determinata de caderine, ele avand un rol important in morfogeneza [Gumbiner 1996; Huber et al., 1996; Randcht 1994; Takeiki 1995]. Prin interactiile de tip homofilic dintre ele au un rol important in sortarea diferitelor linii celulare in embriogeneza, stabilind polaritatea celulara, mentinerea morfologiei tisulare si diferentierii celulare. In vitro, indepartarea Ca2+ extracelular sau tratarea cu anticorpi anti-caderine dezmembreaza tesutul, in timp ce anticorpii impotriva altor molecule de adeziune nu au acest efect.
Caderinele clasice au o structura de baza comuna, constand dintr-un domeniu extracelular, care consta din cinci domenii repetitive ce permit acestora sa dimerizeze cu caderinele vecine in prezenta Ca2+ [Pertz et al., 1999], o portiune transmembranara si un domeniu citoplasmatic (figura 4). Regiunea citoplasmatica se leaga direct la trei proteine omoloage ce apartin familiei "armadillo" (b-catenina, placoglobina si p120). b-catenina si placoglobina se leaga la a-catenina si mediaza legarea complexului caderina-catenina la citoscheletul de actina.
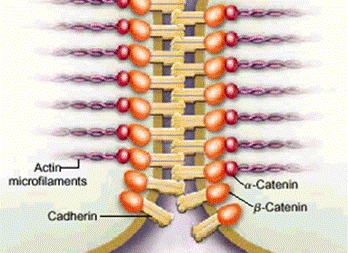
Figura 4. Structura caderinelor
Principalele caderine exprimate de endoteliu sunt caderina vasculara endoteliala (VE-caderina) si N-caderina dependenta de calciu [Dejana 1996; Lampugnani & Dejana 1997; Rubin 1992]. VE caderina este specifica celulei si este localizata strict la jonctiunile intercelulare ale tuturor tipurilor celulare ale endoteliului, in vivo si in vitro [Dejana 1996; Lampugnani & Dejana 1997]. Comparativ cu caderinele clasice, secventa aminoacidica a VE caderinei prezinta diferenta considerabile (doar 23% omologie cu E, N si P [placental] caderinele). N-caderina este prezenta in cantitati importante in endoteliu, dar, surprinzator ea nu este concentrata la jonctiunile celula-celula si ramane difuza pe membrana celulara [Salomon 1992]. Se speculeaza ca, in endoteliu, VE si N-caderina au roluri diferite; in timp ce VE caderina promoveaza interactii homofile intre celulele endoteliale, N-caderina poate fi responsabila de ancorarea endoteliului la alte tipuri celulare inconjuratoare ce exprima N-caderina, ca celule musculare netede sau pericite.
I. Chemokine
Chemokinele constituie o familie de cytokine chemotactice, inrudite structural care au fost clasificate in subgrupe (CC, CXC, C, CXXXC) in functie de pozitia cisteinelor N-terminale. Acestea sunt molecule prinflamatoare mici (8-12 kDa), inductibile, secretate care sunt implicate intr-o varietate de raspunsuri imune si inflamatorii, actionand in primul rand ca chemoatractanti si activatori de tipuri specifice de leucocite [Baggiolini et al. 1997; Schall 1994; Mackay 1997]. Ele sunt citokine multi-potente care localizeaza si amplifica inflamatia prin inducerea chemotaxiei si activarea celulelor din locurile inflamate. De asemenea, chemokinele sund mediatori esentiali ai traficului leucocitar normal. Astfel, aceste molecule joaca un rol critic in migrarea directa a leucocitelor din sange in tesut. Sunt aproape exclusiv secretate (exceptie facand fractalkina care se gaseste si in forma solubila si transmembranara) si actioneaza ca mesageri extracelulari pentru sistemul imun. Toate celulele nucleate si toate tesuturile pot exprima cel putin cateva chemokine. Astfel, chemokinele joaca un rol critic in multe procese patofiziologice ca: raspunsuri alergice, boli infectioase si autoimune, angiogeneza, inflamatie, cresterea tumorala si dezvoltare hematopoietica. Aproximativ 80% din chemokine au intre 66-78 aminoacizi in forma lor matura.
Spre deosebire de hormonii endocrini clasici, care sunt produsi in general in organe distincte si regleaza raspunsuri fiziologice normale, functionarea zilnica a tesuturilor, citokinele au cu adevarat rol in tesuturi doar atunci cand acestea sufera provocari sau modificari fiziologice majore. Astfel de evenimente au loc in timpul infectiilor si traumelor tisulare, iar citokinele joaca un rol major in apararea si repararea tesuturilor in timpul acestor evenimente. In plus la reglarea celulara a sistemului imun adaptiv si innascut, ele regleaza cresterea si diferentierea celulara, influenteaza cersterea embrionului si dezvoltarea fetusului si pot fi importante si in bolile non-imunologice [Muller 2002].
Unii membrii ai acestei familii au fost identificati initial pe baza activitatilor lor biologice, in timp ce altii au fost descoperiti folosind tehnici de hibridizare sau strategii de clonare. Membrii familiei de chemokine prezinta intre 20% pana la 90% identitate in secventa aminoacidica. Asa cum am amintit la inceput, in functie de pozitia celor 4 cisteine conservate in lantul polipeptidic, au fost definite patru clase de chemokine (figura 5):
- chemokine CXC care au un aminoacid intre primele doua cisteine conservate;
-chemokine CC la care primele doua cisteine conservate sunt adiacente;
-chemokine C care pierd doua (prima si a treia) din cele patru reziduuri cisteinice conservate;
-chemokine CX3C care au trei aminoacizi intre primele doua cisteine conservate.
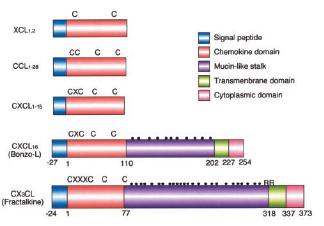
Figura 5. Structura chemokinelor (dupa Umehara H
Subfamilia CXC poate fi impartita la randul ei in doua subfamilii:1) CXC ce au caracteristic o secventa de trei aminoacizi ELR (acid glutamic-leucina-arginina) imediat langa prima cisteina conservata, langa capatul amino-terminal; 2) CXC fara domeniul ELR. S-a artat ca multe din chemokinele CXC care contin domeniul ELR sunt chemotactice pentru neutrofile in timp ce chemokinele non-ELR sunt chemotactice pentru limfocite. In contrast, chemokinele CC sunt chemotactice pentru monocite, limfocite T si B, celule dendritice, celule NK, eozinofile si bazofile dar nu neutrofile (figura 6). Unica chemokina C, limfotactina, este chemotactica pentru limfocite. Singurul membru al clasei CX3C, fractalkina este singura chemokina membranara, declanseaza adeziunea celulelor T si monocitelor [Bazan et al., 1997; Pan et al., 1997]
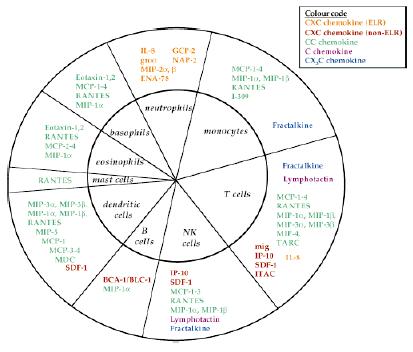
Figura 6. Specificitatea chemoatractanta a diferitelor chemokine pentru celula tinta. (Gale and McColl SR
Chemokinele se leaga la heparina si glicozaminele de la suprafata celulelor [Tanaka, Y et al. 1993, Schall T et al. 1994]. Imobilizarea chemokinelor la proteoglicanii sau alte componente ale suprafetei celulare este importanta pentru mentinerea gradientului chemokinic necesar activarii, diapedezei si migrarii leucocitelor in tesut.
|
|
|
Fig. 7. Receptori chemokinici |
Receptorii chemokinici
Chemokinele mediaza activitatile lor prin legarea la receptori de pe suprafata celulelor tinta care apartin familiei mari de receptori ce traverseaza membrana de 7 ori, cuplati cu proteina G (figura 7) [Baggiolini, M. et al. 1997]. Receptorii chemokinici care leaga chemokine CXC se numesc CXCR iar receptorii care leaga chemokine CC se numesc CCR. Diferiti receptori au specificitate pentru mai multi liganzi. Exista cel putin 17 receptori chemokinici cunoscuti, multi dintre ei prezentand proprietati de legare variate, diferite chemokine putand actiona prin acelasi receptor.
Membrii importanti ai chemokinelor
II. 1. MCP-1
MCP-1 este un membru a familiei CC de chemokine, fiind un activator si chemoatractant puternic pentru monocite. Chemokina MCP-1 este exprimata de o varietate de tipuri celulare, incluzand monocite, fibroblasti, CE si CMN ca raspuns la diversi stimuli [Cushing et al., 1990; Rollins et al., 1990]. Desi mecanismul migrarii monocitelor de-a lungul endoteliului vascular la situsurile inflamate nu este foarte bine caracterizat, se atribuie un rol important moleculei MCP-1 [Oppenheim et al., 1991]. MCP-1 are activitate puternic chemoatractanta asupra monocitelor, producand rapid roligul monocitelor, aderarea ferma la CE si infiltrarea in spatiul subendotelial; induce expresia TF, a speciilor reactive de oxigen si a diferitelor gene proinflamatorii. S-a demonstrat ca MCP-1 creste expresia de integrine de pe membranele celulelor tinta, favorizand adeziunea intercelulara si procesul de diapedeza [Vaddi et al., 1994]. Celulele care sufera procesul de diapedeza sunt apoi atrase la situsul inflamator de gradientul de concentratie al MCP-1 si al altor chemokine.
Multe studii au aratat semnificatia clinica a MCP-1 in formarea si ruptura placii. Expresia MCP-1 de catre macrofage promoveaza ateroscleroza prin cresterea numarului de macrofage in placa, si acumularea de lipide oxidate in soarecii deficienti apoE [Reckless et al., 2001]. Studii care au folosit hibridizarea in situ au demonstrat acumularea crescuta a MCP-1 mRNA in regiunile necrotice ale aterosclerozei umane, desi MCP-1 mRNA nu a fost gasit in arterele normale [Nelken et al., 1991]. Un studiu imunohistochimic releva ca CE si macrofagele subendoteliale sunt surse majore de MCP-1 in leziunile aterosclerotice timpurii [Takeya et al., 1993]. Mai intai, CE exprima MCP-1 care produce influxul initial al monocitelor in spatiul subendotelial [Takashashi et al.,1995]. Apoi, monocitele/ macrofagele infiltrate exprima MCP-1 care atrage in continuare influxul monocitelor in placa. Exista studii care au aratat ca MCP-1 a fost indus in primul rand in medie, de celulele musculare neointimale dar si de monocite/ macrofage din leziunile aterosclerotice ale animalelor cu ateroscleroza indusa prin dieta [Weber et al., 2004].
Nivelele circulante de MCP-1 sunt crescute la pacientii cu sindrom coronarian acut (ACS) [Simon et al., 2000] si la pacientii cu infarct miocardic [Lee et al., 1999]. Insa, nivelele plasmatice, atat de MCP-1 [Hojo et al., 2002; Mazzone et al., 2001] cat si de factor tisular (TF) au fost mai mari la pacientii cu ACS decat la cei cu angina stabila.
Dat fiind rolul foarte important al monocitelor in procesul de formare al leziunii, nu este surprinzator ca dovezile directe pentru rolul critic al MCP-1 in aterogeneza au venit de la experimentele care au facut deletie genetica a MCP-1 sau receptorului CCR2. Astfel, absenta MCP-1 in soarecii deficienti la receptorul LDL protejeaza soarecii de dezvoltarea leziunilor aterosclerotice [Gu et al., 1998]. Similar cu rezultatele obtinute prin indepartarea genei MCP-1,
s-a aratat ca indepartarea genei CCR2 in soarecii apoE-/- duce la reducerea semnificativa a leziunii aterosclerotice [Boring et al., 1998]. Acest rezultat a fost confirmat independent de mai multe laboratoare.
Blocarea expresiei MCP-1 poate fi o strategie folositoare impotriva aterosclerozei si bolilor arteriale coronariene. Neutralizarea MCP-1 cu anti-MCP-1 inhiba hiperplasia neointimala a leziunilor arterilale la sobolani [Dawson et al., 1999]. De asemenea, a fost dezvoltata o noua strategie impotriva aterosclerozei cu ajutorul unei gene a MCP-1 mutanta, cu deletie N-terminala [Egashira et al., 2000]. Mutantul se leaga la receptorul MCP-1, CCR2 si blocheaza chemotaxia mediata de MCP-1. Acest mutant a fost introdus in muschiul scheletal al soarecilor apoE deficienti [Ni et al., 2001], ceea ce a blocat efectiv activitatea MCP-1 si formarea leziunii aterosclerotice, fara modificari ale concentratiei lipidice din ser. Aceste studii arata ca interferenta cu o singura chemokina poate avea un efect dramatic pentru progresia bolii.
II. 2. Fractalkina
Fractalkina sau neurotactina - o chemokina ce apartine subfamiliei CXXXC, identificata recent, are o arhitectura unica, primele doua resturi de cisteina fiind despartite de trei amninoacizi [Pan et al., 1997, Imai et al., 1997]. Spre deosebire de celelalte chemokine care sunt secretate, fractalkina este o proteina membranara, care contine un domeniu chemokinic la capatul amino-terminal legat la o structura mucin-like lunga (figura 5). Expresia genei umane a fractalkinei este mai abundenta in creier si inima, dar este de asemenea prezenta la nivele scazute si in alte tesuturi. Expresia fractalkinei in celulele enoteliale, fibroblaste si celulele microgliale este crescuta de semnale inflamatorii [Pan et al., 1997]. Recent, s-a aratat ca fractalkina are un rol important in adeziunea si migrarea monocitelor si limfocitelor TH1, functionand mai degraba ca o molecula de adeziune intre monocite si CE decat factor chemotactic [Goda et al., 2000]. Forma solubila a fractalkinei este eliberata de la suprafata membranara, printr-un proces de proteoliza de catre enzima convertoare a TNFa, [Garton et al., 2001, Tsou et al., 2001], aceasta forma prezentand activitate chemotactica eficienta pentru monocite, celule NK si T [Bazan et al., 1997]. Ambele forme ale fractalkinei umane, solubila sau legata, sunt chemoatractante pentru monocite si limfocite, dar nu neutrofile, in vitro. Un alt studiu recent arata ca fractalkina poate induce adeziunea intre monocite si celule endoteliale nu numai datorita functiei adezive ci si prin cresterea aviditatii integrinelor pentru ligandul lor [Fong et al., 1998] (figura 8).
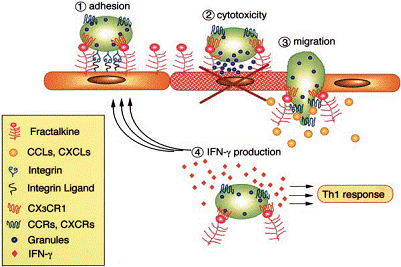
Figura 8. Modelul de adeziune al leucocitelor, dependent de fractalkina. Interactia fractalkina-receptor (CX3CR1) si integrina-receptor duce la adeziunea ferma. Celule ce exprima CX3CR1 sunt monocite, celule NK si cellule T. Cand aceste celule sunt activate de fractalkina legata la membrana se pot produce lezari in celulele endoteliale vecine. Fractalkina legata de membrana creste efectul altor chemokine asupra migrarii in tesut a celulelor ce exprima CX3CR1. Celulele transmigrate ce exprima CX3CR1 sunt activate de fractalkina, produc IFN-γ, ducand la raspuns Th1. IFN- γ creste de asemenea expresia de fractalkina in celulele endoteliale si CMN, indicand un sistem feedback paracrin (dupa Umehara et al 2004).
Inainte de identificarea si descrierea fractalkinei, se presupunea ca toate chemokinele sunt secretate ca molecule solubile care trebuie sa se asocieze cu proteoglicanii de la suprafata celulara si cu componentele matricii extracelulare, ca glcozaminoglicanii, pentru a intretine un gradient chemokinic local. Legarea chemokinei la receptorul ei specific de pe suprafata celulara duce la generarea unui semnal intracelular printr-un complex Ga, care are drept rezultat procesul de chemotaxie. Dupa aceasta asociere, interactia dintre chemokine si receptorii lor specifici de pe leucocite declanseaza activarea membrilor familiei de molecule de adeziune integrine, printr-un mecanism dependent de proteina G [Moser & Loetscher 2001, Gerard & Rollins 2001]. In cazul fractalkinei, domeniul chemokinic este prezentat la suprafata lantului mucinic din exteriorul celulei, fractalkina functionand ca molecula de adeziune [Imai et al., 1997], fara sa mai fie necesara asocierea cu proteoglicani sau glicozaminoglicani. Intr-adevar, celulele care exprima receptorul pentru fractalkina (CX3CR1) leaga rapid si cu afinitate mare fractalkina de la suprafata celulelor, atat in conditii statice cat si in conditii de flux fiziologic [ Imai et al. 1997, Fong et al., 1998, Goda et al., 2000]. Astfel, fractalkina poate facilita extravazarea leucocitelor circulante mediind adeziunea celulara, inlocuind sau cooperand cu pasii clasici de adeziune, procesul defasurandu-se mai rapid decat in calea clasica de adeziune [Umehara et al., 2001, Haskell et al. 1999].
Exista multe dovezi care sugereaza ca fractalkina poate fi implicata in ateroscleroza si in patofiziologia cardiovasculara. Nivele crescute de fractalkina au fost observate in arterele umane cu leziuni aterosclerotice avansate [Senaratne et al., 2001]. Analiza leziunilor aterosclerotice umane au demonstrat prezenta fractalkinei in regiuni ale leziunii care coincideau cu acumularea macrofagelor [Greaves et al, 2001] Intr-un studiu imuno-histochimic recent, s-a aratat ca fractalkina este exprimata in arterele coronariene aterosclerotice, dar nu in arterele normale, in timp ce receptorul acesteia, CX3CR1 este exprimat in toate vasele [Wong et al., 2002]. De asemenea, s-a aratat ca expresia frctalkinei este crescuta in leziunile aterosclerotice ale soarecilor apo E deficienti (apoE-/-) si ca daca acesti soareci sunt deficienti si la receptorul CX3CR1, formarea leziunilor aterosclerotice cu acumulare de macrofage este redusa [Lesnik et al., 2003, Combadiere et al., 2003]. In plus, s-a aratat ca polimorfismul genic la aminoacizii 249 si 280 din CX3CR1 uman este un factor de risc genetic pentru bolile coronariene [Moatti et al., 2001, MacDermott et al., 2001].
Aceste studii au stbilit clar un rol pentru fractalkina si receptorul ei in ateroscleroza. Dat fiind ca fractalkina poate actiona atat ca o chemokina cat si ca o molecula de adeziune, ar fi interesant sa se descopere care aspect al actiunii fractalkinei este mai important in ateroscleroza.
|
Politica de confidentialitate | Termeni si conditii de utilizare |

Vizualizari: 2618
Importanta: ![]()
Termeni si conditii de utilizare | Contact
© SCRIGROUP 2025 . All rights reserved